Навигация
Эффективный диаметр молекул воздуха: d = … м
6. Эффективный диаметр молекул воздуха: d = … м
![]()

![]()
Цель работы:
Углубление теоретических представлений об энтропии, экспериментальное наблюдение процесса плавления и кристаллизации и получение навыков измерения изменения энтропии.
1. Теоретическая часть
Термодинамический процесс обратим, если, протекая в обратном направлении, он возвращает систему в исходное состояние без затрат энергии (упругий удар, колебания маятника в отсутствии сопротивления, идеализированный цикл Карно). Большинство процессов в технике – необратимы или, по крайней мере, содержат этапы, являющиеся необратимыми (неупругий удар, процессы с трением, диффузия, теплообмен). Энтропия является количественной мерой степени необратимости процесса.
Из равенства КПД тепловых двигателей и термического КПД обратимого цикла Карно
![]() (1)
(1)
можно получить выражение
![]() (2)
(2)
 |
Это выражение означает, что количество теплоты, полученное или отданное телом при обратимом процессе, пропорционально температуре. Отношение Q/T называется приведенным количеством теплоты. Сумма приведенных количеств теплоты при любом обратимом процессе равна нулю, что в дифференциальной форме имеет вид
![]() ,
, ![]() (3)
(3)
причем интеграл берется по замкнутому контуру (круговой процесс). В каждом цикле кругового процесса все термодинамические параметры принимают исходные значения, т.е. их изменение равно нулю. В этом случае равна нулю и сумма приведенных количеств теплоты, что позволяет ввести термодинамический параметр состояния энтропию S, как некоторую функцию состояния, дифференциал которой
![]() (4)
(4)
Если некоторая термодинамическая система обратимо переходит из состояния 1, характеризующегося параметрами р1, V1, Т1, в состояние 2 с параметрами р2, V2, Т2, то изменение энтропии системы при таком переходе может быть вычислено по формуле
![]() , (5)
, (5)
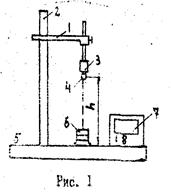
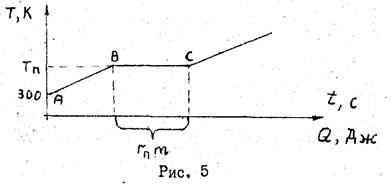
где dQ — элементарный приток теплоты в систему, Т - термодинамическая температура всей системы. Интеграл берется вдоль «траектории» процесса, например абс при нагревании и плавлении, как показано на рисунке 1.
Возможны следующие три случая:
а) DS=0 – процесс обратим, может протекать как в прямом, так и в обратном направлениях;
б) DS>0 - процесс необратим, самопроизвольно протекает только в одном направлении
в) DS<0 - процесс самопроизвольно протекать не может, необходим подвод энергии извне.
2-й закон термодинамики с использованием понятия энтропии формулируется так:
Все процессы в природе протекают в направлении увеличения энтропии, энтропия замкнутой системы не может самопроизвольно уменьшаться.
В статистической физике энтропию связывают с термодинамической вероятностью состояния системы – с числом способов, которыми может быть реализовано данное состояние макроскопической системы. Согласно Больцману энтропия системы и термодинамическая вероятность связаны между собой следующим соотношением
S=klnW, (6)
 |
где k – постоянная Больцмана. Энтропия является мерой неупорядоченности системы. 2. Экспериментальная часть Установка собрана по схеме, показанной на рисунке 2. Она состоит из электронагревателя малой мощности 2 (трубчатая муфельная печь), питание которого осуществляется через понижающий трансформатор 3. В стеклянной пробирке находится небольшой кусочек олова известной массы 1. Пробирка закреплена в штативе и может опускаться в нагреватель или подниматься из него. Температуру олова измеряют дифференциальной термопарой. Она состоит из двух термопар, включенных «навстречу» так, что милливольтметр показывает разность термоЭДС. При этом температура t1 «холодного спая» термопары должна быть постоянной и вполне определенной, для чего этот спай термопары рекомендуется погружать в тающий лед. Искомая температура t2 определяется по градуировочному графику этой термопары или с помощью градуировочного коэффициента. Используемая в данной работе термопара в требуемом интервале температур имеет градуировочный коэффициент a =19,5 град/мВ.
Если «холодный» спай термопары находится не в тающем льду, а в воздухе, то к полученным из градуировки результатам необходимо приплюсовать комнатную температуру. В качестве электроизмерительного прибора используется мультиметр, который включается на измерение постоянного напряжения на пределе 200 мV.
В данной лабораторной работе определяется изменение энтропии, происходящее при нагревании и плавлении (или при охлаждении и затвердевании) определенной массы олова.
Возрастание энтропии при нагревании можно объяснить возрастанием энергии колебательного движения атомов олова в кристаллической решетке, что приводит к увеличению возможных микросостояний и, следовательно, к росту энтропии, как меры неупорядоченности системы. При плавлении энтропия системы возрастает дополнительно за счет неупорядоченности пространственного распределения атомов в жидкой фазе.
Если первоначально температура олова равна комнатной, то при подведении теплоты олово сначала нагревается до температуры плавления, потом плавится при постоянной температуре. Изменение энтропии на первом этапе – в процессе нагревания, равно:
 (7)
(7)
где Тпл - температура плавления, Тн—начальная температура кристаллической фазы, с - удельная теплоемкость олова: с = 2,3 • 102 Дж/(кг ×К), m - масса олова.
На втором этапе - при плавлении, изменение энтропии определяется по формуле:
![]() (8)
(8)
где l — удельная теплота плавления (для олова l=5,85×104 Дж/кг).
Полное изменение энтропии равно:
![]() (9)
(9)
Эта величина положительна DS >0, если рассматриваемый процесс сопровождается притоком теплоты в систему, т.е. при нагревании и плавлении. При кристаллизации и охлаждении DS<0. Для вычисления DS надо знать параметры, входящие в (9), в частности, необходимо измерить температуру плавления и температуру кристаллизации олова.
Измерения и обработка результатов
1. Изучите описание экспериментальной установки. При работе особое внимание уделить технике безопасности:
· Включайте нагреватель только с разрешения преподавателя.
· Не касайтесь металлических деталей установки во время его работы. Опасайтесь ожогов.
· Прежде, чем производить любые манипуляции с прибором выньте вилку трансформатора из розетки.
2. Подготовьте прибор к работе. Для этого опустите пробирку с оловом в горловину печи. Подключить мультиметр к гнездам термопары, выставив его на 200mV постоянного напряжения.
3. Включите прибор (с разрешения преподавателя). Через каждые 20 –30 секунд записывайте показания мультиметра. Данные заносите в таблицу 1 отчета. Когда милливольтметр покажет 12 – 13 мВ, процесс нагревания остановите, отключив электропечь.
4. Для охлаждения образца поднимите его и отведите в сторону от электропечи. Для этого отверните винт крепления муфты штатива, поверните держатель пробирки и закрепить его в новом положении.
5. Произведите измерения температуры в процессе охлаждения образца. Для этого вновь необходимо отмечать показания милливольтметра через каждые 20-30 секунд. Этот процесс завершите при показаниях милливольтметра 4 – 5 мВ. (таблица 2)
6. Пользуясь градуировочным коэффициентом, переведите показания милливольтметра в градусы Цельсия с учетом комнатной температуры. Заполнить соответствующую строку в таблицах 1 и 2.
7. По полученным результатам постройте графики изменения температуры олова со временем tо=f(t). Желательно, чтобы в верхней части графики нагревания и охлаждения кончались и начинались из одной точки.
8. Вновь включите электропечь и повторно снимите данные для построения кривых нагревания-плавления и кристаллизации-охлаждения олова. Заполнить таблицы 3 и 4. Постройте на прежней координатной сетке новые графики tо=f(t). По горизонтальным участкам всех четырех кривых определите среднее значение температуры фазовых переходов: плавления Тпл и кристаллизации Ткр (по шкале Кельвина).
9. По данным эксперимента, используя выражения (7-9), вычислите:
· Изменение энтропии DS1 данного образца олова при изменении температуры от комнатной до температуры плавления олова.
· Изменение энтропии этого образца DS2 при плавлении олова.
· Полное изменение энтропии в процессе нагревания и плавления образца.
· Изменение энтропии DS3 данного образца олова при кристаллизации образца.
· Изменение энтропии DS4 данного образца олова при охлаждении образца от температуры кристаллизации до конечной температуры.
· Полное изменение энтропии образца при его кристаллизации и охлаждении.
Контрольные вопросы
1. Какими энергетическими превращениями сопровождается процесс плавления? Процесс кристаллизации?
2. Приведите примеры обратимых и необратимых термодинамических процессов.
3. Каков физический смысл «приведенной теплоты»? Почему в необратимых процессах сумма приведенных количеств теплоты не равна нулю?
4. Почему имеет смысл изменение энтропии, а не ее значение?
5. Каков вероятностный смысл понятия энтропия? Приведите примеры.
6. Как рассчитать изменение энтропии при нагревании? При фазовом переходе в веществе?
7. Каков принцип действия термопары? Дифференциальной термопары?
Отчет по лабораторной работе № 5
«Изучение изменения энтропии в неизолированной системе»
выполненной студент . . . . . курса, ...... Ф. И. ...........
группа …. «…»…………. 200...г.
Цель работы: .............................................................................................................................
Масса образца m = .... кг
Удельная теплоемкость олова с = .... Дж/кг×К
Удельная теплота плавления олова l = ... Дж/кг
Комнатная температура tк = ... °С
Таблица 1
| t, c | |||||||||||||||||||
| U, мВ | |||||||||||||||||||
| t°C |
Таблица 2
| t, c | |||||||||||||||||||
| U, мВ | |||||||||||||||||||
| t°C |
Таблица 3
| t, c | |||||||||||||||||||
| U, мВ | |||||||||||||||||||
| t°C |
Таблица 4
| t, c | |||||||||||||||||||
| U, мВ | |||||||||||||||||||
| t°C |
 |
Расчет изменения энтропии
При нагревании образца: Тн = ... К, Тпл = ... К, DS1 = ... Дж/К
При плавлении образца: Тпл = ... К DS2 = ... Дж/К
Полное изменение при нагревании и плавлении: DS = ... Дж/К
При кристаллизации образца: Ткр = ... К, Тк = ... К, DS3 = ... Дж/К
При охлаждении образца: Ткр = ... К, Тк = ... К, DS4 = ... Дж/К
Полное изменение при кристаллизации и охлаждении: DS = ... Дж/К
Выводы: ………………………………………………………………………………………..
[1] Анализ формулы (13) показывает наличие минимума у периода колебаний при ml2=J0.
[2] Оценка погрешности измерения производится по данным первого опыта с указанием погрешностей всех величин, входящих в расчетную формулу. В окончательный результат вносится среднее по всем опытам значение вязкости.
Похожие работы
... изменение. 3. Что такое термодинамическая вероятность состояния (статистический вес). 4. Статистический смысл изменения энтропии. 5. Первый закон термодинамики. 6. Вывод рабочей формулы (36) данной работы. 7. Второй закон термодинамики и его статистический смысл. 6. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ И УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ МЕТАЛЛА Цель работы Исследовать фазовый переход первого рода ...
... случайность, спонтанность непредсказуемость развития процесса (своего рода физический экзистенциализм), и в силу этого он далек от парадигмы абсолютности. Рассмотрим уровневый подход на примере энергии. Сегодня основные виды энергии в физике рассматриваются по парам: потенциальная – кинетическая, электрическая – магнитная, тепловая – механическая, причем каждая пара рассматривается автономно, ...
... в 2 раза. 180. Найти относительную скорость движения двух частиц, движущихся навстречу друг другу со скоростями u1 = 0,6×c и u2 = 0,9×c. II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул (макроскопические системы ...
... . Фронт волны. Интерференция волн. Принцип Гюйгенса. Дифракция волн. Уравнение бегущей волны. Стоячие волны. Звуковые волны. Скорость звука. Громкость и высота звука. II. Молекулярная физика и термодинамика II.1. Основы молекулярно-кинетической теории Основные положения молекулярно-кинетической теории и их опытное обоснование. Броуновское движение. Массы и размеры молекул. Моль вещества. ...



0 комментариев