Навигация
Теоретическая часть
1. Теоретическая часть
![]() Макроскопическое движение, возникшее в жидкости или газе под действием внешних сил, постепенно прекращается. Очевидно, что это происходит под действием сил сопротивления,
существующих внутри жидкостей и газов. Силы такого внутреннего трения присущи всем реальным жидкостям и газам и составляют основу понятия вязкости.
Макроскопическое движение, возникшее в жидкости или газе под действием внешних сил, постепенно прекращается. Очевидно, что это происходит под действием сил сопротивления,
существующих внутри жидкостей и газов. Силы такого внутреннего трения присущи всем реальным жидкостям и газам и составляют основу понятия вязкости.
1.1. Вязкость жидкостей
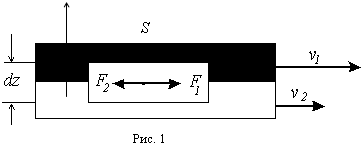 |
Причину возникновения сил вязкого трения в жидкостях можно пояснить с помощью рисунка 1. Пусть два слоя жидкости, середины которых отстоят друг от друга на расстоянии dz, имеют скорости v1 и v2. Co стороны слоя, который движется быстрее, на слой, который движется медленнее, действует ускоряющая сила F1. Наоборот, на быстрый слой действует тормозящая сила F2 со стороны медленного слоя. Эти силы, направленные по касательной к слоям, называются силами внутреннего трения. И. Ньютон предложил для их расчета следующую формулу
![]() , (1)
, (1)
где dv/dz- градиент скорости движения слоев в направлении, перпендикулярном трущимся слоям, S - площади соприкасающихся слоев, h - динамическая вязкость (вязкость) жидкости или газа или коэффициент внутреннего трения. Динамическая вязкость - характеристика данного вещества, численно она равна силе трения, возникающей между двумя слоями этой жидкости площадью по 1 м2 каждый при градиенте скорости, равном 1 м/с на метр. Размерность коэффициента вязкости ![]() . В некоторых случаях принято
пользоваться так называемой кинематической вязкостью, равной динамической вязкости жидкости, деленной на плотность жидкости
. В некоторых случаях принято
пользоваться так называемой кинематической вязкостью, равной динамической вязкости жидкости, деленной на плотность жидкости ![]() .
.
В жидкостях внутреннее трение обусловлено действием межмолекулярных сил. Расстояния между молекулами жидкости сравнительно невелики, а силы взаимодействия значительны. Молекулы жидкости, подобно молекулам твердого тела, колеблются около
положения равновесия, но эти положения не являются постоянными. По истечении некоторого времени молекула скачком переходит в новое положение. Это время называется временем «оседлой жизни» молекулы. Среднее время «оседлой жизни» молекул называется временем релаксации t. Вязкость жидкости обусловлена силами межмолекулярного взаимодействия, характерными для каждого вещества. Вещества с малой вязкостью - текучи, и наоборот, сильно вязкие вещества могут иметь механическую твердость, как, например, стекло. Вязкость существенно зависит от количества и состава примесей, а также от температуры. С повышением температуры время релаксации уменьшается, что обуславливает рост подвижности жидкости и уменьшение ее вязкости.
1.2. Вязкость газовВязкость газов, в отличие от жидкостей, увеличивается при повышении температуры. Различный характер зависимости вязкости газов и жидкостей от температуры указывает на различный механизм их возникновения, хотя формула Ньютона одинаково справедлива и для обоих этих состояний.
![]()


![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Рассмотрим, как возникает внутреннее трение в газах. В отличие от жидкостей здесь силы внутреннего трения возникают в результате микрофизического процесса передачи импульса от одного слоя газа к другому. Переносчиками импульса выступают молекулы газа.
Рассмотрим, как возникает внутреннее трение в газах. В отличие от жидкостей здесь силы внутреннего трения возникают в результате микрофизического процесса передачи импульса от одного слоя газа к другому. Переносчиками импульса выступают молекулы газа.
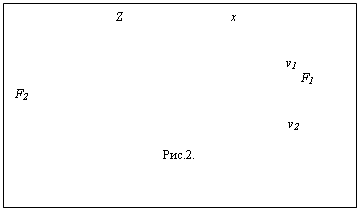
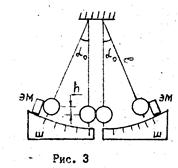
Выделим в движущемся потоке газа вдоль вектора скорости два параллельных соприкасающихся слоя. Пусть скорости их движения по величине и направлению таковы, как показано на рисунке 2. Имеющиеся в тепловой скорости, а, следовательно, и в импульсе молекул составляющие рx в рассматриваемых слоях неодинаковы. Молекулы, находящиеся в более медленном, «нижнем», слое имеют меньшую составляющую импульса рx и, попав в «верхний» слой, затормаживают его. «Верхние» же молекулы, наоборот, переносят импульс больший, чем имеют молекулы «нижнего» слоя, и поэтому ускоряют этот слой.
 Вязкость различных газов неодинакова и тем больше, чем больше молекулярная масса газа. Она увеличивается также с повышением давления, т.е. концентрации молекул, и температуры. Чем выше температура газа, тем интенсивней происходит обмен молекулами между его слоями, тем лучше работает механизм внутреннего трения.
Вязкость различных газов неодинакова и тем больше, чем больше молекулярная масса газа. Она увеличивается также с повышением давления, т.е. концентрации молекул, и температуры. Чем выше температура газа, тем интенсивней происходит обмен молекулами между его слоями, тем лучше работает механизм внутреннего трения.
Похожие работы
... изменение. 3. Что такое термодинамическая вероятность состояния (статистический вес). 4. Статистический смысл изменения энтропии. 5. Первый закон термодинамики. 6. Вывод рабочей формулы (36) данной работы. 7. Второй закон термодинамики и его статистический смысл. 6. ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ И УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ МЕТАЛЛА Цель работы Исследовать фазовый переход первого рода ...
... случайность, спонтанность непредсказуемость развития процесса (своего рода физический экзистенциализм), и в силу этого он далек от парадигмы абсолютности. Рассмотрим уровневый подход на примере энергии. Сегодня основные виды энергии в физике рассматриваются по парам: потенциальная – кинетическая, электрическая – магнитная, тепловая – механическая, причем каждая пара рассматривается автономно, ...
... в 2 раза. 180. Найти относительную скорость движения двух частиц, движущихся навстречу друг другу со скоростями u1 = 0,6×c и u2 = 0,9×c. II. ОСНОВЫ МОЛЕКУЛЯРНОЙ ФИЗИКИ И ТЕРМОДИНАМИКИ Молекулярная физика и термодинамика – разделы физики, в которых изучаются макроскопические процессы в телах, связанные с огромным числом содержащихся в них атомов и молекул (макроскопические системы ...
... . Фронт волны. Интерференция волн. Принцип Гюйгенса. Дифракция волн. Уравнение бегущей волны. Стоячие волны. Звуковые волны. Скорость звука. Громкость и высота звука. II. Молекулярная физика и термодинамика II.1. Основы молекулярно-кинетической теории Основные положения молекулярно-кинетической теории и их опытное обоснование. Броуновское движение. Массы и размеры молекул. Моль вещества. ...



0 комментариев