Навигация
Структура иммуноглобулинов
Контрольная работа по биологии
Содержание
1. Первичная структура Н-и L-цепей иммуноглобулинов
2. Трехмерная структура иммуноглобулинов
3. Антигенсвязывающие центры антител
1. Первичная структура Н-и L-цепей иммуноглобулинов
При исследовании аминокислотной последовательности было обнаружено, что все легкие и тяжелые цепи имеют одну принципиальную структурную особенность: они состоят из двух частей — вариабельной и константной. Вариабельные части легких цепей сильно отличаются друг от друга у всех исследованных иммуноглобулинов, а константные имеют близкую аминокислотную последовательность в пределах одного класса как легких, так и тяжелых цепей.
Постоянная или константная часть легких цепей для каждого из х- или Я-типов цепей включает 107 а. о. СООН-концевого участка. Исключение составляют различия в нескольких аминокислотных остатках, например в положении 191 и 153 в цепях человека или в положениях 190 и 152 в Я-цепях, обусловленные генетическими вариантами.
Оставшаяся последовательность аминокислотных остатков в NHa-концевой половине легких цепей образует так называемую вариабельную область. Частота замен отдельных аминокислот в вариабельных областях легких цепей иммуноглобулинов зависит от положения аминокислотного остатка в полипептидной цепи и максимальна около аминокислот в положениях 30, 50 и 95. Эти участки, получившие название гипервариабельных, принимают непосредственное участие в связывании антигена и входят в состав антигенсвязывающего центра.
Вариабельная область Н-цепей в МН2-концевой части несколько длиннее соответствующей области L-цепей и включает 118—124 а. о. Гипервариабельными участками являются четыре аминокислотные последовательности: 31—37, 51—68, 84—91 и 101—110, также непосредственно контактирующие с антигеном в антигенсвязывающем центре. Последовательности аминокислотных остатков вариабельных областей Н-цепей различных иммуноглобулинов по степени гомологии могут быть разделены на три подгруппы, внутри каждой из которых эта величина составляет 8,0—90%.
Константная область тяжелой цепи приблизительно в три раза длиннее вариабельной.
2. Трехмерная структура иммуноглобулинов
В каждой из легких цепей молекул антител существуют две внутрицепочечные дисульфидные связи, число таких связей в тяжелых цепях различно. Каждый из внутрицепочечных дисульфидных мостиков образует петлю из 55—70 а.о.
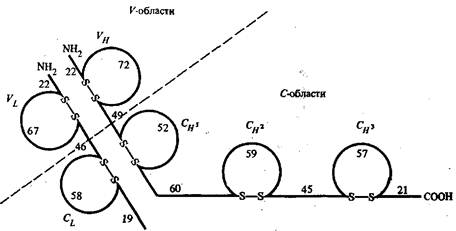
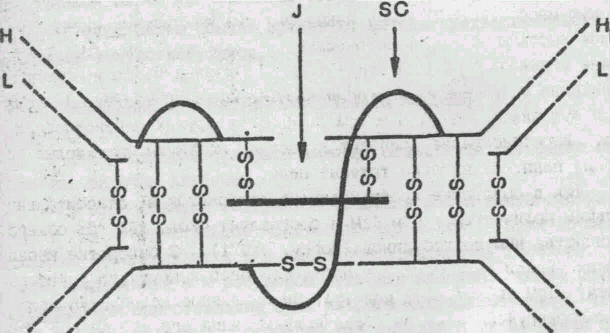
Рис. 1 - Схема расположения внутрицепочечных дисульфидных связей в легких и тяжелых цепях молекулы IgG человека
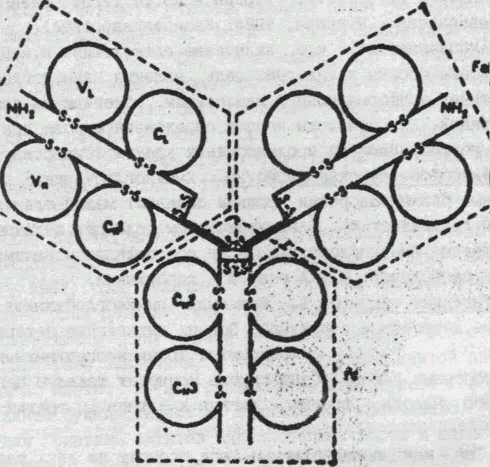
На рис. 1 приведено схематическое изображение расположения дисульфидных связей вдоль тяжелых и легких цепей IgG человека с указанием среднего числа аминокислотных остатков в составе каждой из петель. По данным рентгеноструктурного анализа, участки пептидных цепей вблизи петли образуют глобулу, в которую включается примерно 110 а. о. Такие глобулы получили название доменов. Н2-концевые домены тяжелых и легких цепей относятся к вариабельным частям, а СООН-концевые домены — к константным частям. Было установлено, что аминокислотные последовательности константных доменов из тяжелых цепей в пределах одного класса являются весьма сходными между собой.
Н2-концевой домен тяжелой цепи обозначают как Ун, а три последующих в константной области тяжелой цепи — как Сн1. Сн2 и СнЗ. А и у тяжелые цепи содержат по 3 константных домена, обозначаемых как Са1, Са2, Са3 для IgA и Cvl, Су2, С£ для IgG, а более длинные ц- и е-цепи — по четыре.
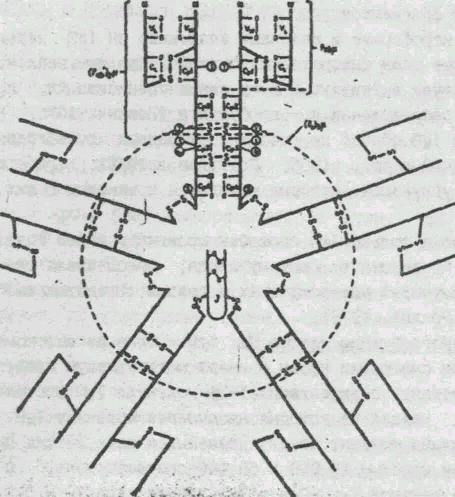
Рентгеноструктурный анализ, выполненный для нескольких белков — димера Я-цепей, двух димеров F-областей Fab-фрагментов IgG и IgA, а также Fc-фрагмента IgG, позволил установить пространственное расположение отдельных участков полипептидных цепей и доменов. Домены L- и Н-цепей представляют собой полусферы, соединенные вдоль одной цепи линейными полипептидиыми отрезками, доступными растворителю и действию протеолитических ферментов. Их основным структурным элементом являются два почти параллельных слоя, один из которых состоит из четырех линейных антипараллельных отрезков цепи, второй — из трех. В состав этих р-слоев входит около 60% антипараллельные сегменты fxl — fx4 и fyl — fy3 обра-ауют два практически параллельных слоя Р-складчатой структуры. Между ними лежат сегменты, образующие изгибы цепи, спирали н т.п.; V- н С-домены отличаются частью сегментов; V-домен имеет добавочную петлю Е; черный прямоугольник соответствует внутрицепочечной дисульфидной связи всех аминокислотных остатков области. Боковые заместители гидрофобных аминокислот образуют плотно упакованное ядро между р-слоями. Дисульфидная связь между р-слоями, являющаяся существенным элементом жесткости структуры доменов, находится в самом гидрофобном ядре и поэтому в водных растворах недоступна для восстанавливающих агентов.
Участков с а-спиральной конформацией в структуре доменов практически не содержится. По сравнению с С-доменами К-обла-сти несколько длиннее и содержат дополнительную петлю Е. В К-областях образующие ядро аминокислотные остатки с гидрофобными боковыми заместителями, а также остатки в изгибах полипептидной цепи, обеспечивающие ее необходимый поворот, являются консервативными или полуинвариантными. Гипервариабельные остатки располагаются на изгибах цепи таким образом, что оказываются пространственно сближенными.
Взаимодействие между Н-цепями в Fab-фрагменте обеспечивается множественными контактами между парами доменов Уъ и. Vn, Cl и Сн1. При ассоциации'Cl и Сн1 домены обращены друг к другу четырехцепочечными р-слоями и взаимодействуют вдоль обширной зоны.свободной от растворителя. В контактах, имеющих в основном гидрофобный характер, участвует около 30 а. о. Наоборот, Vi, и Ун-домены ориентированы друг к другу трехце-почечными р-слоями. Основную роль в стабилизации образующейся структуры играют взаимодействия между консервативными и полуинвариантными аминокислотами с гидрофобными боковыми заместителями. Гипервариабельные участки Vl, и Ун-областей сближены и образуют доступную растворителю относительно плоскую область связывания антигена.
В Fc-фрагменте lgG Сн2-домены тяжелых цепей ориентированы друг к другу трехцепочечными р-слоями, но непосредственно друг с другом не контактируют из-за ограничений, накладываемых наличием межцепочечных дисульфидных связей в Н2-конце Су2-доменов; между ними находятся углеводные фрагменты, ковалентно связанные с остатками Asn-297 каждой Ц-цепи. Они состоят главным образом из остатков глюкозы, глюкозамина, фруктозы и сиаловой кислоты. Содержание углеводов и состав существенно отличаются у разных классов. Их присоединение является постсинтетическим процессом и происходит упорядоченно во время внутриклеточного транспорта молекулы иммуноглобулина. До сих пор биологическая роль углеводного компонента не ясна.
СуЗ-домены соседних Н-цёпей IgG обращены друг к другу четырехцепочечными р-слоями, и характер их взаимодействия аналогичен связи между Cvl и Cl. Небольшая область контакта между Ст2 и СуЗ-доменами охватывает около 12 остатков.
В молекулах IgM взаимодействие Су2-доменов, по-видимому, происходит по типу Fab—С, т. е. Су2-домены сближены и контактируют четырехцепочечными р-слоями. Наличие дисульфид-ного мостика на С-конце См2-домена способствует тесному сближению N-концов СмЗ-доменов, в результате чего непосредственного контакта между СмЗ-доменами не происходит.
Между Сд1 и Сц2-доменами Н-цепей IgG и IgA и между Сн2 и СнЗ-доменами тяжелых цепей иммуноглобулинов других классов расположен так называемый «шарнирный» участок, создающий высокую степень подвижности между двумя Fab- и Fc-фраг-ментами. Длина «шарнирного» участка иммуноглобулинов разных классов и подклассов варьирует от 15 до 65 а. о. Степень гомологии последовательности «шарнирных» участков составляет 60— 70%. Имеется зависимость между строением «шарнирного» участка и подвижностью Fab-фрагментов подклассов IgG-человека. Наибольшей гибкостью обладает молекула IgG3, у которой «шарнирный» участок, состоящий из,65 а. о., представляет довольно жесткий стержень с гибкими концами, примыкающими к Fab-фрагмен-там. У IgM4, обладающего наиболее жесткой структурой, «шарнирный» участок содержит всего 13 остатков, среди которых 5 остатков Pro и 2 — Cys, образующих межцепочечные дисульфидные связи, IgGl и IgG2 занимают промежуточное положение.
Похожие работы
... количествах антитела только одного вида — моноклональные антитела. Подчеркнем, что моноклональные антитела гомогенны как по специфичности, так и по физико-химическим свойствам. Вопросы, связанные с получением поликлональных и моноклоиальных а 2. Структура и специфичность антигенов Понятие антигенная детерминанта включает в себя последовательность образующих ее химических функциональных групп ...
... свыше 12% (Шаханина, Стоев, 1981). IgE играют важную роль в патогенезе аллергии (Isgizaka, Ishizaka, 1976, Dorrington, Bennich, 1978). К.Г.Стоев (1979) разработал методы выделения и количественного определения D и Е иммуноглобулинов в сыворотке крови здоровых и больных людей. ПРЕПАРАТИВНОЕ ВЫДЕЛЕНИЕ ИММУНОГЛОБУЛИНОВ Для выделения иммуноглобулинов из сыворотки крови животных, особенно G1, М и А, ...
кую чувствительность, необходимую для таких диагностических задач. Лаборатория «ДИТРИКС» предлагает самый точный и быстрый метод определения иммуноглобулинов в автоматическом режиме на аппаратуре фирмы « Roche ». Человеческий иммуноглобулин G (IgG) имеет наивысшую концентрацию среди 5 классов иммуноглобулинов (IgG , IgA , IgM , IgD и IgE) со средней скоростью синтеза 30 мг/кг веса тела. Время ...
... Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикла мочевинообразования Кребса. Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот. Дальнейшие ...

0 комментариев