Навигация
2.2 Описание эксперимента
Для получения рекомбинантного аденовируса CELO методом котрансформации с ДНК вируса CELO дикого типа сконструированная плазмида должна содержать правый и левый фрагменты ДНК указанного вируса. Мы использовали плазмиду pCBEl, содержащую правый концевой фрагмент генома вируса CELO от 88.8 доЮО единиц карты (ед. к.). Участок генома от 95,3 до 99,7 ед. к., который не является существенным для репликации вируса, был делетирован из pCBEl по сайтам рестриктазы EcoRV. Указанным способом была получена плазмида pCBEARV. Полученная плазмида была подвергнута гидролизу рестриктазой Hind3 с последующим дефосфорилированием, а затем обработке олигонуклеотидом , содержащим сайт распознавания рестриктазы Рас 1.
Левый фрагмент вируса CELO был клонирован в плазмиду pGEM-T путем постановки полимеразной цепной реакции (ПЦР). В качестве праймеров были использованы олигонуклеотиды, содержащие следующие сайты рестрикции: первый - Bst и Pad, второй—Asc, Sfi и Есо721.Число циклов амплификации составило 15.
Следующий этап заключался в проведении гидролиза полученных плазмид; PacpCBEARV по сайту рестрикции Smal, CELOleftpGEM-T путем обработки рестриктазами Bstl 1071 и Есо721. Из полученных фрагментов была сконструирована плазмида, несущая правый и левый концы генома аденовируса CELO. Недостатком полученной плазмиды являлось наличие высококопийного ori ( ori—участок, в котором начинает расплетаться ДНК при помощи ДНК- полимеразы). Учитывая наличие двух сайтов рестрикции по Pad, ori было сменено при помощи рестрикции по указанным сайтам и последующим соединением липких концов образованного фрагмента с частью плазмиды pTG3601, гидролизованной также по двум сайтам Pad.
Полученная плазмида была рестриктирована по Ascl и котрансформирована с геномом вируса CELO по гомологичным участкам. Таким образом нами был получен Ad-вектор для экспрессии генов на основе генома аденовируса птиц CELO. Указанная схема представлена на рисунке 2.1.
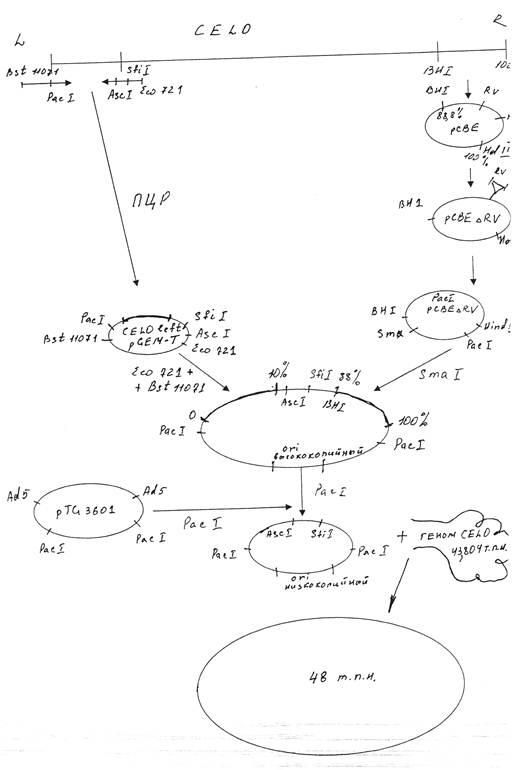
2
2.3 Обработка экспериментальных данных
Плазмида с измененным ori была подвергнута наращиванию в Е. coli препаративных количествах. Для доказательства идентичности полученных плазмид с исходной был проведен рестрикционный анализ. В лунки 0.8% агарозного геля были внесены следующие пробы: в первую—маркер молекулярного веса (геном фага X, разрезанный рестриктазой РСТ, см. рисунок 2, б));
во вторую — плазмида, нарощенная в препаративных количествах; в третью - первоначально полученную плазмиду. По результату электрофореза, представленному на рисунке 2.2, можно судить об идентичности молекулярного состава указанных плазмид.

Плазмида, полученная после рекомбинации с геномом CELO и имеющая 48 тысяч пар оснований, была подвергнута обработке рестриктазой HindHI. Указанная рестриктаза активна при следующей комбинации нуклеотидов:
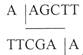
Количество сайтов рестрикции в полученной плазмиде и их местоположение указаны на рисунке:
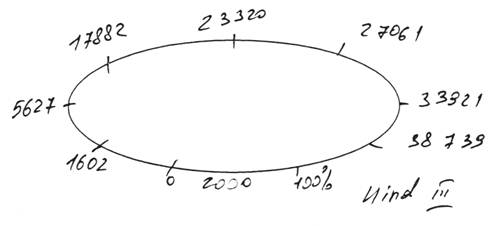
Пробы после рестрикции были подвергнуты электрофорезу. В первую, вторую и третью лунку помещены целевые плазмиды, полученные из разных клонов Е. coli. В четвертую лунку помещена плазмида, неподвергавшаяся рестрикции, в пятую — маркер молекулярного веса.
Результаты рестрикционного анализа свидетельствуют об идентичности полученных фрагментов с ожидаемыми.
Заключение
В заключении данной работы рассмотрим наиболее существенные и практически значимые достижения рекомбинантной ДНК-биотехнологии, а также перспективы её развития.
Начиная с момента открытия двойной спиральной структуры а особенно после расшифровки генома человека, научные изыскания приносят значительные практические результаты, наиболее перспективные из которых следующие: конструирование рекомбинантных организмов-продуцентов жизненно необходимых лекарственных средств, получение которых альтернативными методами невозможно или сопряжено со значительными трудностями; разработка генетических вакцин; развитие генной терапии; применение трансгенных растений и животных для интенсификации сельского хозяйства.
Сравнение структур генов секвенированных к настоящему времени геномов человека, дрозофилы нематоды, дрожжей и бактерий приводит к выводу, что все живые существа действительно произошли от общего предшественника, так как родственные гены легко идентифицируются в геномах представителей всех трех царств живых организмов. Указанный факт теоретически обосновывает возможность встраивания и успешного функционирования чужеродных генов в организме. В настоящее время широкий спектр биологически активных веществ производится рекомбинантными организмами (соматотропин, инсулин, интерфероны, интерлейкин - 2).
Одним из самых современных и перспективных направлений биотехнологии является разработка генетических вакцин. Преимуществом генетических вакцин является возможность фокусирования иммунного ответа на одном или нескольких определенных антигенах возбудителя, что принципиально невозможно при использовании традиционных вакцин и не происходит при течении инфекционного процесса, а также возможность их использования не только в превентивных, но и в терапевтических целях для лечения аутоиммунных заболеваний, аллергий и злокачественных новообразований.
К терапии нового поколения относится генная или клеточная терапия основанная на превращении стволовых клеток в любые другие необходимые для организма клетки. В настоящее время указанная выше методика находится в стадии разработки, но имеет реальную перспективу.
Литература
1. Альбертс Б., Брей Д., Льюис Дж. и др. Молекулярная биология клетки в 3-х томах. — М.: Мир, 1994. — 1558 с. — ISBN 5-03-001986-3.
2. Докинз Р. Эгоистичный ген. — М.: Мир.[82]
3. История биологии с начала XX века до наших дней. — М.: Наука, 1975. — 660 с.
4. Льюин Б. Гены. — М.: Мир, 1987. — 1064 с.
5. Пташне М. Переключение генов. Регуляция генной активности и фаг лямбда. — М.: Мир, 1989. — 160 с.[83]
6. Уотсон Дж. Д. Двойная спираль: воспоминания об открытии структуры ДНК. — М.: Мир, 1969. — 152 с.
7. Burgers P, Koonin E, Bruford E et al. (2001). «Eukaryotic DNA polymerases: proposal for a revised nomenclature». J. Biol. Chem. 276 (47): 43487-90. PMID 11579108
8. Авторозов Е.К. Лекции по микробиологии и биотехнологии – М.: Эксмо, 2000
9. Елинов М.П. Основы биотехнологии – М.: Москва, 2004
10. Егорова Н.С. Биотехнология. Учебное пособие для ВУЗов – М.: Просвещение, 2009.
0 комментариев