Навигация
Текстильна промисловість та побутова хімія
4.3 Текстильна промисловість та побутова хімія
Також ферменти використовують в текстильній промисловості для розшліхтування тканин і приготування висококонцентрованих клейстером крохмалю в процесі фарбування тканин[8].
Амілолітичні ферменти застосовують у виробництві пральних порошків. Амілаза виводить з білизни крахмалсодержащіе залишки їжі. Виробництво ферментів при виробництві пральних порошків просто необхідно, щоб підвищити миючу здатність. За оцінками фахівців - технологів частка ферментів в загальній миючої здатності порошку становить 30-35%. Навіть незначне додавання ферментів в пральний порошок значно збільшує його миючу здатність [2, 6].
4.4 Фармацевтична промисловість
Амілолітичні ферменти широко використовують для лікування захворювань шлунково-кишкового тракту. Використання цих ферментів у медицині вельми перспективно, і, безсумнівно буде розширюватися. Труднощі в застосуванні ферментних препаратів для цілей медицини полягають у необхідності очищення їх від пірогенних речовин, токсинів та інших домішок [36]. Амілаза - фермент, гідролізується Глікозидний зв'язку в полісахариду. Основна функція даного ферменту полягає в переварюванні крохмалю і глікогену. У зв'язку з наявністю полісахаридних фрагментів у складі клітинної стінки бактерій, наголошується розщеплення цих полісахаридів і розвиток бактеріостатичної дії амілази, яка найбільш виражена з ферментів цього підкласу - у лізоциму. Спільна дія цих ферментів забезпечує неспецифічну захист проти бактеріальної інфекції[24].
5. СУЧАСНІ НАУКОВІ ДОСЛІДЖЕННЯ, ПОВ`ЯЗАНІ З РОЗРОБКОЮ АМІЛОЛІТИЧНИХ ФЕРМЕНТНИХ ПРЕПАРАТІВ
5.1 Комп'ютерне моделювання структури амілолітичних ферментів
При вивченні механізмів ферментативного каталізу класичними методами (ІЧ і УФ-спектроскопія, електронна спектроскопія, ЯМР і т.д.) додаткову інформацію вносить комп'ютерне моделювання білкових молекул з використанням даних рентгеноструктурного аналізу (РСА). Здатність глобулярних білків утворювати якісні монокристали, в яких всі атоми ідентичні і орієнтовані однаковим чином, дозволила вивчати їх за допомогою методу кристалографії. Відомо, що дані рентгеноструктурного аналізу завжди правильно відображають укладання білкової ланцюга, а в переважній більшості випадків буквально відтворюють активну конформацію ферменту. Отже, вони є надійною і поки що єдиною основою для кількісного опису механізму каталітичного акта на атомно-молекулярному рівні. Метод кристалографії дозволяє розшифровувати тривимірні структури комплексів ферментів з інгібіторами, які в тій чи іншій мірі відповідають хімічним стадіях каталізу. Маючи в своєму розпорядженні рентгеноструктурних даними, одна частина яких відповідає реальному вихідного стану ферменту, а інша - фермент-інгібіторної комплексам, стає можливим відтворення механізму каталітичного акта, а, отже, можна простежити динаміку поведінки білкової макромолекули [1]. Розробляються в даний час програми комп'ютерного моделювання білкових молекул на основі результатів кристалографії дозволяють одержувати наочні тривимірні зображення досліджуваних об'єктів, і по-новому осмислити дані експериментальних досліджень кінетики-термодинамічних властивостей ряду ферментів, отримані за останнє десятиліття, а, отже, виявити додаткові аспекти молекулярних механізмів ферментативного перетворення субстрату. У зв'язку з цим метою даної роботи є аналіз топології амілолітичні ферментів з використанням програми MolScript по даних рентгеноструктурного аналізу. Підвищений інтерес до амілаза зумовлений їх широким застосуванням у медицині, харчовій і легкій промисловості як ефективні біокаталізаторів. Дослідження фізико-хімічних властивостей, кінетика-термодинамічних параметрів, особливостей фермент-субстратні взаємодій при здійсненні акту каталізу амілолітичні ферментами сприяли суттєвому зміни й удосконалення багатьох існуючих технологій і створення нових. Однак, очевидним є брак інформації про просторової організації макромолекул ферментів даної групи.
Об'єктом наших експериментальних досліджень є глюкоамілаза з Aspergillus awamori, препарат Г-20Х виробництва Ладижинського заводу ферментних препаратів. Для визначення активності глюкоамілази використовували глюкозооксідазний метод. Визначення загальної кількості білка в ферментні препарати проводили за методом Лоурі. Дослідження співвідношення типів вторинної структури здійснювали методом інфрачервоної спектроскопії на спектрометрі Specord M-80 (Німеччина). Визначення молекулярної маси глюкоамілази, а також вивчення четвертинної структури ферменту з використанням додецилсульфату натрію у концентрації 3,5 × 10-5 моль / л для руйнування надмолекулярних рівня організації, проводили за допомогою гель-хроматографії на сефадексе G-200. Кількісне визначення SH-груп здійснювали методом, заснованому на вимірюванні приросту оптичної щільності в області 255 нм при приєднанні n-меркурібензоата до SH-групам. Для кількісного визначення SS груп використовували метод, заснований на вимірюванні оптичної щільності (l = 412нм.) При утворенні нітротіобензоата. Визначення числа йоногенних груп проводили на автоматичної установки, розробленої на кафедрі біофізики та біотехнології ВДУ, шляхом порівняння кривих титрування білка. Вивчення просторової структури глюкоамілази здійснювали з використанням програми MolScript.
Програма MolScript використовується для моделювання протеїнових і протеідових структур. Вихідними даними для програми є *. in файл, в якому вказується файл рентгеноструктурного аналізу, об'єкти для виводу і точну їх опис за допомогою графічних параметрів. Для створення в першому наближенні вхідних файлів MolScript використовується програма MolAuto. Ця програма розпізнає вторинну структуру у файлі pdb і виводить відповідні команди для схематичного опису даної структури. MolAuto має кілька ключів, які дозволяють впливати на властивості об'єктів. Програма не здатна вибирати зручний ракурс, тому користувачеві необхідно вибирати його самостійно. MolAuto може бути частиною потоку UNIX з програмою MolScript: наприклад для швидкого отримання зображення структури в режимі OpenGL. Кожен формат, підтримуваний MolScript, володіє своїми специфічними властивостями. Тому вибір формату проводиться з урахуванням встановленого програмного забезпечення і бажаного набору властивостей отриманої моделі.
Програма MolScript використовує одну фіксовану правостороннім систему координат з ціною ділення 1 ангстрем. Точка огляду зафіксована і змінитися не може. Для перегляду молекули з різних ракурсів атомні координати необхідно трансформувати, тобто повернути і / або транслювати в межах системи координат. Молекулярні координати зчитуються з pdb файлу, а самі координати атомів і залишків, що входять в дане зображення, використовуються графічними командами. Координати обраних атомів трансформуються матрицею, визначеної однією або кількома операціями.
При вивченні топології для двовимірних статичних і тривимірних моделей проводилося розпізнавання субодиниць ферментів в різних масштабах по різних напрямах. Топологічні питання розглядалися як для фрагментів, так і для цілісних молекул амілолітичні ферментів, що дозволило ввести позначення функціонально значущих груп.
Класичні методи вивчення особливостей перебігу ферментативного каталізу дозволяють розглядати широке коло питань. Так, експериментальним шляхом нами було досліджено вплив різних фізико-хімічних факторів на конформацію макромолекули глюкоамілази з Aspergillus awamori та пов'язаних з нею механізмів активації та інактивації даного ферменту; Вивчено кінетику-термодинамічні аспекти реакції гідролізу крохмалю. Методом гель-хроматографії визначена молекулярна маса глюкоамілази, що становить 106 кДа. Дослідження амінокислотного складу глюкоамілази показало, що молекула ферменту містить 26,8% амінокислотних залишків з алкільних бічними ланцюгами (Ala, Val, Leu, Met, Ile), що визначають високу стійкість ферменту до органічних розчинників. Виявлено високий вміст у молекулі глюкоамілази Ser і Thr. Результати наших експериментів і аналіз даних літератури з секвенування глюкоамілази (А. Е. Альошин та ін, 1994) дозволяють зробити висновок про те, що молекула ферменту має 6 SH-груп та 4 дисульфідних зв'язку, що стабілізують його третинну структуру. Вивчення надмолекулярних рівня організації глюкоамілази показало наявність четвертинної структури, представленої двома ідентичними субодиниця з молекулярною масою 53600Да, що володіють каталітичної активністю. Її стабільність визначається водневими зв'язками і гідрофобними взаємодіями і може залежати від невеликих змін в просторовій структурі кожної з взаємодіючих субодиниць. Причому четвертинна структура, очевидно, має здатність передачі структурних перебудов від однієї субодиниці до іншої і є одним з факторів регуляції функціональної активності молекули білка.

Рисунок 5.1. Просторова структура глюкоамілази
Результати досліджень впливу n-меркурібензоата на каталітичну активність глюкоамілази дозволяють зробити висновок про те, що до складу активного центру даного ферменту не входять імідазольного група гістидину і SH-групи, а в гідролізі крохмалю беруть участь карбоксильні групи аспарагінової і глутамінової кислот.
Використовуючи дані рентгеноструктурного аналізуі програму MolScript, методом молекулярного моделювання показано, що активний центр глюкоамілази розташований в наскрізний порожнини (~ 1,5 нм), обмежену наступними амінокислотними залишками: Leu-58, Leu-130, Leu-177, Leu - 319, Trp-178, Trp-417, Phe-187 (Рис1).
Встановлено, що в гідролізі крохмалю беруть участь карбоксильні групи Asp-55, Glu-179, Glu-400 (рис.2).
Активний центр ферменту розташовується в щілини, прикритій двома кластерами молекул H2O: перше - в області Leu-58 (12 молекул H2O), другий - у поглибленні активного центру (7 молекул). Показано, що з одного боку щілини активного центру зосереджені Asp-55 та Glu-179, а з протилежного - Glu-400.
Результати рентгеноструктурного аналізу (Альошин А.Е. та ін, 1994 [10]) показали, що поверхня молекули глюкоамілази глікозильованого: 10 амінокислотних залишків серину і треоніну мають маноза (Ser-453, Ser-455, Ser-459, Thr-457 і ін).
Цей фермент характеризується наявністю N-термінального домену, що складається з 440 амінокислотних залишків, O-глікозильованої ділянки, що має 70 амінокислот і C-термінального крохмалезв’язуючого домену (100 амінокислот). Каталітичний домен має 2 N-глікозильовані ділянки, причому контакт між N-глікозильованими ланцюгами і поліпептидом стабілізується залишком маннози за допомогою водневого зв'язку або іонізованими молекулами води, чим і визначається стабільність ферменту і можливість утворення надмолекулярних структур. O-глікозильований домен має залишки Gly перед і після C-кінця, які являють собою вигини, що визначають взаємодію крохмалезв’язуючого домену з каталітичним і відповідну орієнтацію молекули субстрату. Глікозилювання запобігає скупчення молекул субстрату в зв'язують центрах і забезпечує стехіометричної зв'язування.

Рисунок 5.2. Просторова структура макромолекули глюкоамілази
Методом комп'ютерного моделювання встановлено, що для молекул глюкоамілази характерна щільна упаковка гідрофобного ядра у вигляді 13 α-спіральних ділянок (рис.3), а так само антипаралельних β-структур, що утворюють 11 петель (рис. 4).
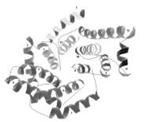
Рисунок 5.3. Топологія α-спіралей в макромолекулі глюкоамілази

Рисунок 5.4. Топологія β-слоїв в макромолекулі глюкоамілази
Під вторинної структурі присутні, крім того, невпорядковані ділянки в кількості 19 (мал. 5). У відсотковому співвідношенні даних структур по протяжності, аморфні ділянки переважають над іншими, що підтверджено також методом ІЧ-спектроскопії.

Рисунок 5. Топологія неупорядкованих ділянок в макромолекулі глюкоамілази
Таким чином, комп'ютерне моделювання дозволяє отримувати додаткову інформацію про структуру білкових макромолекул і проводити розшифровку механізму ферментативного каталізу.
В даний час продовжуються роботи з проблем вивчення топології різних амілолітичних ферментів, таких як α-амілаза, β-амілаза, інулаза та ін. Обговорюються питання топологічної самоорганізації досліджуваних білкових макромолекул, яка визначається взаємозв'язком первинної та вторинної структури[25, 26, 27].
Похожие работы
... час як обсяги імпорту горілки впали (зокрема, імпорт російської горілки в Україну у 2006 році, порівняно з 2005, скоротився за оцінками експертів, майже на 20%, а частка російської горілки на українському ринку не переважає 1%). За оцінками експертів, до 80% імпортної продукції на алкогольному ринку Росії – українського походження, а частка її на російському ринку в цілому у першому півріччі 2006 ...
... і декстрин. Температурний оптимум росту 30°С, оптимум рН 7 –9,5 Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків. 3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів Пробіотики відіграють позитивну роль у підвищенні загальної ...
... Костєв Ф.І., Борисов О.В., Щегрінов М.М. Одеський державний медичний університет. Стент для довготривалого дренування верхніх сечових шляхів (54). Анотація Борисов С.О. Вибір лікувальної тактики при обструктивних нефропатіях у урологічних хворих. — Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.06 — урологія. — Державна Установа “Інститут ...
0 комментариев