Навигация
Класифікація амілолітичних ферментів
2.2 Класифікація амілолітичних ферментів
Амілолітичні ферменти об'єднують велику групу ферментів, які здійснюють гідроліз переважно α-(1,4)-Глікозидних зв'язків амілози, амілопектину, глікогену та інших мальтоолігосахаридів. До групи амілолітичних ферментів відносяться наведені нижче і деякі інші ферменти:
КФ 3.2.1.1 α-амілаза
КФ 3.2.1.2 β-амілаза
КФ 3.2.1.3 Глюкоамілаза
КФ 3.2.1.41 Пуллуланаза
КФ 3.2.1.68 Ізоамілаза
КФ 3.2.1.20 α-глюкозидази
КФ 3.2.1.11 Декстраназа
КФ 2.4.1.19 Амілаза Bacillus macerans (циклодекстроглюканотрансфераза)
Амілази бувають двох типів: ендо-і екзоамілази. Чітко вираженої ендоамілазой є α-амілаза, здатна до розриву внутрішньомолекулярних зв'язків у полімерних ланцюгах субстрату. Глюкоамілаза і β-амілаза є екзоамілазами, тобто ферментами, що атакують субстрат з нередукуючого кінця.
Субстратами для дії амілаз є крохмаль, що складається з амілози і амілопектину, продукти часткового гідролізу крохмалю і глікоген. Крохмаль - рослинний полісахарид з дуже складною будовою. Цей двокомпонентний з'єднання, що складається з 13-30% амілози і 70-85% амілопектину. Обидва компоненти неоднорідні, їх молекулярна маса (М. м.) коливається в широких межах і залежить від природи крохмалю. Амілоза - це необертающийся полімер, в якому залишки глюкози Сполучених α-1,4-Глікозидний зв'язком; ступінь полімеризації близько 2000. У «аномальних» амілози з однією-двома α-1,6-зв'язками полімеризація може зрости до 6000. Амілоза практично не має відновлюючої здатності, тому що в кожній молекулі амілози є тільки один вільна альдегідна група [8].
Реакції, що каталізуються амілазами, мають дві стадії: коротку передстаціонарну і тривалу – стаціонарну. Під час першої стадії ендоамілаза швидко зменшує молекулярну масу субстрату, утворюючи суміш лінійних та розгалужених олігосахаридів. Другий етап реакції триває, поки продукти гідролізу не перестануть забарвлюватися йодом; він протікає значно повільніше і залежить від індивідуальних властивостей ферменту та його природи[9].
α-амілаза (1,4-α-D-глюканглюканогідролаза) є ендоамілазою, що викликає гідролітичні розщеплення α-1,4-глікозидних зв'язків всередині полімерного субстрату. Це водорозчинний білок, що має властивості глобуліну і має молекулярну масу 45-60 кДа. Всі α-амілази відносяться до металоензимів, вміст у них Са коливається від 1 до 30 г-атом / 1 г-моль ферменту. Повне видалення Са приводить до інактивації ферменту. Глутамінова і аспарагінова кислоти становлять 25 мас. % Від маси білка. Залежно від виду мікроорганізму властивості α-амілаз можуть сильно відрізнятися не тільки за механізмом дії на субстрат і по кінцевим продуктам, але і за оптимальними умовами для прояву максимальної активності. Присутність в промислових препаратах протеїназ знижує каталітичну активність α-амілази. У результаті впливу α-амілази на перших стадіях в гідролізаті накопичуються декстрини, потім з'являються тетра- і тримальтоза, що не зафарбовуються йодом і які дуже повільно гідролізуються α-амілазою до ди- і моносахаридів[5].
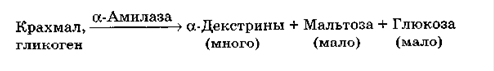
Рисунок 2.1. Механізм дії α-амілази[2]
β-амілаза (β -1,4-глюкан мальтогідролаза, КФ 3.2.1.2) - активний білок, що володіє влатсивостями альбуміну. Каталітичний центр ферменту має сульфгідрильні і карбоксильні групи і імідозольний цикл залишків гістидину. β-Амілаза –екзофермент кінцевої дії, що виявляє спорідненість до передостаннього β -1,4-зв'язку з нередукуючого кінця лінійного ділянки амілози і амілопектину.
На відміну від α-амілази β-амілаза практично не гідролізують нативний крохмаль, тоді як клейстеризований крохмаль гідролізуєтся нею з утворенням мальтози β-конфігурації. Якщо гідролізу піддається амілоза, то гідроліз йде повністю до мальтози. Незначна кількість декстринів може здіснюватися при гідролізі «аномальної» амілози, тому що гідроліз β-амілазою йде тільки по лінійній ланцюга до α -1,6-зв'язків. Якщо субстратом для β-амілази служить амілопектин, то гідроліз йде в значно меншому ступені. β-Амілаза відщеплює фрагмент з нередукуючим кінцем ділянки від зовнішніх лінійних гілок, які мають по 20-26 глюкозних залишків, з утворенням 10-12 молекул мальтози. Гідроліз призупиняється на передостанній α -1,4-зв'язку, що межує з α -1,6-зв'язком. У гідролізаті накопичується 54-58% мальтози, решту становлять високомолекулярні декстрини, що містять значну кількість α -1 ,6-зв'язків – так звані β -декстрини.
β-амілази виявляють більшу стабільність у відсутність іонів Са2+. Молекулярна маса β-амілази рослин досить висока, вона складає від 50000 до 200000. Фермент може складатися з однієї або чотирьох субодиниць до 50 000 кожна. Фермент містить SH-групи та чутливий до дії важких металів. Вважається, що (β-амілазу має високу здатність до нескінченої атаки субстрату. Для амілози середньої молекулярні маси в одному при з'єднанні ферменту до субстрату можливо відчеплення до чотирьох залишків мальтози. При збільшенні молекулярної маси субстрату можлива і більша кількість місць атаки.
Продукт реакції – мальтоза – має β-конфігурацію. Гідроліз іде по лінійному ланцюзі тільки до α-1,6-зв'язків. При гідролізі крохмалю утворюється 54-58% мальтози і 42-46% високомолекулярних декстринів (β-декстринів). β-амілази виявляють більшу стабільність у відсутність іонів Са. Фермент може складатися з однієї або чотирьох субодиниць, містить SH-групи та чутливий до дії важких металів. Властивості β-амілаз залежать від джерел їх виділення. Для отримання мальтози з крохмалю використовують бактеріальні β-амілази[5].

Рисунок 2.2. Принциповий механізм дії β-амілази[2]
Глюкоамілаза (1,4-α-D-глюканглюкогідролаза) широко рас-розлогий в природі. Вона синтезується багатьма мікроорганізмами і утворюється в тканинах тварин. У літературі фермент відомий під різними назвами: амілоглюкозідаза, γ-амілаза, лізосомальних α-глюкозидази, кисла мальтаза, матулаза, екзо-α-1 ,4-глюкозидази. Глюкоамілаза каталізує послідовне відщеплення кінцевих залишків α-D-глюкози з нередуцірующіх решт субстрату. Цей фермент проявляє екзогенний механізм впливу на субстрат. Багато глюкоамілази володіють також здатністю гідролізувати α-1 ,6-глюкозідние зв'язку. Однак це відбувається в тому випадку, коли за α-1 ,6-зв'язком слід α-1 ,4-зв'язок, тому декстран ними не гідролізується. Глюкоамілаза значно швидше гідролізують полімерний субстрат, ніж оліго-і дисахариди. Майже всі глюкоамілази є глікопротеїдів, що містять від 5 до 35% вуглеводів, які складаються з оліго-, ди- і моносахаридів.
Майже всі глюкоамілази є глікопротеїдів, що містять від 5 до 35% вуглеводів, які складаються з оліго-, ди-і моносахаридів. Угле ¬ водний компонент може бути цілісним фрагментом або ж розбитими на індивідуальні сполуки, які прикріплюються до білка через треонін і серин. Наприклад, у глюкоамілази A. niger їх 20. Більшість відомих глюкоамілаз має оптимум при рН 4,5-5,2, рідше - при 5,7-6,0, в основному для дріжджових глюкоамілаз[8].
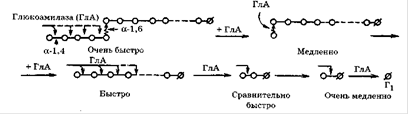
Рисунок 2.3. Принциповий механізм дії глюкоамілаз[2]
Фермент пуллуланаза (пуллулан-6-глюканогідролаза) раніше був відомий під назвами: R-фермент, гранична декстриназа або амілопектин-6-глюканогідролаза. Пуллуланаза, як і α-амілаза, є ендогенних ферментом, але на відміну від неї здатна невпорядковано гідролізувати α-1 ,6-зв'язку в пуллулані, амілопектину, глікогену та граничних декстрину, одержуваних при спільному впливі на крохмаль і глікоген α-і β - амілаз. Якщо між двома α-1 ,6-зв'язками розташовано більше трьох залишків глюкози, то розрив α-1 ,6-зв'язку йде значно повільніше, тому амілопектин гідролізується пуллуланазой гірше за інших розгалужених полісахаридів. Найбільш частим відщеплює фрагментом є мальтотріоза. Пуллуланази з різних джерел мають різні властивості[7].
Ізоамілаза (глікоген-6-глюканогідролаза), або дебранчінг-фермент, гідроліз α-1 ,6-зв'язку в розгалужених полісахаридів, таких як амілопектин, глікоген, β-граничні декстрини. Відмінною особливістю ізоамілази в порівнянні з пуллуланазой є те, що вона не здатна гідролізувати пуллулан і слабко діє на граничні β-декстрини. Бактеріальна ізоамілаза розщеплює α-1 ,6-зв'язку в глікогенній повністю, а пуллуланаза діє на цей субстрат слабо. Ізоамілазу утворюють багато мікроорганізмів, такі як B. amyloliquefacie, Cytophaga, Streptomyces, Pseudomonas amyloderamosa, Saccharomyces cerevisiae та ін, ферменти яких мають здатність гідролізувати субстрат при рН від 3,5 до 6,5 і температурах від 25 до 53 ° С. Ізоамілаза не стабілізується кальцієм, за винятком ферменту з Cytophaga. Молекулярна маса ізоамілаз коливається від 90 до 120 кДа.
α-глюкозидази (α-D-глюкозідглюкогідролаза) має здатність гідролізувати α-1 ,4-зв'язку від нередуцірующего кінця субстрату з відщеплення залишку глюкози. Фермент проявляє найбільшу спорідненість до низькомолекулярним субстрату, легко гідролізують мальтозу, олігосахариди, а полісахариди гідролізують повільно або зовсім не гідролізують. α-глюкозидази об'єднує групу ферментів і має ряд інших назв: мальтаза, глюкоінвертаза, глюкозідосахараза. Властивості ферментів, які продукуються різними мікроорганізмами, можуть значно відрізнятися. Фермент має здатність до перенесення α-D-глюкозільних залишків на відповідні акцептори, часто з утворенням α-1 ,6-зв'язків[5].
Декстраназа (1,6-α-D-глюкан-6-глюканогідролаза) каталізує розщеплення α-1 ,6-зв'язків у бактеріальному полісахариди декстрану. Серед продуцентів декcтраназ слід зазначити B. subtilis, B. megaterium, Lactobacillus befidus, Streptococcus mutans, Bravibacterium fuscum, Pseudomonas UQM-733, різні грунтові бактерії, а також численні види мікроскопічних грибів роду Penicilium, Aspergillus і Fusarium. Декстранази мають молекулярну масу від 35 до 71 кДа; вони є слабокислими білками. Ізоелектричної точка для всіх грибних декстраназ лежить в діапазоні від 4,0 до 4,6. Для більшості бактеріальних декстраназ оптимальна температура каталітичної дії 35-37 ° С; для грибних продуцентів температура трохи вище - 55-60 ° С. Оптимальне значення рН коливається в залежності від виду продуцента від 4,4 до 7,5. За допомогою ендодекстраназ можна отримувати з декстрану кровозамінники необхідної молекулярної маси; їх також використовують у стоматології для зняття зубних бляшок, що складаються з декстраноподобних глюканов[5].
![]()
Рисунок 2.4. принциповий механізм дії декстранази[2]
Амілаза B. Macerans [1,4-α-D-глюкан-4-α-(1,4-α-глюкану) трансфераза (ціклізующая)] Ця унікальна амілаза, яка вперше була знайдена в культурі B. macerans. Вона циклізує частину ланцюга 1,4-α-глюкану шляхом утворення 1,4-α-глюкозідной зв'язку. Робоча назва цього ферменту – циклодекстринглюканотрансфераза (ЦГТ-аза). При дії на крохмаль і аналогічні субстрати утворюються циклічні нередукуючі декстрини (декстрини Шардінгера) різних розмірів.
Фермент діє на лінійні полісахариди, гідролізуючи насамперед α-1 ,4-зв'язок, і потім переносить звільнився редукуючий кінець ланцюга на НРК. Фермент також здатний перебудовувати лінійну структуру мальтодекстрин без циклізації, може переносити залишки глюкози і мальтози на олігосахариди, тобто має за певних умов трансферазну активність і здатний ввести реакцію конденсації[7].
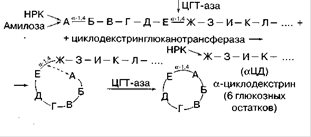
Рисунок 2.5. Принципова схема дії ферменту амілази B. Macerans[2]
Похожие работы
... час як обсяги імпорту горілки впали (зокрема, імпорт російської горілки в Україну у 2006 році, порівняно з 2005, скоротився за оцінками експертів, майже на 20%, а частка російської горілки на українському ринку не переважає 1%). За оцінками експертів, до 80% імпортної продукції на алкогольному ринку Росії – українського походження, а частка її на російському ринку в цілому у першому півріччі 2006 ...
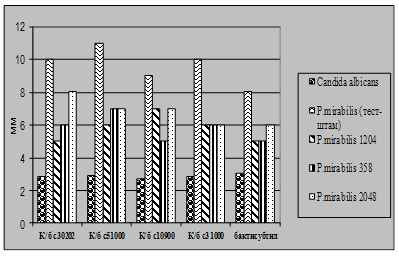
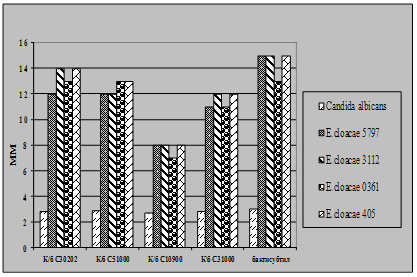
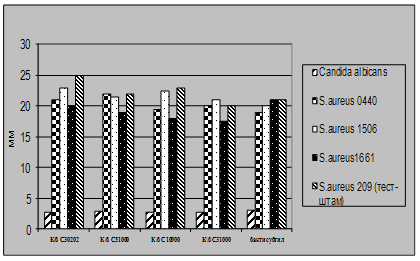
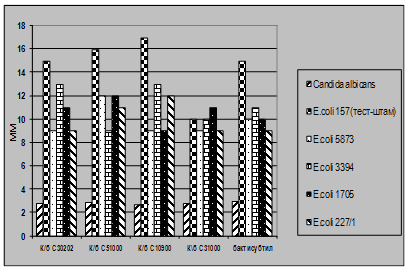
... і декстрин. Температурний оптимум росту 30°С, оптимум рН 7 –9,5 Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків. 3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів Пробіотики відіграють позитивну роль у підвищенні загальної ...
... Костєв Ф.І., Борисов О.В., Щегрінов М.М. Одеський державний медичний університет. Стент для довготривалого дренування верхніх сечових шляхів (54). Анотація Борисов С.О. Вибір лікувальної тактики при обструктивних нефропатіях у урологічних хворих. — Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.06 — урологія. — Державна Установа “Інститут ...
0 комментариев