Навигация
Идентификация органических оснований и их солей
9 Идентификация органических оснований и их солей
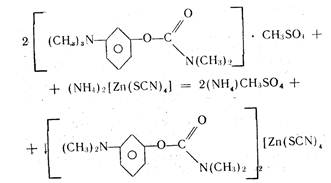
Общим испытанием на соли органических оснований [Я=И] • НА с неорганическими и органическими кислотами (НА) является реакция нейтрализации связанных с ними кислот. При этом органическое основание выпадает в осадок:
![]()
Затем основание можно идентифицировать по температуре плавления или с помощью цветных реакций.
Анионы связанных неорганических (хлороводородной, бромоводородной, йодоводородной, азотной, фосфорной) и органических (бензойной, салициловой, виннокаменной и др.) кислот обнаруживают с помощью рассмотренных выше качественных реакций.
Органические азотсодержащие основания и их соли, в т.ч. алкалоиды, витамины, антибиотики, можно идентифицировать с помощью осад и тельных (общеалкалоидных) реактивов.
Осадительные реактивы образуют с органическими азотсодержащими основаниями (алифатической, ароматической, гетероциклической структуры) и их солями аморфные или кристаллические осадки (белые или окрашенные), которые имеют стабильную температуру плавления, что также подтверждает подлинность испытуемого ЛВ. Особенно широко для испытания подлинности используют пикриновую кислоту, образующую со многими органическими основаниями пикра- ты, нерастворимые в воде.
Для идентификации органических оснований и их солей используют реактивы, которые не совсем точно называют специальными (специфичными) по отношению к некоторым алкалоидам. К их числу относятся: концентрированная серная кислота, концентрированная азотная кислота, смесь этих кислот (реактив Эрдмана), концентрированная серная кислота, содержащая ванадиевую кислоту (реактив Манделина), концентрированная серная кислота, содержащая формальдегид (реактив Марки).
Концентрированная серная кислота — один из наиболее широко используемых в фармацевтическом анализе реактивов. При испытании подлинности многих органических соединений используются ее активные окислительные, дегидратирующие свойства и каталитическое действие. Сочетание концентрированной серной кислоты с другими окислителями усиливает окислительную активность этих реактивов. Кроме того, она участвует в таких химических процессах, как конденсация, кислотный гидролиз, минерализация.
Концентрированная азотная кислота используется для идентификации органических соединений, т.к. проявляет свойства окислителя и нитрующего агента. Продукты окисления приобретают различное окрашивание, а образовавшиеся ни- тропроизводные имеют характерное желтое окрашивание и легко переходят под действием гидроксидов щелочных металлов в ацисоли, имеющие хиноидную структуру и иную окраску.
10 Источники и причины недоброкачественности лекарственных веществ
Основными источниками примесей являются: исходные и промежуточные продукты синтеза, сопутствующие вещества (в растительном и животном сырье), растворители, остатки кислот и щелочей, в том числе за счет выщелачивания стекла, металл, из которого изготовлена аппаратура, песок, асбест, волокна тканей и фильтровальной бумаги и т.д.
Примеси можно разделить на две группы: технологические (внесенные исходным сырьем или образовавшиеся в процессе производства) и примеси, приобретенные в процессе хранения, транспортировки, под воздействием различных факторов (тепла, света, кислорода воздуха, влаги и др.).
Примеси могут быть токсичные (недопустимые), оказывающие влияние на фармакологический эффект, и примеси, указывающие на степень очистки ЛВ. Последние, присутствуя в больших количествах, снижают содержание биологически активных веществ и соответственно уменьшают активность ЛС. Поэтому в ФС (ФСП) указываются допустимые пределы содержания таких примесей и приводятся испытания, подтверждающие отсутствие токсичных примесей.
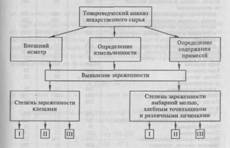
11 Общие требования к испытаниям на чистоту
Основное требование к испытаниям на чистоту — достаточная чувствительность, специфичность и воспроизводимость используемой реакции.
Содержание примесей можно установить эталонным и безэталонным путем. Эталонный — основан на сравнении со стандартом (эталонным раствором), содержащим определенное количество открываемой примеси. При этом в одинаковых условиях выполнения реакции наблюдают окраску или помутнение, возникающие при добавлении соответствующего реактива. Безэталонный путь — установление предела содержания примеси по отсутствию положительной реакции. При этом предел содержания примесей не превышает чувствительности реакции.
При выполнении испытаний на чистоту необходимо строго соблюдать общие указания ГФ: достаточная степень чистоты воды и растворов реактивов, точность навесок (до 0,001 г), одинаковые диаметры и цвет стекла посуды, объемы реактивов, последовательность и скорость их прибавления, единообразные условия наблюдения результатов испытаний.
12 Общие испытания на примеси неорганических ионов
Определение примесей и приблизительную оценку их количества осуществляют колориметрическим или нефеломет- рическим методами путем сравнения с эталонными растворами, нормирующими предельное содержание примеси.
Испытание иа хлориды основано на реакции с ионами серебра:
![]()
Возникает белая опалесценция, не исчезающая после добавления азотной кислоты и исчезающая при добавлении раствора аммиака:
![]()
Испытание на сульфаты основано на реакции с ионами бария:
![]()
Образуется белая опалесценция, не исчезающая от добавления хлороводородной кислоты.
Испытание на соли аммония основано на взаимодействии с реактивом Несслера:
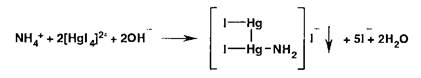
Образуется желтое окрашивание или желто-бурый осадок.
Менее чувствителен (0,003 мг в 1 мл) способ обнаружения примеси солей аммония, основанный на выделении аммиака под действием гидроксида натрия:
![]()
Выделяющийся аммиак обнаруживают по запаху или по посинению красной лакмусовой бумаги.
| Испытание на соли кальция основано на образовании белого мелкокристаллического осадка при действии оксалатом аммония:
|
Осадок не исчезает при добавлении уксусной кислоты, но легко растворяется в хлороводородной или азотной кислотах:
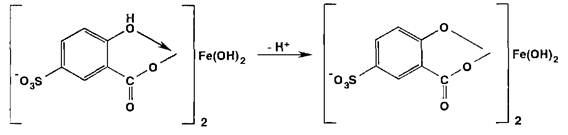


Испытание на соли железа (II) и (III) основано на образовании окрашенных феррилсульфосалицилатных солей или комплексов при взаимодействии с раствором сульфосалициловой кислоты. Окраска и состав комплексов зависят от рН среды:
В щелочных средах рН 9-11,5 образуется комплекс желтого цвета (Х1ШХ 416 нм), а при рН > 12 он разлагается с депрото- нированием анионного бис-комплекса:
Испытание на соли цинка основано на образовании белого осадка при взаимодействии с раствором гексацианоферрата (II) калия:
![]()
Обнаружению мешают ионы железа (III), которые в этих условиях дают синее окрашивание. Поэтому их вначале осаждают раствором аммиака.
Испытание на соли тяжелых металлов основано на образовании в уксуснокислой или нейтральной среде черного осадка или бурой окраски раствора при взаимодействии с сульфид-ионами:
![]()
Похожие работы
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...
... названия. В качестве основного синонима будут также приводиться торговые названия, под которыми JIC зарегистрировано или производится в Российской Федерации. 4 Методологические основы классификации лекарственных средств Количество ЛС в мире непрерывно возрастает. На фармацевтическом рынке в России в настоящее время обращается более I8 ООО наименований ЛС, что в 2,5 раза больше, чем в 1992 г. ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... препараты пенициллинов. Таблица 5. Идентификация лекарственных препаратов пенициллинов. Таблица 6. Химический метод количественного определения лекарст- венных препаратов пенициллинов.( Йодометрический м-д). Фармацевтический анализ препаратов пенициллинов Идентификация препаратов пенициллинов Подлинность препаратов пенициллинов подтверждают с помощью УФ – и ИК – ...

0 комментариев