Навигация
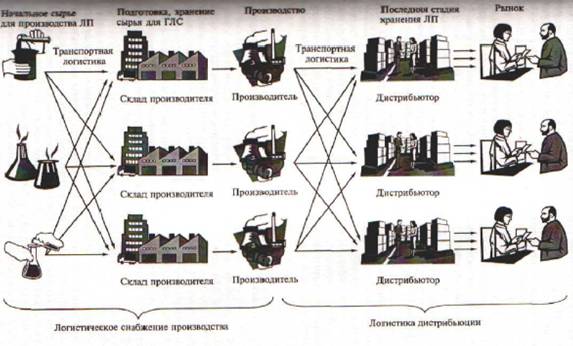
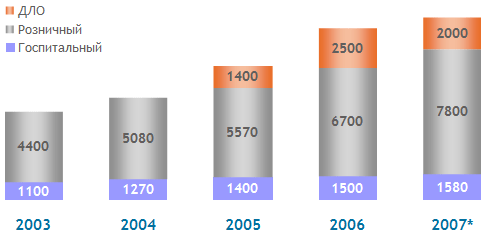
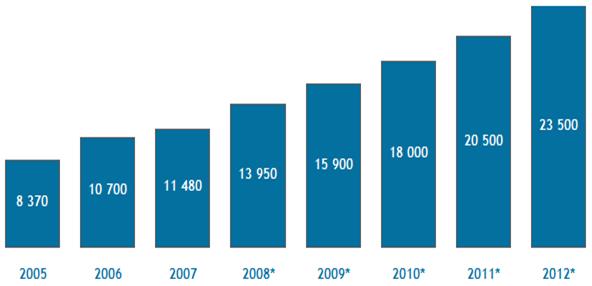
Производство лекарственных средств
6 Производство лекарственных средств.
Основное содержание правил GMP
Первые правила GMP были приняты в 1963 г. в США, затем в Канаде, Италии, Англии и 40 других государствах. Правила GMP являются общим руководством, устанавливающим порядок организации производственного процесса и проведения контроля, а также содержащим минимальные практические указания по современному правильному ведению производства. На основе правил GMP в каждой стране создаются стандарты и документы, регламентирующие ведение производства отдельных видов фармацевтической продукции.
В России правила GMP («Правила организации производства и контроля качества лекарственных средств» — РД 64-125-91) впервые были разработаны в 1991 г. с учетом опыта действующих Правил других стран. В последующие годы появились новые правила GMP и международные стандарты. В них включены впервые или развиты новые положения, такие какуправление качеством, валидация. Это потребовало переработки отечественных правил GMP. В результате с учетом законодательной базы России был создан новый стандарт отрасли ОСТ 42-510-98. Он разработан в соответствии с Федеральным законом «О лекарственных средствах».
Приказом Минздрава и Минэкономики РФ ОСТ 42-510-98 «Правила организации производства и контроля качества лекарственных средств (GMP)» был введен в действие поэтапно, начиная с 1 июля 2000 г., и является обязательным для всех организаций, производящих ЛС и ЛВ (субстанции). Поэтапное внедрение ОСТа 42-510-98будет осуществлено в полном объеме до 31 марта 2005 г., а для предприятий, производящих субстанции, — до 31 декабря 2008 г.
Новый стандарт представляет собой свод правил по организации производства и качества ЛС, в т.ч. субстанций, предназначенных для изготовления ГЛС. По уровню требований он не уступает аналогичным документам ВОЗ, Европейского Союза, США. Его внедрение позволит России обеспечить производство ЛС. на современном уровне, гарантировать их высокое качество.
В основе концепции GMP лежит понимание ограниченных возможностей контроля качества ЛС после его получения в условиях проведения лабораторных испытаний. Существенным недостатком оценки качества конечного продукта является условность перенесения оценки испытуемых образцов на всю контролируемую серию.
Правила GMP носят системный и профилактический характер. Они направлены на предотвращение ошибок и отклонений путем учета всех факторов, способных повлиять на качество готовой продукции с самого начала и до окончания производственного цикла. Внедрение этих правил невозможно без должного внимания к санитарии и личной гигиене на производстве, к технологической и контрольной документации, без современного оборудования.
В соответствии с системой GMP весь процесс производства должен быть проверен, «валидирован», оборудование «квалифицировано», контрольно-измерительная аппаратура «откалибрована». Причем все эти операции должны быть «задокументированы». Правила GMP, содействуя выработке продукции, однородной внутри серий и между сериями, существенно повышают значимость выборочного анализа готовой продукции при всех видах контроля, как на предприятии-изготовителе — выходного, так и потребительского — государственного.
Таким образом, правила GMP нацелены на снижение риска, присущего фармацевтическому производству, который нельзя устранить только путем контроля качества конечного продукта.
7 Управление качеством производства ЛС
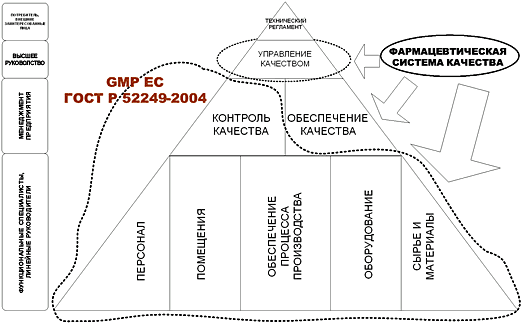
Под управлением качеством в фармацевтической промышленности понимают обеспечение надлежащего производства и контроля качества на всех этапах процесса производства ГЛС. Взаимосвязанными частями управления качеством являются: «Обеспечение качества», «Правила правильного производства (GMP)», «Контроль качества».
Обеспечение качества. Это широко распространенная концепция, включающая комплекс мероприятий, оказывающих влияние на качество готового продукта и гарантирующих соответствие его требованиям НД. Система обеспечения качества предназначена для того, чтобы фармацевтическое предприятие могло гарантировать, что разработка, испытания и изготовление ЛП проведены с учетом требований GLP, GCP и GMP. Производство должно быть обеспечено утвержденными технологическими регламентами, методиками и инструкциями, а также должностными инструкциями, в которых четко определена ответственность руководящего персонала за качество готового продукта. Контроль качества исходного сырья, вспомогательных, упаковочных материалов должен быть проведен на стадиях их изготовления или перед применением в производстве. Обязательным является проведение регистрации всех контрольных испытаний сырья, вспомогательных и других материалов, полупродуктов, готовых продуктов, постадийного контроля производства, калибровки приборов и валидация. Предприятие гарантирует, что готовый продукт произведен в соответствии с утвержденными техническими регламентами, а реализация готового продукта осуществлена только после разрешения начальника ОТК (ОКК).
На предприятии должна быть в наличии документация, позволяющая контролировать условия хранения продукта в течение срока годности у производителя, а также при транспортировке и до реализации. Фармацевтическое предприятие должно нести ответственность за качество выпускаемых им ЛС и гарантировать соответствие их требованиям НД.
Правила GMP являются составной частью системы обеспечения качества. Они гарантируют, что производство и контроль осуществляются на предприятии согласно требованиям соответствующей документации. Правила позволяют свести к минимуму риск производственных ошибок, которые нельзя предотвратить или устранить только путем контроля качества готового продукта. Наиболее часто встречаются два типа ошибок: перекрестная контаминация и смешивание и перепутывай ие готовых продуктов.
Правила правильного пользования (GMP) предусматривают:
- четкую регламентацию всех процессов производства и контроля качества пригодных для выпуска ГЛС требуемого
качества:
- проведение валидации всех стадий производства, которые могут оказать влияние на качество продуктов;
- обеспеченность производства обученным и квалифицированным персоналом, необходимыми помещениями, обоснованием и обслуживанием, сырьем, вспомогательными и иными материалами необходимого качества, соответствующими условиями для хранения и транспортировки сырья и материалов;
- наличие однозначных и четко изложенных технологических регламентов и инструкций для каждого конкретного производства;
- регистрацию всех этапов производства, подтверждающую выполнение всех требуемых по регламенту операций и соответствие полученных продуктов установленным требованиям по количеству и по качеству;
- хранение текущей производственной документации (в т.ч. по реализации готового продукта), что позволяет проследить прохождение каждой серии ЛС;
- обеспечение хранения и реализации готового продукта в условиях, позволяющих свести к минимуму риск снижения его качества;
- порядок возврата любой серии ГЛС с анализом причин нарушения его качества и предупреждения повторения выявленных недостатков.
Контроль качества — это часть «Правил GMP», включающая отбор проб, проведение испытаний и выдачу соответствующих документов, гарантирующих, что все необходимые испытания действительно проведены, процесс производства соответствовал требованиям регламентов, а готовый продукт был реализован только в том случае, если его качество отвечало требованиям НД.
Система контроля качества (объекты контроля, операции, техническое оснащение, методы и др.) является неотъемлемой частью производственного процесса.
В структуре каждого фармацевтического предприятия должен быть отдел контроля качества (ОКК). Пока еще многие предприятия сохранили отделы технического контроля (ОТК). Это самостоятельное и независимое структурное подразделение, которое возглавляется квалифицированным специалистом и руководствуется в своей работе государственными и отраслевыми документами, регламентирующими его деятельность.
Похожие работы
... и контролирует правильность оформления прописей для индивидуального производства лекарств. Ведет текущую и отчетную документацию. Проводит целевое фармацевтическое исследование аптек, других учреждений с целью оценки состояния контроля качества лекарственных средств при их изготовлении, транспортировке, хранении и отпуске. Экспресс-анализ лекарственных форм. Необходимость внутриаптечного ...
... препарата до реализации готового продукта – с активной регулирующей ролью государственных органов. 3. Проверка качества лекарственных средств Порядок контроля качества ЛС, обращающихся на фармацевтическом рынке, регламентируется приказом Минздрава России N° 137 от 04.04.03 г. «Об утверждении порядка осуществления государственного контроля ЛС на территории РФ и постановлением Госстандарта ...
... показателей и методов контроля качества Л С. Он должен обеспечивать разработку эффективного и безопасного Л С. Новый ОСТ предусматривает наличие двух категорий стандартов качества: I. Государственные стандарты качества лекарственных средств (ГСКЛС), к которым относятся: общая фармакопейная статья (ОФС) и фармакопейная статья (ФС); II. Стандарт качества (СКЛС); фармакопейная ...
... в рамках инспекционного контроля качества лекарственных средств. При возникновении сомнений в достоверности данных, полученных в результате проверки сопроводительной документации и контроля качества лекарственного средства по показателям «описание», «упаковка», «маркировка» могут проводиться дополнительные испытания. Выбор объема проводимых испытаний для выборочной проверки показателей качества ...

0 комментариев