Навигация
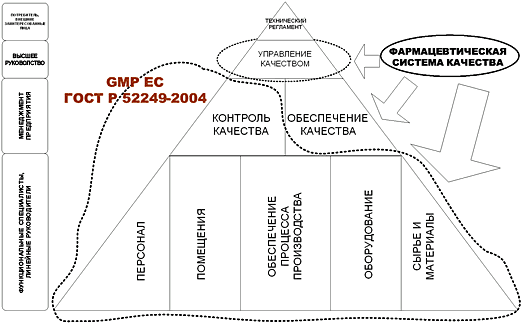
Обеспечение качества лекарственных средств
ОБЕСПЕЧЕНИЕ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
1 Структура и функции контрольно-разрешительной системы (КРС)
В СССР существовала система Государственного контроля качества ЛС, возглавляемая МЗ СССР. Она была призвана оценивать эффективность, безвредность и качество ЛС, их соответствие требованиям ГФ и другой НД. Эта система включала два основных направления. Одно из них связано с контролем вновь создаваемых ЛС, а другое — с контролем качества ЛС, выпускаемых предприятиями медицинской промышленности или изготавливаемых в аптеках.
Начало создания контрольно-разрешительной системы Российской Федерации относится к 1993 г. Ее основой стала имевшаяся в структуре МЗ РФ Инспекция (затем — Управление) государственного контроля лекарственных средств и медицинской техники. Система включает экспертизу, стандартизацию, сертификацию и контроль качества лекарственных, профилактических, диагностических средств, медицинской техники и изделий медицинского назначения на всех этапах обращения ЛС.
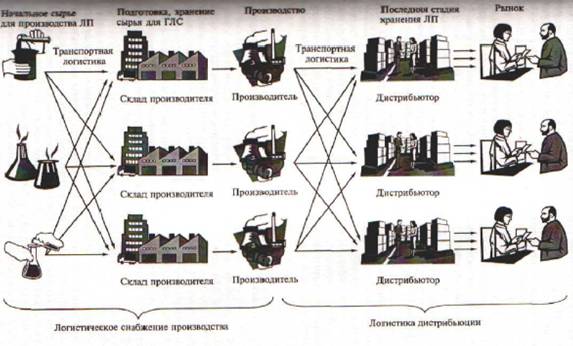
Контрольно-разрешительная система охватывает практически все этапы обращения и контроля качества ЛС от создания до реализации, включая стадии разработки, доклинических и клинических исследований ЛС, производства и экстем- порального изготовления, разработку НД, предусматривающую упаковку, маркировку и хранение, транспортировку, а также сертификацию, реализацию и импорт ЛС.
В современных условиях рынка ЛС роль контрольно-разрешительной системы непрерывно возрастает. В связи с необходимостью усиления контрольных и разрешительных функций Минздравом РФ были произведены структурные изменения в ее административных подразделениях.
Существовавшее Управление было в 1999 г. преобразовано в Департамент государственного контроля качества, эффективности и безопасности лекарственных средств и медицинской техники (далее — Департамент). Расширен его состав, в который входят отделы экспертизы и стандартизации ЛС; государственного контроля, сертификации и инспектирования производства ЛС; организации испытаний новой медицинской техники; стандартизации и государственного контроля медицинской техники; стандартизации и контроля фармацевтической деятельности.
На региональном уровне контрольно-разрешительная система представлена контрольно-аналитическими лабораториями (КАнЛ) и центрами по контролю качества лекарств (ЦККЛ).
Главное направление деятельности Департамента — регистрация, стандартизация и государственный контроль ЛС. В его функции входят: разрешение медицинского применения и регистрация ЛС; утверждение государственных стандартов на Л С; сертификация и государственный контроль за качеством медицинской продукции; выдача лицензий на производство и реализацию ЛС и медицинской техники. Кроме того, Департамент разрабатывает проекты нормативных актов, информационно-методические материалы и информационные письма по вопросам лекарственного обеспечения, экспертизы, регистрации и государственного контроля качества ЛС и изделий медицинского назначения.
Реализацию этих функций Департамент осуществляет с помощью созданного в феврале 1999 г. Государственного научного центра экспертизы и контроля лекарственных средств (ГНЦЭКЛС). В его составе функционируют: Институт контроля качества лекарственных средств (с отделами химико-фармацевтического, биологического контроля), Институт стандартизации ЛС, Институт доклинической экспертизы ЛС, Институт клинической экспертизы ЛС, Институт клинической фармакологии, отдел инспектирования предприятий и организаций, производящих, хранящих и реализующих ЛС. Эти подразделения обеспечивают научное и методическое руководство системой организации контроля ЛС и ее инспектирование.
Основными направлениями деятельности ГНЦЭКЛС являются: организация экспертизы нормативной документации на новые препараты; подготовка экспертных заключений; научная экспертиза ЛС, включенных в перечень жизненно необходимых и важнейших; исследования побочных действий Л С; разработка и внедрение отраслевых стандартов на информацию о ЛС; совершенствование организационных форм системы государственного контроля ЛС.
Составной частью контрольно-разрешительной системы являются находящиеся в ведении Департамента Фармакологический государственный комитет (ФГК) и Фармакопейный государственный комитет (ФПК). Они координируют свою деятельность с ГНЦЭКЛС.
Оба комитета являются экспертными органами Минздрава РФ. В их состав входят наиболее известные и компетентные ученые, ведущие специалисты различных областей медицины и фармации. Каждый из комитетов возглавляется председателем и имеет в своем составе президиум (ФГК имеет также Бюро), специализированные экспертные комиссии. Эти комиссии осуществляют первичную проработку и экспертизу представляемых документов и готовят их для утверждения на лрезидиуме комитета.
Фармакологический государственный комитет является основным экспертным органом Минздрава РФ по вопросам разрешения клинических испытаний. На этот комитет возлагаются следующие функции: экспертная оценка специфической активности, токсичности и безопасности ЛС; разрешение клинических испытаний или изучения ЛС с целью их рекомендации к регистрации и медицинскому применению; изменение показаний к применению разрешенных ранее ЛВ; экспертиза и одобрение инструкций по медицинскому применению ЛС и листков-вкладышей; пересмотр номенклатуры с целью исключения из Государственного реестра устаревших, малоэффективных и небезопасных ЛС; подготовка и участие в издании информационных материалов. При ФГК имеются специализированные экспертные комиссии по: акушерству и гинекологии, антибактериальным и противовирусным ЛС, гастроэнтерологии, дерматологии и венерологии, иммунологии, кардиологии, онкологии, педиатрии, инструкциям и номенклатуре, препаратам растительного и животного происхождения и гомеопатическим средствам, урологии, токсикологии и др. В функции комиссий входит рассмотрение материалов на новые оригинальные ЛС, новые комбинации ЛС, новые показания и новые (повышенные) дозировки ЛС. В функции Бюро ФГК входит оперативное решение вопросов по регистрации воспроизведенных, лицензированных ЛС, витаминов, препаратов растительного, животного происхождения и гомеопатических средств. Президиум ФГК определяет стратегию совершенствования системы экспертизы, клинических испытаний и регистрации ЛС, а также решает наиболее важные вопросы экспертной оценки эффективности и безопасности ЛС.
Фармакопейный государственный комитет, который осуществляет экспертизу нормативной документации на ЛС, возглавляет президиум, в состав которого входят председатель, два заместителя председателя, главный Ученый секретарь, председатели специализированных комиссий: химической, фармацевтической, фармакологической, микробиологической, фитопрепаратов, антибиотиков, гормональных и ферментных препаратов, препаратов крови и кровезаменителей, радиофармацевтических препаратов, гомеопатических средств, препаратов, получаемых генноинженерными методами, а также комиссии по экспертизе документации на отечественные ЛС (создана в связи с подготовкой нового издания Фармакопеи России). Комиссии производят экспертную оценку представляемой в ФПК нормативной документации для обеспечения ее соответствия современным требованиям к качеству ЛС (согласно ОСТ) и готовят рекомендации для рассмотрения на президиуме ФПК. В функции ФПК входят: разработка общих положений и требований по совершенствованию ГФ и подготовка очередных ее изданий; экспертиза ОФС, ФС и ФСП на новые ЛС и лекарственное растительное сырье, рекомендованное ФГК для медицинского применения; экспертиза проектов изменений и дополнений к ФС и ФСП; составление и подготовка к изданию списков сроков годности на отечественные и зарубежные ЛС, разрешенные к применению в РФ; экспертиза документации на зарубежные ЛС.
Таким образом, скоординированная деятельность Департамента, Государственного научного центра экспертизы и контроля ЛС совместно с Фармакологическим и Фармакопейным государственными комитетами обеспечивает единство в проведении всех этапов контроля качества на федеральном уровне: от создания ЛС, его экспертизы и регистрации до выпуска серийной продукции и ее применения. Важную роль в контрольно-разрешительной системе играют территориальные органы контроля качества: КАнЛ и ЦККЛ. Их деятельность позволила создать двухуровневую систему, разграничив функции федеральных и региональных органов. При этом была обеспечена вертикальная подчиненность подразделений, расположенных в субъектах Федерации, органам государственной власти, т.е. единство всей системы контроля качества ЛС.
Похожие работы
... и контролирует правильность оформления прописей для индивидуального производства лекарств. Ведет текущую и отчетную документацию. Проводит целевое фармацевтическое исследование аптек, других учреждений с целью оценки состояния контроля качества лекарственных средств при их изготовлении, транспортировке, хранении и отпуске. Экспресс-анализ лекарственных форм. Необходимость внутриаптечного ...
... препарата до реализации готового продукта – с активной регулирующей ролью государственных органов. 3. Проверка качества лекарственных средств Порядок контроля качества ЛС, обращающихся на фармацевтическом рынке, регламентируется приказом Минздрава России N° 137 от 04.04.03 г. «Об утверждении порядка осуществления государственного контроля ЛС на территории РФ и постановлением Госстандарта ...
... показателей и методов контроля качества Л С. Он должен обеспечивать разработку эффективного и безопасного Л С. Новый ОСТ предусматривает наличие двух категорий стандартов качества: I. Государственные стандарты качества лекарственных средств (ГСКЛС), к которым относятся: общая фармакопейная статья (ОФС) и фармакопейная статья (ФС); II. Стандарт качества (СКЛС); фармакопейная ...
... в рамках инспекционного контроля качества лекарственных средств. При возникновении сомнений в достоверности данных, полученных в результате проверки сопроводительной документации и контроля качества лекарственного средства по показателям «описание», «упаковка», «маркировка» могут проводиться дополнительные испытания. Выбор объема проводимых испытаний для выборочной проверки показателей качества ...

0 комментариев