Навигация
УФ - спектр ципрофлоксацина
4.1 УФ - спектр ципрофлоксацина
Согласно литературным данным [12] максимум поглощения в спектре солянокислых растворов приходится на 276-278 нм, что согласуется с полученными данными (рис. 4.1).
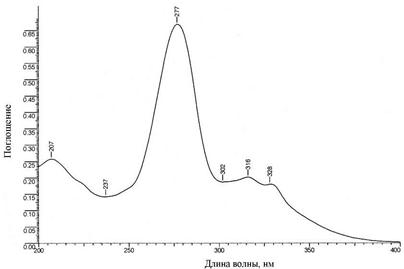
Рис. 4.1. Вид УФ-спектра ципрофлоксацина с концентрацией 5 мкг/мл в 0,1 М растворе HCl.
Вид спектра и положение максимума зависит от рН среды из-за присутствия карбоксильной группы и обусловлен сложной сопряженной структурой молекулы, приводящей к формированию нескольких максимумов поглощения. Необходимость растворения в кислоте связана с протонированием вторичного атома азота, что приводит к увеличению растворимости по сравнению с растворимостью в воде. Поэтому при проведении всех исследований в растворе создавалась постоянная концентрация HCl - 0,1 моль/л. Величина экспериментального молярного коэффициента поглощения для раствора ципрофлоксацина в глазных каплях «Ципромед» составляет 43500 ± 400 М-1см-1 (разд. 4.2), что близко к 44800, приведенному в работе [12]. Кроме того, форма основной полосы поглощения и плеча в длинноволновой области не зависят от производителя капель. Наличие компонентов минимально в составе глазных капель «Ципромед» (указано присутствие 0,022% бензалкония хлорида при содержании ципрофлоксацина 0,3 %).
4.2 Характеристики градуировочной зависимости
для определения ципрофлоксацина
В выбранных условиях была получена градуировочная зависимость оптической плотности солянокислого раствора ципрофлоксацина при 277 нм от его концентрации. Получилась линейная градуировочная зависимость в диапазоне концентраций ципрофлоксацина от 9,00*10-7 моль/л до 2,17*10-5 моль/л (0,3 мкг/мл до 7,2 мкг/мл), проходящая через начало координат. Полученные данные представлены на рисунке 4.2 и в таблице 4.1.
 Рис. 4.2. Градуировочная зависимость оптической плотности раствора при 277 нм от концентрации ципрофлоксацина
Рис. 4.2. Градуировочная зависимость оптической плотности раствора при 277 нм от концентрации ципрофлоксацина
Характеристики градуировочной зависимости для разных способов выражения концентрации (коэффициент a – незначим):
| b = 43500; S2yx = 2,12*10-5; S2b = 26030; S2a = 2,96*10-6; y = (43500 ymin = 0,005; xmin = Cmin = 1,99*10-7 моль/л. | b = 0,131; S2yx = 1,69*10-5; S2b = 1,88*10-7; S2a = 2,35*10-6; y = (0,131 ymin = 0,005; xmin = Cmin = 0,059 мкг/мл. |
Таблица 4.1
Зависимость оптической плотности раствора при 277 нм от концентрации ципрофлоксацина
| с*105, моль/л | ст, мкг/мл | А | с*105, моль/л | ст, мкг/мл | А |
| 0,09 | 0,3 | 0,033 | 0,54 | 1,8 | 0,238 |
| 0,09 | 0,3 | 0,033 | 0,54 | 1,8 | 0,239 |
| 0,18 | 0,6 | 0,073 | 1,09 | 3,6 | 0,469 |
| 0,18 | 0,6 | 0,073 | 1,09 | 3,6 | 0,469 |
| 0,27 | 0,9 | 0,119 | 1,63 | 5,4 | 0,701 |
| 0,27 | 0,9 | 0,111 | 1,63 | 5,4 | 0,706 |
| 0,36 | 1,2 | 0,158 | 2,17 | 7,2 | 0,939 |
| 0,36 | 1,2 | 0,159 | 2,17 | 7,2 | 0,949 |
Для дальнейшего удобства расчетов и представления результатов концентрация ципрофлоксацина будет представлена в мкг/мл.
Следует отметить, что характеристики градуировочной зависимости практически не изменяются в присутствии физраствора.
Допустимые пределы содержаний ципрофлоксацина в каплях 0,270 – 0,330 % (г/100 мл). В разных образцах капель концентрация ципрофлоксацина варьировалась от 2,50 до 3,30 мг/мл (от 0,25 до 0,33 %). Поэтому перед исследованием сорбции – десорбции несколько флаконов капель сливалось вместе, и уже в усредненном растворе определялась исходная концентрация.
Концентрация ципрофлоксацина в одном из образцов глазных капель «Ципромед», установленная спектрофотометрическим методом составила (3,15 ± 0,02) г/100 мл. Результаты представлены в таблице 4.2.
Таблица 4.2
Воспроизводимость определения концентрации ципрофлоксацина в каплях спектрофотометрическим методом
| А277 | ст , мкг/мл (в фотометрируемом растворе) | w, % , (в каплях) |
| 0,331 | 2,52 | 0,315 |
| 0,332 | 2,53 | 0,316 |
| 0,332 | 2,53 | 0,316 |
| 0,330 | 2,51 | 0,314 |
| 0,331 | 2,52 | 0,315 |
| 0,331 | 2,52 | 0,315 |
|
|
Отработанная методика и полученная по ней градуировочная зависимость использовались при исследовании обменных свойств мягких контактных линз по отношению к раствору капель «Ципромед».
Сорбция и десорбция проводились в статических условиях. Использовали модельные калиброванные линзы диаметром 12,0 мм, толщиной 0,60 мм. Масса линз представлена в таблице 3.1.
4.3.1 Результаты исследования сорбции ципрофлоксацина МКЛДинамику сорбции ципрофлоксацина линзами из материала «Кемерон» изучали следующим образом: каждую предварительно насыщенную (до постоянной массы) линзу замачивали в 2 мл капель на 1, 2, 3, 5 часов и сутки. Все это делалось в разных опытах. По истечении этого времени линзы извлекали, а оставшийся раствор анализировали в соответствии с отработанной методикой, отбирая на анализ определенную аликвоту раствора (1 мл). Результаты представлены в таблице 4.3 и на рисунках 4.3, 4.4.
Таблица 4.3
Результаты изучения сорбции ципрофлоксацина линзами из капель «Ципромед»
| t, ч | mп/погл, мг |
мг | mпогл, мг | mпогл/ mлинзы, мг/г | mпогл/ mисх, % |
| 0,5 | 5,00 | 5,06 | 1,01 | 9,52 | 16,8 |
| 0,5 | 5,08 | ||||
| 0,5 | 5,10 | ||||
| 0,5 | 5,06 | ||||
| 1 | 4,86 | 4,83 | 1,39 | 13,0 | 22,5 |
| 1 | 4,79 | ||||
| 2 | 4,58 | 4,60 | 1,66 | 15,6 | 26,5 |
| 2 | 4,61 | ||||
| 3 | 4,78 | 4,79 | 1,51 | 14,3 | 24,0 |
| 3 | 4,79 | ||||
| 5 | 4,57 | 4,57 | 1,68 | 15,6 | 27,0 |
| 16 | 4,62 | 4,62 | 1,50 | 14,14 | 25,0 |
| 24 | 4,79 | 4,71 | 1,60 | 15,0 | 26,0 |
| 24 | 4,62 |
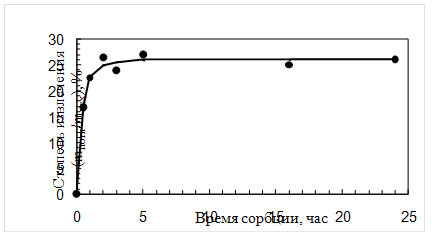
Рис. 4.3. Зависимость степени извлечения ципрофлоксацина из препарата от времени сорбции

Рис. 4.4. Зависимость степени сорбции ципрофлоксацина из препарата
от времени сорбции
Для оценки воспроизводимости результатов сорбции была проведена серия опытов, где было задействовано четыре линзы с приблизительно одинаковыми массами (0,3179 г, 0,3159 г, 0,3167 г, 0,3239 г). Линзы (каждую отдельно) замачивали в 2 мл раствора капель «Ципромед» 2 часа. Полученные данные представлены в таблице 4.4.
Таблица 4.4
Воспроизводимость результатов сорбции ципрофлоксацина МКЛ (время сорбции 2 часа)
| mп/погл, мг | mпогл, мг | mпогл/ mлинзы, мг/г | mпогл/ mисх, % | |
| 4,58 | 1,67 | 15,70 | 27 | |
| 4,61 | 1,64 | 15,44 | 26 | |
| 3,99 | 1,58 | 14,86 | 28 | |
| 4,02 | 1,55 | 14,33 | 28 | |
| 4,04 | 1,53 | 14,38 | 27 | |
| 4,10 | 1,47 | 13,66 | 26 | |
| 4,44 | 1,76 | 16,56 | 28 | |
| 4,57 | 1,63 | 15,06 | 26 | |
| 4,52 | 1,69 | 15,88 | 27 | |
| 4,69 | 1,52 | 14,13 | 24 | |
|
| 4,36±0,20 | 1,60±0,06 | 15,0±0,6 | 26,7±0,9 |
| Sr,% | 6,5 | 5,6 | 6,0 | 4,7 |
Полученные результаты показывают, что величина относительного стандартного отклонения (Sr,%) характеристик сорбции не превышает 6,5%.
Анализируя полученные данные по сорбции ципрофлоксацина (табл. 4.3 и рис. 4.3, 4.4), можно сказать о том, что полное насыщение препаратом линз происходит за 3 часа. Причем за первый час извлекается более 70% от максимальной степени извлечения. Сорбционная емкость составляет 15,0 мг/г безводного полимера.
Таким образом, можно порекомендовать проводить насыщение мягких контактных линз из материала «Кемерон» раствором капель «Ципромед» не более трех часов.
Основными определяющими факторами в данном случае могут быть размеры молекул, влияющие на проникающую способность, возможность образования водородных связей и ионных ассоциатов с функциональными группами сополимера, а также состояние и количество воды в гидрогеле. В частности, для линз Concor-55, сополимер которого содержит гидроксиэтилметакрилат и N-винилпирролидон, а влагосодержание на 15% ниже исследуемого материала, степень сорбции ципрофлоксацина достигает 25 мг/г [3]. Сродство к фторхинолонам авторы объясняют комплексообразующими свойствами сополимеров винилпирролидона [3]. Авторы работы [3] не приводят метрологических характеристик результатов анализа, хотя ими использованы, по видимому, очень тонкие линзы, поскольку указанная масса в безводном состоянии порядка 14 мг. Кемерон-1 содержит в своем составе до 70 % поливинилпирролидона [4], но при близких диаметрах линз толщина исследуемых нами значительно больше. Если достаточно крупные молекулы ципрофлоксацина распределяются в поверхностных слоях набухшего полимера, то различия в степени поглощения вполне объяснимы.
Согласно полученным результатам для насыщения МКЛ из материала «Кемерон-1» препаратом «Ципромед» достаточно трех часов
4.3.2 Результаты исследования десорбции ципрофлоксацина МКЛПри изучении динамики десорбции ципрофлоксацина линзами после насыщения препаратом их извлекали из раствора капель и помещали в пенициллатницы с 2 мл бидистиллированной воды последовательно, выдерживая линзу каждый раз по 30 минут. Полученные водные растворы анализировали. Общее время возвращения составило 3 – 3,5 часа. Вымачивание в воде прекращали, когда при анализе проб значения оптической плотности становилось равным нулю. Результаты представлены в таблице 4.5 и на рисунках 4.5, 4.6.
Таблица 4.5
Результаты изучения десорбции ципрофлоксацина МКЛ
| Сорбция | Десорбция | |||
| Время t, ч | mпогл, мг | Δt, мин | mвозв, мг | mвозв/mпогл |
| 1 | 1,35 | 30 | 0,63 |
0,88 |
| 30 | 0,35 | |||
| 30 | 0,14 | |||
| 30 | 0,05 | |||
| 30 | 0,02 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S 210 | S 1,20 | |||
| 1 | 1,42 | 30 | 0,62 | 0,85 |
| 30 | 0,34 | |||
| 30 | 0,14 | |||
| 30 | 0,06 | |||
| 30 | 0,03 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S 210 | S 1,20 | |||
| 2 | 1,67 | 30 | 0,75 | 0,84 |
| 30 | 0,44 | |||
| 30 | 0,14 | |||
| 30 | 0,07 | |||
| 30 | 0,01 | |||
| 30 | 0 | |||
| S 180 | S 1,41 | |||
| 2 | 1,64 | 30 | 0,72 | 0,85 |
| 30 | 0,45 | |||
| 30 | 0,15 | |||
| 30 | 0,06 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S 180 | S 1,39 | |||
| Сорбция | Десорбция | |||
| Время t, ч | mпогл, мг | Δt, мин | mвозв, мг | mвозв/mпогл |
| 3 | 1,51 | 30 | 0,81 | 0,98 |
| 30 | 0,41 | |||
| 30 | 0,17 | |||
| 30 | 0,07 | |||
| 30 | 0,02 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S 210 | S 1,49 | |||
| 3 | 1,50 | 30 | 0,78 | 1,00 |
| 30 | 0,42 | |||
| 30 | 0,18 | |||
| 30 | 0,07 | |||
| 30 | 0,03 | |||
| 30 | 0,02 | |||
| 30 | 0,00 | |||
| S 210 | S 1,50 | |||
| 5 | 1,68 | 30 | 0,86 | 0,89 |
| 30 | 0,42 | |||
| 30 | 0,16 | |||
| 30 | 0,05 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S 180 | 1,50 | |||
| 16 | 1,50 | 30 | 0,86 | 1,00 |
| 60 | 0,49 | |||
| 30 | 0,12 | |||
| 30 | 0,05 | |||
| 30 | 0,03 | |||
| 30 | 0,01 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S 270 | S 1,57 | |||

Рис. 4.5. Зависимость массы десорбированного ципрофлоксацина от времени десорбции.

Рис. 4.6. Зависимость степени десорбции ципрофлоксацина от времени десорбции.
Были проведены исследования десорбции ципрофлоксацина линзами из материала «Кемерон-1» в суммарный объем воды (8 мл) за общее время (2 ч). Полученные данные представлены в таблице 4.6 и на рисунке 4.7.
Таблица 4.6
Десорбция ципрофлоксацина из МКЛ в суммарный объем воды
| Сорбция | Десорбция | |||
| Время t, ч | mпогл, мг | Время t, ч | mвозв, мг | mвозв/mпогл |
| 0,5 | 1,01±0,07 | 2 | 0,64 | 0,60 |
| 0,60 | 0,61 | |||
| 0,56 | 0,57 | |||
| 0,59 | 0,58 | |||
| mвозв= (0,60±0,06) мг Sr = 9,4 % | ||||
| 3 | 2,44±0,09 | 2 | 0,95 | 0,39 |
| 1,13 | 0,45 | |||
| 1,04 | 0,44 | |||
| 1,32 | 0,54 | |||
| mвозв= (1,11±0,25) мг Sr = 22,5 % | ||||

Рис. 4.7. Зависимость доли десорбированного ципрофлоксацина от времени десорбции в воде при разной ее сменяемости
Была исследована десорбция ципрофлоксацина в сменяемые объемы (по 2 мл) через каждые 30 мин и в общий объем (8 мл) через 2 часа физраствора. Полученные данные представлены в таблице 4.7 и на рисунке 4.8.
Таблица 4.7
Десорбция ципрофлоксацина из МКЛ в физраствор
| Сорбция | Десорбция | |||
| Время t, ч | mпогл, мг | Δt, мин | mвозв, мг | mвозв/mпогл |
| 2 | 1,53±0,07 | 120 | 0,79 | 0,50 |
| 0,72 | 0,47 | |||
| 0,71 | 0,46 | |||
| 0,72 | 0,49 | |||
| mвозв= (0,73±0,06) мг Sr = 7,8 % | ||||
| 2 | 1,65±0,16 | 30 | 0,55 | 0,67 |
| 30 | 0,33 | |||
| 30 | 0,18 | |||
| 30 | 0,12 | |||
| S 120 | S 1,18 | |||
| 2 | 1,65±0,16 | 30 | 0,50 | 0,69 |
| 30 | 0,34 | |||
| 30 | 0,18 | |||
| 30 | 0,11 | |||
| S 120 | S 1,13 | |||
| 2 | 1,65±0,16 | 30 | 0,51 | 0,67 |
| 30 | 0,33 | |||
| 30 | 0,17 | |||
| 30 | 0,12 | |||
| S 120 | S 1,13 | |||
| 2 | 1,65±0,16 | 30 | 0,49 | 0,74 |
| 30 | 0,34 | |||
| 30 | 0,18 | |||
| 30 | 0,12 | |||
| S 120 | S 1,12 | |||
| Smвозв= (1,14±0,04) мг Sr = 3,8 % | ||||
Полученные результаты показали, что степень десорбции ципрофлоксацина линзами за 30 мин составляет 50 – 60% от сорбированного, а также более высокому уровню сорбции соответствует большая степень десорбции. Причем, что при малых временах насыщения (1 – 2 часа), что при больших (3 – 16 часов) процесс десорбции идет одинаково быстро. Результаты десорбции за разное время сорбции находятся в пределах погрешности эксперимента (10-23%), поэтому можно говорить о том, что десорбция не зависит от размера МКЛ, ее массы.
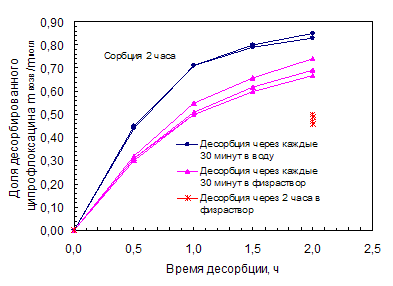
Рис. 4.8. Зависимость доли десорбированного ципрофлоксацина от времени вымачивания в воде или физрастворе при разной ее сменяемости
Причиной данного явления может быть размер молекулы ципрофлоксацина в объеме гидрогеля при абсорбции, так как он (размер молекулы) не позволяет сориентироваться, пройти вглубь материала линзы. Это может быть связано с тем, что молекулы ципрофлоксацина при абсорбции диффундируют в несвязанной воде гидрогеля. Возможно, что при этом задействован не весь объем гидрогеля, то есть молекулы ципрофлоксацина неглубоко проникают в объем линзы, а остаются около поверхности.
Если сравнивать десорбцию ципрофлоксацина в суммарный и сменяемые объемы воды или физраствора, то в суммарный объем она (десорбция) уменьшается на 20%.
Следует отметить, что результаты десорбции в физраствор схожи с результатами десорбции в воду, они находятся в пределах погрешности эксперимента. Поэтому можно говорить о том, что проведение десорбции в физраствор непринципиально.
В работе [3] отмечалось, что в результате модифицирования линз из материалов Concor-38 и Dura Soft-3 увеличивался размер линзы, одновременно с этим улучшались эластические свойства линз (вследствие увеличения их водосодержания) и их сорбционные свойства. Поэтому был проведен эксперимент по модифицированию линз (раздел 3.4.2) и опыты по сорбции и десорбции ципрофлоксацина модифицированными линзами (раздел 3.4.2).
В процессе модифицирования линзы приобрели желтоватый оттенок, что может быть связано с тем, что в линзах осталось небольшое количество ципрофлоксацина, который в щелочной среде имеет небольшую окраску.
После модифицирования линз из материала «Кемерон-1» наблюдалась та же самая картина. Но линзы становились очень хрупкими, вероятно, из-за разрушения структуры самого материала.
Параллельно с опытом по сорбции ципрофлоксацина была проведена проверка десорбции щелочи из модифицированных МКЛ. Методом кислотно – основного титрования было установлено, что за два часы из одной линзы десорбируется 1,2 мг NaOH. Следует отметить, что при этом, так же, как при выдерживании в ципрофлоксацине, линзы увеличиваются в размере примерно в 2 раза и становятся очень хрупкими. Кроме того в процессе сорбции ципрофлоксацина модифицированными МКЛ в растворе образуется кристаллический осадок белого цвета, который при добавлении 0,1 М соляной кислоты полностью растворяется. Вероятно, процесс десорбции щелочи из линз идет быстрее, чем сорбция ципрофлоксацина. При этом возможно взаимодействие ципрофлоксацин гидрохлорида со щелочью, в результате которого образуется малорастворимый в воде основный ципрофлоксацин. Данные по сорбции и десорбции ципрофлоксацина модифицированными линзами представлены в таблицах 4.8 и 4.9
Таблица 4.8
Результаты исследования сорбции и десорбции ципрофлоксацина модифицированными линзами
| Сорбция | Десорбция (8 мл H2O) | |||
| Время t, ч | mпогл, мг | Время t, ч | mвозв, мг | mвозв/mпогл |
| 3 | 0,64 | 2 | 0,61 | 0,95 |
| 0,90 | 0,50 | 0,55 | ||
| 0,85 | 0,54 | 0,64 | ||
| mпогл= (0,80±0,34) мг mвозв= (0,55±0,14) мг Sr = 43,1 % Sr = 25,4 % | ||||
Таблица 4.9
Сравнение сорбции и десорбции ципрофлоксацина модифицированными и немодифицированными линзами
| Сорбция | Десорбция (8 мл H2O) | |||
| Время t, ч | mпогл, мг | Время t, ч | mвозв, мг | |
| Немодифицированные линзы | 3 | 2,44±0,09 | 2 | 1,11±0,25 |
| Модифицированные линзы | 3 | 0,80±0,34 | 2 | 0,55±0,14 |
Модифицирование линз из материала «Кемерон-1» приводит к тому, что сорбционная емкость МКЛ снижается в 3 раза (с 23 мкг/мл до 8 мкг/мл). Это происходит из-за того, что, как говорилось ранее, в растворе капель не присутствует необходимого количества ципрофлоксацина (он связывается щелочью).
Следует отметить, что линзы из материала «Кемерон-1» не стоит подвергать какому-либо модифицированию.
Изучение десорбции является в значительной степени модельными экспериментами, поскольку приближенными к реальной десорбции лекарственных веществ из МКЛ в ткань глаза могут быть исследования in vivo [1]. Тем не менее, авторы работ [1] отмечают, что фармакокинетика исследованных ими глазных капель сохраняется и при десорбции в порции физраствора. Отмечается при этом, что процессы десорбции in vivo протекают на 10-15 % медленнее.
Если рассматривать гидрогель МКЛ как транспортное средство для доставки ципрофлоксацина в глаз, то можно привести следующие данные: при инстилляционном введении препарата в орган зрения попадает около 0,12 мг на каплю или 0,24 мг на две капли ципрофлоксацина. Часть препарата сразу вымывается слезой. При постепенном поступлении ципрофлоксацина из насыщенной линзы может быть десорбировано ~ 1,5 мг. Проведенное исследование не позволяет судить о скорости поступления препарата в реальных условиях, можно только предположить, что она будет на 10-15% ниже наблюдаемой (согласно работе [1]).
Процессы сорбции-десорбции ципрофлоксацина полностью обратимы в пределах погрешности эксперимента, причем полная десорбция происходит практически за то же время, что и насыщение линзы препаратом.
Таким образом, полученные результаты свидетельствуют о возможности пролонгированного введения препарата «Ципромед» в ткани глаза с использованием МКЛ из материала «Кемерон-1» в качестве транспортного средства.
5. Выводы
1. Получена градуировочная зависимость для определения ципрофлоксацина по собственному поглощению при 277 нм в солянокислом растворе с характеристиками: y = (43500 ![]() 400)x или y = (0,131
400)x или y = (0,131 ![]() 0,001)x; ymin = 0,005; xmin = Cmin = 1,99*10-7 моль/л (0,059 мкг/мл).
0,001)x; ymin = 0,005; xmin = Cmin = 1,99*10-7 моль/л (0,059 мкг/мл).
2. Показано, что время насыщения мягких контактных линз ципрофлоксацином составляет 2 – 3 часа. Сорбционная емкость составляет 1,5-2,5 мг на 1 линзу или около 23 мг/г безводного полимера.
3. Показано, что степень десорбции ципрофлоксацина в сменяемые объемы воды или физраствора близка к 100 % через 3 часа, т.е. сорбция ципрофлоксацина из МКЛ обратима.
4. Показано, что МКЛ из материала «Кемерон-1» можно использовать для местного введения глазных капель, содержащих ципрофлоксацин, в орган зрения.
6. Список литературы:
1. Розенблюм, Ю.З. Основные тенденции развития оптической коррекции зрения [Текст] / Ю.З. Розенблюм // Российский медицинский журнал.-2000.-№1.-С. 40-44.
2. Рыбакова, Е.Г. Закономерности десорбции лекарственных препаратов из мягких контактных линз [Текст] / Е.Г. Рыбакова, С.Э. Аветисов, Г.А. Бадун, А.В. Краснянский // Вестник офтальмологии.-1996.-№1.-С. 18-21.
3. Даниличев, В.Ф. Лечебные мягкие контактные линзы на основе полимерных гидрогелей [Текст] / В.Ф. Даниличев, С.С. Иванчев, И.А. Умаков, В.И. Павмоченко, В.А. Рейтузов, А.С. Бабалиева, Э.В. Муравьёва // Глаз.- 2006.-№5.- С. 11-17.
4. Пак, В.Х. Российский материал для мягких контактных линз [Текст] / В.Х. Пак, В.Д. Жевняк, Т.В. Дикунова,Ю.Ф. Хатминский, Е.В. Прозорова // Глаз.-2007.-№1.-С.6-9.
5. Старучинский, Л.С. [Текст] / Л.С. Старучинский, В.А. Кречиков // Клиническая микробиология и антимикробная химиотерапия.- 2001.- Т.3.- №3.-С. 243-252.
6. Соколов, В.Д. Перспективы применения химиопрепаратов [Текст] / Кафедра фармакологии и токсикологии СПГ АВМ. Обзор.
7. Дженкинс, Г. Химия органических лекарственных препаратов [Текст] / Г. Дженкинс, У. Хартунг - М.: Гос. издательство иностранной литературы.-1941.-740 с.
8. Общая характеристика препаратов группы фторхинолонов [Электрон. ресурс] - Электронная текстовая программа-
http://dsmu.donetsk.ua/library/lom/lom1.htm.
9. Тест-системы RIDASCREEN Enro/Cipro [Текст] / Обзор.
10. НД 42 – 1534 – 98 Фармакопейного госкомитета Министерства здравоохранения РФ.
11. Временная фармакопейная статья 42 – 2534 – 95 Фармакопейного комитета Министерства здравоохранения РФ.
12. Титов, И.В. Использование метода УФ-спетрофотометрии для установления подлинности лекарственных средств группы фторхинолонов [Текст] / И.В. Титов, В.Л. Дорофеев, А.П. Арзамасцев // Вестник ВГУ. Серия: Химия. Биология. Фармация.-2004.-№2.-С. 264-269.
13. 42 – 3849 – 95 Фармакопейного госкомитета Министерства здравоохранения РФ.
14. Временная фармакопейная статья 42 – 2534 – 95 Фармакопейного комитета Министерства здравоохранения РФ.
15. Минаев, Ю.Л. Основные характеристики мягких контактных линз [Электрон. ресурс]- Электронная текстовая программа / Ю.Л. Минаев // Приложение к журналу «Глаз» - М.-http://www.contlenses.com.
16. Головнев, Н.Н. Синтез новых соединений ципрофлоксацина [Текст] / Н.Н. Головнев, Т.Д. Чурилов, А.Д. Васильев, М.С. Молокеев // Вестник КрасГУ. Неорганическая химия. УДК 541.49.
17. Дорофеев, В.Л. Номенклатура и фармакопейный анализ лекарственных средств группы фторхинолонов [Текст] / В.Л. Дорофеев // Вопросы биологической, медицинской и фармацевтической химии.-2001.-№4.-С. 5.
18. Говорков, А.Т. Способ получения полимерного материала для мягких контактных линз [Текст] / А.Т. Говорков, В.В. Сталковский, М.П. Фомина, Ф.Е. Веренцов // Патент РФ № 2058328.-1993.
19. Жевняк, В.Д. Способ получения материала для мягких контактных линз [Текст] / В.Д. Жевняк, В.В. Сталковский, М.П. Фомина // Патент РФ № 2119927.-1997.
20. Морозова, Е.М. Основные принципы получения окрашенных мономеров и полимеров и их практическое значение [Текст] / Е.М. Морозова, А.В. Зуйков, О.П. Шапохина // Материаловедение.-2002.-№3.
21. Ушаков, Н.А. Способ изготовления лечебных контактных линз [Текст] / Н.А. Ушаков, С.А. Новиков, В.И. Павлюченко // Патент РФ № 2173868.-2001.
22. Досон, Р. Справочник биохимика [Текст] / Р. Досон, Д. Эллиот, У. Элиот, К. Джонс – М.: Мир.-1991.- 389 с.
23. Гауптман, З. Органическая химия [Текст] / З. Гауптман, Ю. Трефе, Х. Ремане-Leipzig- 506 с.
24. Пономарев, В.Д. Количественный анализ [Текст]: аналитическая химия: в 2 т. / В.Д. Пономарев.- М.: Высшая школа.-1982.-2 т.-С. 44
25. Применение МКЛ, насыщенных лекарственными препаратами, в лечении заболевания органа зрения [Текст] / Методические рекомендации: Министерство здравоохранения СССР. МНИИ глазных болезней им. Гельмгольца.- М.-1987.
26. Ушаков, Н.А. О применении МКЛ при повреждении и заболевании глаз [Текст] / Н.А. Ушаков, Ю.П. Гудаловский, Э.В. Муравьева // Военно-медицинский журнал.-1992.-№8.
ПРИЛОЖЕНИЕ 1
Таблица П.1.1.
Классификация антибиотиков фторхинолонового ряда
| Поколение | Препарат | Спектр активности |
| I – нефторированные хинолоны | Налидиксиновая кислота Оксолиновая кислота Пипемидиновая кислота | В основном грамотрицательная микрофлора (семейство Enterobacteriaceae) |
| II – «грамотрицательные» фторхинолоны | Норфлоксацин Ципрофлоксацин Пефлоксацин Офлоксацин Ломефлоксацин | Грамотрицательная микрофлора, S. Aureus, низкая активность против Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae |
| III – «респираторные» фторхинолоны | Левофлоксацин Спарфлоксацин Темафлоксацин* | Увеличение активности против Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae |
| IV – «респираторные» + «антианаэробные» фторхинолоны | Тровафлоксацин* Клинафлоксацин* Моксифлоксацин Гемифлоксацин** BMS – 284756** | Увеличение активности противStreptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae, анаэробов |
Отозван с рынка; ** На стадии клинических испытаний
ПРИЛОЖЕНИЕ 2
Синтез фторхинолонов
Методы построения углеродного скелета хинолоновых молекул хорошо известны, и синтез их фторированных производных не представлял бы проблемы, если бы атомы фтора можно было ввести в уже готовые хинолоновые молекулы. Поскольку прямое введение атомов фтора в ароматическое кольцо связано со значительными трудностями, совершенно очевидно, что стратегия синтеза фторхинолонов должна базироваться на использовании исходных веществ, которые уже содержат атомы фтора, причем в строго определенных положениях ароматического кольца. Ретроспективный анализ показывает, что для получения 6-фторхинолонов пригодны 3-галоген-4-фторзамещенные анилины либо 2,4-дигалоген-5-фторзамещенные бензойные кислоты.
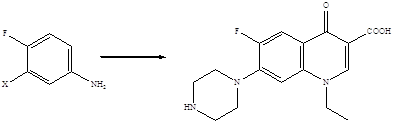
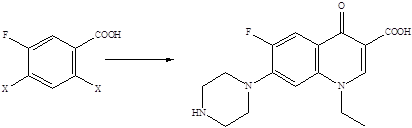
X = F, Cl, Br
4-Фторанилины и 3-фторбензойные кислоты – базовые структуры для получения 6-фторхинолонов
Для получения базовых фтораренов в промышленности чаще всего используют реакции нуклеофильного замещения галогена или диазогруппы фторид-анионом, а далее, как уже отмечалось выше, существуют две стратегии синтеза фторхинолонкарбоновых кислот.
В первом случае фторсодержащие анилины конденсируют сначала с этоксиметиленмалоновым эфиром, а затем проводят внутримолекулярную циклизацию с замыканием пиридонового цикла по реакции Гоулда-Джекобса. Далее NH-хинолон алкилируют, гидролизуют и замещают атом галогена в положении 7 на остаток пиперазина.
Второй метод построения предполагает использование в качестве исходного сырья фторсодержащих производных бензойной кислоты. Ключевым интермедиатом в этом случае является соответствующий ![]() -кетоэфир, который далее конденсируют с орто-муравьиным эфиром. В полученном бензоилакрилате замещают этоксигруппу на остаток амина с последующей внутримолекулярной циклизацией
-кетоэфир, который далее конденсируют с орто-муравьиным эфиром. В полученном бензоилакрилате замещают этоксигруппу на остаток амина с последующей внутримолекулярной циклизацией ![]() -амино-
-амино-![]() -бензоилакрилата в хинолоновый бицикл.
-бензоилакрилата в хинолоновый бицикл.
|


X = F или Cl
Принципиальные схемы синтеза фторхинолонов [5]
ПРИЛОЖЕНИЕ 3
Дальнейшее совершенствование структуры фторхинолонов.
Работы по синтезу более совершенных молекул фторхинолонов продолжаются, и одним из перспективных направлений поиска является создание антибактериальных агентов с двойным механизмом действия. Как уже отмечалось, одним из недостатков цефалоспориновой группы антибиотиков является сравнительно низкая устойчивость C-N-связи циклического амида к действию бактериальных ![]() -лактамаз. Этого недостатка лишены так называемые антибиотики двойного действия, представляющие собой по своей химической структуре гибриды цефалоспоринов с фторхинолонами.
-лактамаз. Этого недостатка лишены так называемые антибиотики двойного действия, представляющие собой по своей химической структуре гибриды цефалоспоринов с фторхинолонами.

Пример антибактериального препарата с двойным механизмом действия
В данном случае остаток фторхинолона флероксацина связан с антибиотиком цефотаксимом через карбоксильную группу хинолона. Такой тип сочленения не является обязательным – в других (также удачных) случаях молекулу цефалоспорина присоединяют через сложноэфирную связь к пиперазиновому фрагменту фторхинолонов.
Принципиально важным условием является то, чтобы остаток фторхинолона был связан с положением С-3' цефалоспоринового бицикла, поскольку именно в этом случае при действии бактериальных ферментов происходит раскрытие ![]() -лактамного цикла, освобождающее молекулу фторхинолона в виде уходящей группы.
-лактамного цикла, освобождающее молекулу фторхинолона в виде уходящей группы.

Химизм действия цефалоспоринов, конъюгированных с фторхинолонами
Таким образом, спектр антибактериальной активности конъюгированных фторхинолонами ![]() -лактамных антибиотиков расширяется за счет взаимодополняющих механизмов их действия
-лактамных антибиотиков расширяется за счет взаимодополняющих механизмов их действия
После того как в ходе исследований было установлено, что оптически активный офлоксацин с S-конфигурацией углерода, несущего метильную группу (основа препарата левофлоксацина), в два раза более активен по сравнению с рацематом (смесью S- и R-энантиомеров) и обладает меньшей токсичностью, все большее внимание уделяется пространственной структуре фторхинолонов, содержащих асимметрические атомы углерода.

В левофлоксацине метильная группа занимает определенное пространственное положение относительно других заместителей
В этой связи перспективным направлением модификации фторхинолонов следует считать введение в положение 7 остатков сложных бициклических аминов и выделение из рацематов индивидуальных пространственных изомеров.

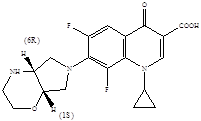
Фторхинолоны с двумя одинаковыми остатками цис-2-окса-5,8-диазабициклононана обладают разной активностью за счет различной пространственной ориентации асимметрических атомов углерода
Так, из двух приведенных энантиомерно чистых цис-изомеров 7-(2-окса-5,8-диазабицикло[4.3.0]нонил-8) замещенного фторхинолона энантиомер с 1R,6S-конфигурацией асимметрических атомов углерода оказался в 2-6 раз более активным по сравнению со своим зеркальным антиподом [6].
ПРИЛОЖЕНИЕ 4
Классификация материалов мягких контактных линз
Группа 1. Неионные полимеры. Низкое содержание воды.
Благодаря неионной структуре (нейтральный электрический заряд) и низкому содержанию воды эти материалы наименее предрасположены к отложениям.
Все линзы этой группы делают из полимеров, состоящих из поперечно сшитых молекул рНЕМА. Первым таким материалом, использованным в США для изготовления МКЛ, был полимакон, полученный, как уже отмечалось, путем плотного сшивания рНЕМА с помощью небольшого числа мостиков из этиленгликольдиметакрилата. Полимакон и в настоящее время остается одним из наиболее широко распространенных материалов группы 1. Полимакон используют такие фирмы как Bausch&Lomb (традиционные линзы дневного ношения Optima 38, планово сменяемые линзы гибкого режима ношения Optima FW), Ocular Sciences Inc. (традиционные линзы дневного ношения Versa Scribe Edge III) и другие.
По законам диффузии, контактная линза половинной толщины имеет вдвое большую кислородопроницаемость при прочих равных условиях. Поэтому поиски новых материалов, пригодных для изготовления тонких линз, привели к появлению сополимеров NVP с метилакрилатом и глицерилметакрилата с ММА (метилметакрилат).
Например, тетрафилкон (Cooper Clear, CooperVision Inc.) – это трехзвенный полимер НЕМА (2-гидроксиэтилметакрилат), VP и ММА, сшитых мостиками из дивинилбензола (DVB). В эту группу входит также фемфилкон (Durasoft, Wesley-Jessen) - сополимер НЕМА и 2-этоксиэтилметакрилата.
Группа 2. Неионные полимеры. Высокое содержание воды.
Материалы этой группы также электрически нейтральны, что делает их более устойчивыми к образованию отложений, чем ионные материалы с высоким содержанием воды.
В эту группу входят различные сополимеры (типа NVP и ММА), обеспечивающие высокое содержание воды. Линзы из этих сополимеров часто используются для ношения по графику плановой замены. Типичными примерами являются линзы плановой замены SofLens 66 (Bausch&Lomb), изготовленные из альфафилкона А с 66% воды, линзы Focus Dailies (CIBA Vision Corp.) из нелфилкона А с 69% воды, а также линзы с УФ-защитой Precision UV (Wesley-Jessen) из сурфилкона А с 74% воды. Количество воды в линзах этой группы определяется количеством поперечных сшивок. Для сшивки может быть использован PVA (поливиниловый спирт), который также обеспечивает высокую смачиваемость полимера водой.
В основном из материалов с высоким содержанием воды делают линзы, которые подлежат более частой замене, чем линзы, изготовленные из материалов с низким влагосодержанием. Кроме того, линзы с высоким влагосодержанием, как правило, менее прочны по сравнению с низкогидрофильными линзами.
Группа 3. Ионные полимеры. Низкое содержание воды.
Все линзы этой группы делают из полимеров, состоящих из поперечно сшитых молекул НЕМА, МА и третьего агента. Материалы из чистого НЕМА слишком мягки и легко рвутся. МА обеспечивает большую смачиваемость и влагопоглощение. Например, линзы традиционного ношения DuraSoft 2 и цветные линзы DuraSoft 2 Colors/or Light Eyes компании Wesley-Jessen изготавливают из фемфилкона А (38%), являющегося сополимером НЕМА, этоксиэтилметакрилата (ЕОЕМА) и МА.
Наличие отрицательного заряда на поверхности линз способствует отложению положительно заряженных молекул белков и жиров слезы. Линзы третьей группы в большей степени привлекают к себе различные продукты слезы, чем линзы первых двух групп.
В целом можно отметить, что МКЛ этой группы составляют небольшую долю в спектре производимых в настоящее время МКЛ.
Группа 4. Ионные полимеры. Высокое содержание воды.
Материалы четвертой группы применяются для изготовления целого ряда высококачественных линз частой плановой замены, планово сменяемых линз и традиционных линз гибкого и пролонгированного ношения.
Полимеры этой группы являются самыми химически активными веществами из всех групп. Наличие электрического заряда и высокое влагосодержание способствуют активному вступлению этих материалов в реакции с растворами и отложению продуктов слезы на поверхности линзы.
Материалы этой группы также очень чувствительны к окружающей среде. Они предрасположены к дегидратации и могут преждевременно пожелтеть или быстро испортиться при использовании для дезинфекции метода нагревания. Они также обесцвечиваются в результате взаимодействия с химическими агентами, содержащимися в растворах, применяемых для ухода за МКЛ. Воздействие на линзы кислыми растворами (с низким рН) может привести к временным изменениям параметров линзы.
Материал этафилкон, полученный сополимеризацией НЕМА с МА и метакрилатом натрия, используется для изготовления линз как третьей, так и четвертой группы в зависимости от пропорций входящих в него компонентов. Этафилкон А используется для производства линз четвертой группы пролонгированного и дневного режима ношения, например линз частой плановой замены с УФ-защитой Acuvue (Vistakon) c 58% воды.
Фемфилкон А (55%), применяемый для изготовления линз DuraSoft 3 и Fresh Look компании Wesley-Jessen, является сополимером НЕМА и ЕОЕМА. Последний компонент введен для придания линзе механической прочности.
Отметим также в этой группе линзы частой плановой замены HighTime55 (Biomedics 55, Ocular Sciences Inc.), изготовленные из окуфилкона с 55% воды и линзы серии Focus (CIBA Vision) из вифилкона А с 55% воды (сополимер НЕМА и NVP). Наличие заряженной лактамной группы в пиролидоне (NVP) усиливает поглощение полимером воды.
ПРИЛОЖЕНИЕ 5
Методы изготовления мягких контактных линз
Центробежное формование. Этот метод был применен для изготовления первых МКЛ и в усовершенствованной модификации используется до настоящего времени. Суть метода состоит в том, что жидкий полимер инжектируется прямо во вращающуюся форму. Окончательная форма линзы и ее параметры определяются такими особенностями процесса формования как температура, скорость вращения, объем инжектированного полимера и др. Во время вращения формы полимер подвергается воздействию также тепла и/или ультрафиолетового излучения, в результате чего жидкий полимер отвердевает. Далее линза вынимается из формы, гидратируется и подвергается такой же обработке, как и при точении линзы.
Центробежное формование является довольно дешевым методом производства МКЛ. Оно обеспечивает хорошую воспроизводимость и стабильность параметров линзы и дает очень тонкий, комфортный край. Линзы, полученные этим методом, имеют малую толщину и обладают асферической геометрией задней поверхности, хорошо соответствующей геометрии роговицы глаза. Кривизна линзы постепенно уменьшается от центра к периферии. К недостаткам метода можно отнести невозможность получения линз со сложной геометрией, например, торических МКЛ. Кроме того, линзы, изготовленные методом центробежного формования, из-за своей асферичности нельзя точно сопоставлять с какой-либо определенной базовой кривизной. Однако опыт показывает, что при подборе таких МКЛ, как правило, не возникает проблем и в практике вполне допустимо использование понятия базовой кривизны и ее радиуса. Можно также отметить, что из-за малой толщины и повышенной гибкости линз, произведенных методом центробежного формования, с ними относительно сложно обращаться, особенно, если линзы имеют малую оптическую силу. Такие линзы слабо перемещаются на глазу, однако это не препятствует поступлению слезной жидкости (обогащенной кислородом) под линзу и удалению продуктов распада из-под нее.
Точение. Точение широко используется для изготовления, как МКЛ, так и РММА линз и жестких газопроницаемых линз. Для точения (токарной обработки на станке) применяют жесткие ("сухие") заготовки из заранее полимеризованного материала. Причем используемые для точения материалы могут иметь характеристики, отличающиеся от характеристик полимера, полученного при центробежном формовании.
Точение включает следующие этапы:
- обработка на токарном станке. Применение компьютерного контроля позволяет получать поверхности с двумя и даже большим числом радиусов кривизны задней поверхности;
- полирование для удаления следов резца;
- насыщение водой до необходимой концентрации;
- химическое удаление из линзы всех посторонних примесей;
- тонирование;
- контроль качества и проверка соответствия параметров заданным значениям;
- стерилизация (тепловой нагрев до 121°-124° С в течение по крайней мере 20 мин.);
- упаковка и маркировка.
Точение является более дорогостоящим методом, чем центробежное формование или литье. Однако этот метод очень полезен для изготовления небольших партий линз, линз со сложной геометрией или по индивидуальному заказу для конкретного пациента.
Линзы, изготовленные точением, как правило, несколько толще, чем линзы, изготовленные другими методами, и вследствие этого имеют меньшую кислородную проницаемость.
Литье. Литье - менее трудоемкий метод, чем точение. При больших масштабах производства позволяет изготавливать достаточно дешевые линзы. Многие планово сменяемые МКЛ и линзы частой плановой замены делают с помощью литья.
Сначала делается металлическая форма-матрица. Для каждого набора параметров линз изготавливается своя металлическая матрица. Далее по этой матрице делают тысячи пластиковых форм-копий. Жидкий полимер заливают в нижнюю половину пластиковой формы, сверху внутрь этой половинки вставляется верхняя часть формы. В пространстве между соединенными таким образом половинками формы, заполненном жидким полимером, и будет получена линза после облучения всей формы ультрафиолетовым излучением. Полученная "сухая" линза удаляется из формы, насыщается водой и подвергается уже описанным выше этапам обработки.
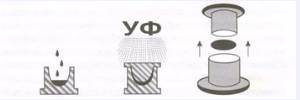
Схематическое изображение процесса изготовления линз методом литья
Примером дальнейшего усовершенствования методов изготовления МКЛ является, так называемый Реверсивный процесс III, используемый в настоящее время фирмой Bausch&Lomb. Суть процесса состоит в том, что переднюю, поверхность линзы получают методом центробежного формования, а заднюю поверхность - токарной обработкой. Преимущества этого метода состоит в том, что передняя поверхность линзы получается более гладкой, чем при точении на токарном станке, что придает линзе высокие оптические характеристики, обеспечивает удобство ношения и идеальный профиль кромки. Задняя поверхность, полученная точением, обеспечивает хорошие функциональные качества, включая оптимальное перемещение и центровку. При токарной обработке можно изготовлять линзы достаточно сложной геометрии.
0 комментариев