Навигация
Молекулярная масса антибиотиков варьируется от 150 до 5000
1. Молекулярная масса антибиотиков варьируется от 150 до 5000.
2. Молекулы одних антибиотиков состоят или только из углерода и водорода, или чаще из углерода, кислорода, водорода и азота; другие антибиотики содержат также атомы серы, фосфора или галогенов.
3. В молекулах антибиотиков представлены почти все функциональные группы, известные в органической химии (гидроксильная, карбоксильная, карбонильная, азотсодержащие функциональные группы и т. д.), а также структуры, характерные для органических веществ (алифатические и алициклические цепи, ароматические кольца, гетероциклы, углеводы, полипептиды и т. д.).
Общим для всех антибиотиков является то, что это твердые органические вещества. Почему практически отсутствуют жидкие антибиотики – не вполне ясно. При комнатной температуре в твердом состоянии находятся обычно высокомолекулярные вещества или вещества, молекулы которых содержат несколько полярных групп [6]. Обычно антибиотики действительно содержат полярные группы, участвующие во взаимодействии с макромолекулами бактерий, что и приводит к подавлению роста последних. Возможно, именно поэтому даже низкомолекулярные антибиотики являются твердыми веществами [7].
2.2 Механизм действия антибиотиков
Антибиотики подавляют рост чувствительных к ним микроорганизмов, ингибируя функции макромолекул, необходимых для жизнедеятельности клетки, таких как ферменты или нуклеиновые кислоты [16]. Молекула антибиотика связывается со специфическим участком макромолекулы - мишени, образуя нефункциональный молекулярный комплекс.
Чтобы определить механизм действия антибиотика, нужно выявить макромолекулу - мишень и установить ее функции. Обычно легче выяснить, какая функция нарушена, чем определить, какая макромолекула является мишенью [8]. Поэтому считают, что антибиотики подавляют синтез клеточной стенки, белка или РНК, репликацию ДНК или функционирование мембран, в зависимости от того, что является первичным эффектом антибиотика.
Некоторые антибиотики представляют собой антиметаболиты, действующие по типу конкурентных ингибиторов [6]. По структуре они близки к нормальным метаболитам, таким как аминокислоты или коферменты, и, связываясь с ферментом, для которого нормальный метаболит является субстратом или кофактором, инактивируют его.
Избирательность действия антибиотиков и, следовательно, причина подавления роста только определенных типов клеток обычно связаны с механизмом их действия [7].
2.3 Химическая модификация антибиотиковУ сравнительно сложных веществ, к которым относятся и некоторые антибиотики, определенные компоненты структуры или химические группировки непосредственно участвуют в образовании комплекса с макромолекулой - мишенью. Другие структурные компоненты или группировки не принимают прямого участия во взаимодействии с мишенью, и их можно модифицировать без значительного изменения активности препарата [7].
Благодаря таким изменениям структуры удается модифицировать некоторые физико-химические свойства молекулы антибиотика, в частности растворимость в воде или липидах, что сильно сказывается на фармакокинетике препарата и, следовательно, на возможности его использования в лечебных целях [6]. Те же самые свойства (растворимость в воде или липидах и т. д.) могут влиять на спектр действия препарата, поскольку от них зависит его способность проникать в клетку.
Изменения свойств молекулы, которые не влияют на ее активность, на молекулярном уровне, т. е. на способность антибиотика образовывать комплекс с макромолекулой в бактериальной клетке, имеют важное значение для биологической активности in vivo и для практической ценности этого антибиотика [4]. Более или менее значительные модификации исходной молекулы могут сопровождаться существенными изменениями ее способности проникать через клеточную мембрану, поступать в ткани организма хозяина, а также восприимчивости к действию различных ферментов [1].
В 50-х годах 20 века к возможности значительного улучшения лечебных свойств антибиотиков с помощью химической модификации природных продуктов относились весьма скептически [7]. Эти взгляды основывались на безуспешности попыток модификации препаратов, применявшихся в то время, и на убеждении, что невозможно повысить активность природного продукта.
Первый аргумент был совершенно неправомочен, поскольку при этом подразумевалось, что все антибиотики являются представителями одного класса, и свойство, справедливое только для некоторых случаев, приписывалось всем антибиотикам. Что же касается высказывания о том, что природу невозможно улучшить, то это действительно так, если речь идет о продукте, являющемся результатом естественного отбора, действующего в течение миллионов лет [8]. Однако в случае антибиотиков этот естественный отбор так или иначе был направлен на выживание организма - продуцента в природной среде обитания, но, конечно, не на повышение терапевтической активности антибиотика, а именно это последнее и является для нас мерой «улучшения» [7].
Из всего сказанного ясно, почему получили столь широкое развитие работы по химической модификации природных антибиотиков, сыгравшие в последние годы важную роль в создании новых терапевтических препаратов. Действительно, сегодня многие антибиотики, применяемые в клинике, являются полусинтетическими [6].
2.4 Фторхинолоны как один из классов антибиотиков нового поколенияПринципиально новым классом сильнодействующих антибактериальных препаратов являются соединения фторхинолонового ряда.
В конце ХХ столетия среди основных химиотерапетических средств для лечения инфекций одно из важных мест заняли фторхинолоны – большая группа высокоэффективных антимикробных препаратов с широкими показаниями к применению [5]. Термин «фторхинолоны» (наиболее точно – 6-фторхинолоны) характеризует принадлежность препаратов к классу хинолонов (или родственным по структуре соединениям) с наличием атома фтора в молекуле, причем в строго определенном положении 6 хинолонового цикла.
Все препараты класса хинолонов, независимо от наличия или отсутствия фтора в молекуле, объединены единым механизмом действия на микробную клетку: их основной мишенью является ДНК-гираза – один из ключевых ферментов клетки, определяющий нормальный процесс биосинтеза ДНК и деления клетки. Поэтому данный класс веществ часто обозначают общим термином - ингибиторы ДНК-гиразы [8].
В медицинской химии существует более широкое понятие класса хинолонов, структурной основой которого является фрагмент 1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Начало этому классу химиопрепаратов было положено в 1962 году с внедрением в медицинскую практику налидиксовой кислоты (невиграмона), а затем ее близких структурных аналогов: оксолиниевой, пиромидиевой и пипемидиевой кислот [6].
Представители первого поколения хинолонов:
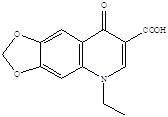

Налидиксиновая кислота Оксолиниевая кислота (грамурин) [6]
(невиграмон, неграм)
Нефторированные хинолоны (первое поколение) имеют ограниченный спектр действия с преимущественной активностью в отношении некоторых грамотрицательных бактерий, главным образом из группы энтеробактерий. Особенности фармакокинетики нефторированных хинолонов позволяют применять эти препараты при чувствительном возбудителе только для лечения инфекций мочевыводящих путей и некоторых кишечных инфекций [16]. Достаточно быстрое развитие лекарственной резистентности к нефторированным хинолонам у клинических штаммов бактерий существенно ограничивает их применение в клинике, хотя некоторые препараты этой группы до сих пор представлены на фармацевтическом рынке (например, налидиксовая кислота, оксолиниевая кислота, пипемидиевая кислота) [6].
Принципиально новые по степени активности, широте антимикробного спектра и особенностям фармакокинетики соединения получены при введении в молекулу хинолона атома фтора в положение 6 цикла и строго определенных заместителей в положение 7 (шестичленный пиперазинильный радикал или его аналоги) [7]. Относительно невысокая токсичность полученных соединений позволила разработать серию высокоактивных антимикробных препаратов, некоторые из которых уже прочно вошли в мировую клиническую практику и определили формирование важнейшей группы антимикробных препаратов – фторхинолонов [8].
Второе поколение хинолонов представлено широким рядом производных (норфлоксацин, пефлоксацин, ципрофлоксацин и др.).
Представители второго поколения хинолонов – монофторированные производные:
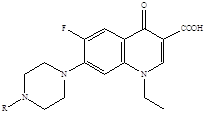
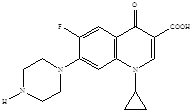
R = H норфлоксацин (нолицин, норбактин); Ципрофлоксацин (ципробай,
R = CH3 пефлоксацин цифран, ципринол, ципролет)
Они появились на мировом фармацевтическом рынке в середине 80-х годов и быстро завоевали признание как препараты с исключительно высоким уровнем активности (в десятки и сотни раз превосходящей ![]() -лактамные антибиотики) и широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой и практически полным отсутствием резистентности [22]. Благодаря своим уникальным характеристикам фторхинолоны сразу привлекли внимание ведущих фармацевтических фирм, которые в сжатые сроки наладили промышленный выпуск серии (более 20 наименований) клинически наиболее важных фторхинолонов. О бурном развитии научных исследований в этой области можно судить по числу синтезированных веществ фторхинолонового ряда, которое уже превысило отметку 10 000 [5]. «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций [6].
-лактамные антибиотики) и широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой и практически полным отсутствием резистентности [22]. Благодаря своим уникальным характеристикам фторхинолоны сразу привлекли внимание ведущих фармацевтических фирм, которые в сжатые сроки наладили промышленный выпуск серии (более 20 наименований) клинически наиболее важных фторхинолонов. О бурном развитии научных исследований в этой области можно судить по числу синтезированных веществ фторхинолонового ряда, которое уже превысило отметку 10 000 [5]. «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций [6].
Следующее поколение хинолонов представлено молекулами спарфлоксацина, ломефлоксацина и темафлоксацина, содержащими два и три атома фтора.
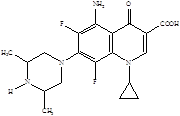
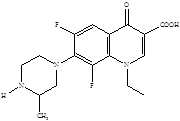
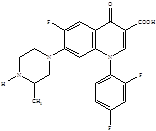
Ломефлоксацин Спарфлоксацин Темафлоксацин [5]
(максаквин)
Дальнейшие модификации химической структуры привели к появлению соединений, активных и в отношении анаэробов. Однако многие из вновь разработанных препаратов не достигли пациентов или были быстро отозваны с рынка вследствие развития тяжелых нежелательных реакций [7]. Одним из новых препаратов, который стал успешно применяться, явился моксифлоксацин – представитель IV поколения фторхинолонов.
Наиболее важными в молекуле фторхинолонов, отвечающими за их антимикробные свойства, являются группы, занимающие позиции 1, 7 и 8. Циклопропиловая группа в положении 1 обеспечивает активность против грамотрицательных микроорганизмов [6]. Присоединение дополнительного кольца в позиции 7 придает высокую активность по отношению к грамположительной микрофлоре, включая пневмококки.
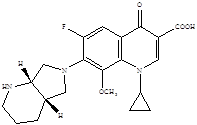
Химическая структура моксифлоксацина:
1-Циклопропил-7[(S,S)-2,8-диаза-бицикло(4.3.0.)-8-ил]-6-фтор-1,4-дигидро-4-оксо-3-хинолкарбоновой кислоты гидрохлорид
Добавление в структуру молекулы метоксигруппы в положении 8 привело к повышению активности в отношении анаэробов без увеличения риска потенциальной фототоксичности.
Классификация фторхинолонов [6] представлена в таблице П.1.1..
2.4.1 Отличие фторхинолонов от других групп антибактериальных агентовСравнение антибактериальной активности фторхинолонов с ![]() -лактамными (пенициллинами, цефалоспоринами) и другими антибиотиками свело эти две совершенно разные по своему происхождению группы антибактериальных агентов в рассмотрение в одни и тех же книгах [8]. Следует подчеркнуть, однако, что фторхинолоны не имеют отношения к биотехнологии и являются продуктами синтетическими. Это отличает их от полусинтетических антибиотиков, отдельные фрагменты которых получают с участием микроорганизмов [5].
-лактамными (пенициллинами, цефалоспоринами) и другими антибиотиками свело эти две совершенно разные по своему происхождению группы антибактериальных агентов в рассмотрение в одни и тех же книгах [8]. Следует подчеркнуть, однако, что фторхинолоны не имеют отношения к биотехнологии и являются продуктами синтетическими. Это отличает их от полусинтетических антибиотиков, отдельные фрагменты которых получают с участием микроорганизмов [5].
Различен и механизм действия фторхинолонов. Соединения этого класса обладают способностью проникать через клеточные мембраны и селективно воздействовать на размножение бактерий путем ингибирования бактериальной ДНК-топоизомеразы II (ДНК-гиразы) – фермента, отвечающего за разрыв и восстановление суперскрученной спирали ДНК. Согласно современным представлениям, молекулы хинолона связываются с ДНК, образуя сложный комплекс из четырех молекул фторхинолона, двойной спирали ДНК- и ДНК-гиразы [6]. Образование такого комплекса происходит в тот момент, когда гираза осуществляет разрезание обеих цепей ДНК. Тем самым нарушается процесс размножения бактерий. Следует отметить, что механизм действия фторхинолонов принципиально отличается от механизмов действия других групп бактериальных препаратов: пенициллинов, цефалоспоринов, аминогликозидов, сульфамидов, что особенно важно для лечения инфекционных заболеваний, вызванных резистентными к этим препаратам штаммами бактерий [8].
2.4.2 Механизм действия фторхинолоновВсе фторхинолоны действуют бактерицидно благодаря ингибированию ферментов класса топоизомераз – ДНК-гиразы (топоизомеразы II) и топоизомеразы IV [16].
Эти ферменты выполняют строго определенные функции в процессе формирования пространственной структуры молекулы ДНК при ее репликации: ДНК-гираза катализирует расплетение (отрицательиую суперспирализацию) нитей ДНК, а топоизомераза IV участвует в разъединении (декатенации) ковалентно-замкнутых кольцевых молекул ДНК. Ингибированне этих ферментов нарушает процессы роста и деления бактериальной клетки, что приводит к ее гибели [23].
Основной мишеныо в грамположительных микроорганизмах преимущественно является топоизомераза IV, а в грамотрицательных – ДНК-гираза [6].
Механизмы резистентности
Развитие резистентности связано с мутациями в генах gyrA и gyrB (кодируют ДНК-гиразу), раrС (grlA) и _are (grlB) – кодируют топоизомеразу IV, а также в гене norА (кодирует мембранные белки, которые участвуют в активном выбросе – эффлюксе – фторхинолонов из клетки). Высокий уровень резистентности возникает вследствие сочетания этих механизмов [7].
Мутации, возникающие в генах gyrA, gyrB, раrС и раrЕ, достаточно значительно влияют на активность фторхинолонов I, II, III поколений, а на активность моксифлоксацина – фторхинолона IV поколения – меньше. Например, мутации у S. Aureus в генах, кодирующих топоизомеразы, меньше снижают активность моксифлоксацина, чем ципрофлоксацина, офлоксацина, левофлоксацина, спарфлоксацина [8].
У Escherichia coli двойная мутация гена gyrA приводит к снижению IC150 норфлоксацниа, ципрофлоксацина и спарфлоксацина по сравнению с таковой у немутировавшего типа более чем в 500 раз, в то время как для моксифлоксацина этот показатель не превышает 12 раз [5].
Эффлюкс (мутация в гене nor А) значительно меньше влияет на активность гидрофобных препаратов, таких, как моксифлоксацин, по сравнению с таковой у гидрофильных препаратов, например у ципрофлоксацина.
При применении моксифлоксацина вероятность развития резистентности у грамположительных микроорганизмов, возможно, ниже, чем при применении других фторхинолонов, что связано с его высоким сродством как к топоизомеразе IV, так и к ДНК-гиразе [6].
2.4.3 Применение фторхинолонов и связанные с этим проблемыФторхинолоны хорошо сочетаются с пенициллинами и аминогликозидами. Допустимо совместное применение с макролидами и тетрациклинами, хотя может проявляться ослабление их действия [6].
Не рекомендуется назначать фторхинолоны с нестероидными противовоспалительными средствами и нельзя сочетать с метилксантинами – кофеином и, особенно, теофиллином, т.к. возможны судороги [8].
Из других побочных явлений – раздражающее воздействие на желудочно-кишечный тракт (при пероральном назначении). Возможно негативное влияние на печень, ЦНС, появление кожно-аллергических сыпей, но у небольшого количества пациентов [7]. В целом фторхинолоны малотоксичные соединения. Применяются при многих бактериальных инфекциях и в хирургической практике.
На сегодняшний день синтезировано достаточное количество фторхинолонов, таких как: ципрофлоксацин, эноксацин, норфлоксацин, офлоксацин, ломефлоксацин, флероксацин, перфлоксацин, энрофлоксацин и др. Зарубежные фирмы выпускают фторхинолоны специально для ветеринарии в форме премиксов и растворов с 5 и 10% содержанием АДВ [17].
Например, энрофлоксацин (энроксил) активен в отношении грамположительной и грамотрицательной микрофлоры, в т.ч. микоплазм. Препарат малотоксичен, LD50 для белых крыс 5000 мг/кг. Собаки переносят дозы в 40 раз превышающие терапевтические. После введения терапевтической дозы препарат циркулирует в организме в лечебных концентрациях уже через 0,5 ч, сохраняясь на этом уровне более 24 ч [9].
Назначают телятам, поросятам, цыплятам, плотоядным при инфекциях дыхательных путей, желудочно-кишечного тракта, мочевыводящих путей, кожи в форме инъекций (внутримышечно) и в форме порошка (с водой) в дозах 2,5-5 мг/кг, однократно. Выпускается в форме 5% растворов и 5% порошка [9].
В результате неправильного применения, увеличения лечебной дозы, а так же несоблюдения сроков ожидания, остаточные количества фторхинолонов могут попадать в молоко, мясо, яйца, предназначенные в пищу людям. Это является причиной развития дисбактериозов, пищевых аллергий, повышения устойчивости патогенных микроорганизмов [10]. Кроме того, наличие следовых количеств фторхинолонов в продуктах питания является причиной развития функциональных нарушений со стороны центральной нервной системы, особенно у детей, что проявляется судорогами, расстройствами слуха и зрения [9].
Согласно европейскому законодательству (Директива ЕС 2377/90) установлены максимально допустимые уровни фторхинолонов в продукции животного происхождения для 2-х соединений этой группы: энрофлоксацина и ципрофлоксацина [10].
Согласно Постановлению Минсельхозпрода РБ от 16.12.2005 г. № 78 об утверждении «Правил осуществления контроля за содержанием вредных веществ и их остатков в живых животных и продукции животного происхождения при экспорте их в страны Европейского Союза» энрофлоксацин включен в перечень фармакологических веществ, на который установлен максимально допустимый уровень остатков [10].
2.5 Методы определения ципрофлоксацина – антибиотика фторхинолонового ряда 2.5.1 Определение содержания ципрофлоксацина методом ВЭЖХЦипрофлоксацин методом ВЭЖХ определяют в таблетках и глазных каплях. Данным методом можно определить 90 - 110% активного вещества от заявленного количества. Разделение проводят на колонке SS 4,0 мм ![]() 250 мм, C18 (L1) в системе фосфорная кислота, доведенная до pH = 3 триэтиламином – вода – ацетонитрил при скорости потока 1,5 мл/мин. Детектирование - в УФ свете при длине волны 278 нм [11].
250 мм, C18 (L1) в системе фосфорная кислота, доведенная до pH = 3 триэтиламином – вода – ацетонитрил при скорости потока 1,5 мл/мин. Детектирование - в УФ свете при длине волны 278 нм [11].
Разделение проводят на пластинках, покрытых слоем смеси силикагеля (0,25 мм). GF 254 (20 ![]() 20 см) в присутствии стандарта. Подвижная фаза: метиленхлорид : метанол : аммония гидроксид : ацетонитрил в соотношении 4 : 4 : 2 : 1. детектирование проводится в УФ свете при 254 и 366 нм. Основное пятно на хроматограмме испытуемого раствора по величине Rf и интенсивности должно соответствовать основному пятну на хроматограмме стандартного раствора [11].
20 см) в присутствии стандарта. Подвижная фаза: метиленхлорид : метанол : аммония гидроксид : ацетонитрил в соотношении 4 : 4 : 2 : 1. детектирование проводится в УФ свете при 254 и 366 нм. Основное пятно на хроматограмме испытуемого раствора по величине Rf и интенсивности должно соответствовать основному пятну на хроматограмме стандартного раствора [11].
Тест-система RIDASCREEN Enro/Cipro предназначена для количественного определения ципрофлоксацина и энрофлоксацина в продуктах животного происхождения методом конкурентного иммуноферментного анализа.
| Вид продукта | Предел обнаружения | Извлекаемость, % |
| Молоко | 1 мкг/кг | 84% |
| Мясо | 10 мкг/кг | 87% |
| Рыба | 10 мкг/кг | 85% |
Чувствительность: данофлоксацин 80-85 %, норфлоксацин 12-15 % [10].
2.5.4 Определение содержания ципрофлоксацина спектрофотометрическим методомЛекарственные вещества группы фторхинолонов имеют характерные УФ-спектры, что обусловлено наличием сложной сопряженной системы в их структуре. Ввиду высоких значений удельного показателя поглощения оптимальная концентрация испытуемого раствора составляет 5 мкг/мл. Метод УФ-спектрофотометрии можно применять для установления подлинности лекарственных средств группы фторхинолонов в виде субстанций и в лекарственной форме «таблетки».
Спектры получают в интервале длин волн от 200 до 450 нм. В качестве растворов сравнения можно использовать воду, 0,01 М HCl, 0,01 М раствор NaOH, 96% этанол [12].
Спектрофотометрическое определение ципрофлоксацина используется для контроля его содержания в препаратах, в частности, в таблетках [13] и глазных каплях [14]. Определение проводят при длине волны (275 ![]() 2) нм в кювете с толщиной слоя 1 см, используя в качестве раствора сравнения 0,1 М раствор кислоты хлористоводородной. Поглощение испытуемого раствора сравнивают с поглощением стандартного раствора, приготовленного растворением точной навески ципрофлоксацина в 0,1 М растворе соляной кислоты.
2) нм в кювете с толщиной слоя 1 см, используя в качестве раствора сравнения 0,1 М раствор кислоты хлористоводородной. Поглощение испытуемого раствора сравнивают с поглощением стандартного раствора, приготовленного растворением точной навески ципрофлоксацина в 0,1 М растворе соляной кислоты.
0 комментариев