Навигация
Разделение анионов методом одноколоночной ИХ
1.1 Разделение анионов методом одноколоночной ИХ
Для большого числа ионов одноколоночной метод обладает высокой чувствительностью и хорошей разделительной способностью. Анионы можно разделить на хроматографической колонке и регистрировать детектором электропроводности, если воспользоваться анионообменной смолой с малой емкостью и эффективным элюентом с низкой электропроводностью. Вторую колонку для “компенсации” фоновой проводимости элюента применять не нужно. Несомненным достоинством одноколоночной системы является тот факт, что, детектор электропроводности подключён непосредственно к анионообменной разделяющей колонке. Это возможно лишь в случае очень низкой концентрации солей в элюенте, а, следовательно, и низкой фоновой проводимости. Однако обычные ионообменные смолы содержат много обмениваемых групп, и для хроматографического разделения анализируемых ионов требуется применять элюент с высокой концентрацией солей. Обменную ёмкость смолы можно изменить, если реакцию присоединения функциональных групп проводить в очень мягких условиях и сократить время взаимодействия. Гьерде и Фритц [4] приготовили несколько ионообменных смол с различной низкой ёмкостью. И ими было обнаружено, что для каждого из трёх исследуемых сочетаний анионов коэффициент селективности оставался неизменным, хотя ёмкость смолы менялась. Этот факт имеет важные следствия для ионообменной хроматографии. Так, существенное снижение ёмкости смолы позволит значительно снизить концентрацию элюента, сохранив исправленное время удерживания неизменным.
В конце 1978 года была разработана простая хроматографическая методика разделения ионов при помощи анионообменной колонки, присоединяющейся непосредственно к детектору электропроводности. Компенсационная колонка не требовалась. В этой схеме были применены два новшества:
a) специальные ионообменные смолы очень малой ёмкостью
b) элюент, обладающий очень низкой электропроводностью
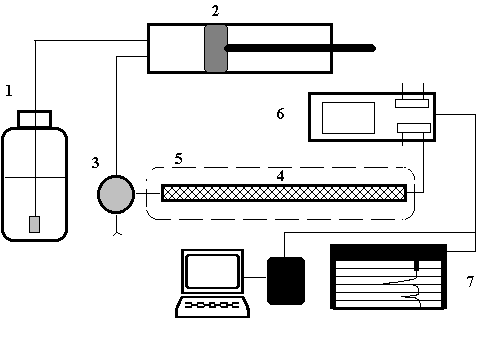
Также, был проведён отбор такого элюента, анион которого сильно удерживается смолой и поэтому даёт малый коэффициент селективности. Данную схему называют “одноколоночной “ ионной” (анионной) хроматографической схемой. На рисунке 1. представлена блок-схема одноколоночного ионного хроматографа.
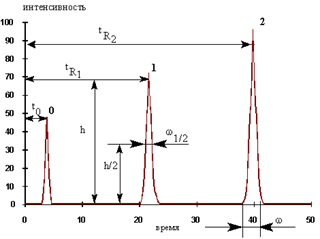
 |  |  |  |  |  | ||||||||
Ёмкость для насос ввод колонка детектор самописец


![]()


![]()
![]()
![]()
![]()
![]()
![]() элюента пробы
элюента пробы

![]() слив
слив
Рис. 1. Блок – схема одноколоночного ионнобменного хроматографа
Он включает в себя следующие компоненты:
1) насос для подачи элюента через пробоотборную петлю, колонку и кондуктометрическую ячейку со скоростью 0.5-2.0 мл/мин;
2) кран для ввода пробы и пробоотборная петля, позволяющую вводить пробу обьёмом 100 мкл;
3) разделяющую колонку в внутренним диаметром 2.0-3.0 мм и длиной 500 мм, заполненную однородными мелкими частицами анионообменной смолы;
4) проточную кондуктометрическую ячейку, являющуюся частью детектора электропроводности, для непрерывной регистрации проводимости элюата;
5) самописец для регистрации выходного сигнала детектора электропроводности.
Одноколоночный метод позволяет осуществить быстрое разделение анионов, причём отсутствие компенсационной колонки никогда не затрудняет анализа. Перед проведением серии анализов выбранный элюент пропускают через анионообменную колонку, пока в ней не установиться равновесие, при котором центры обмена смолы преимущественно будут содержать анионы элюента. При введении образца, в состав которого входят различные анионы, анализируемые анионы будут удерживаться смолой и на эквивалентное количество анионов элюента. В отсутствие перемешивания зона, соответствующая введённому объёму образца, движется вдоль разделяющей колонки со скоростью, равной скорости потока элюента. В этой зоне движутся катионы исходного образца и анионы элюента в концентрации, эквивалентной концентрации анионов в образце. Если электропроводность катионов и анионов в этой зоне больше, чем электропроводность элюента, то при прохождении через детектор электропроводности будет наблюдаться положительный ложный пик. Однако если электропроводность ионов в зоне ниже проводимости элюента, то появиться отрицательный ложный пик. Этот ложный пик не мешает анализу, если элюирование анализируемых анионов происходит после прохождения этого пика. После того как зона, соответствующая объёму пробы, проходит через детектор, нулевая линия быстро восстанавливается до уровня, соответствующего чистому элюенту. Однако растворённые анионы, движимые силами действующих масс элюирующих анионов, смещающих ионообменное равновесие, постепенно перемещаются по колонке. Общая концентрация катионов в растворе определяется концентрацией анионов элюента, поскольку анализируемый анион может перейти в жидкую фазу лишь в результате обмена на эквивалентное количество анионов элюента. Изменение электропроводности при прохождении полосы ионов образца через детектор связано с замещением некоторого количества элюирующих анионов анализируемыми анонами, в то время как суммарная концентрация анионов не меняется. Это изменение прямо пропорционально концентрации анионов данного типа в образце и разнице в эквивалентной электропроводности элюируемого и элюирующего аниона.
Ионообменные смолы нерастворимы. Тонкий порошок такой смолы в хроматографической колонне поглощает ионы тяжелых металлов из раствора, замещая их на кислоту или щелочь. Так, например, готовят воду для питания паровых котлов на больших тепловых электростанциях. Вода очищается от ила и песка и поступает в колонну, наполненную катионитовой смолой. В ней полностью поглощаются соли кальция и магния, делающие воду "жесткой", вместо них появляются ионы водорода - образуется кислота. Подкисленная вода проходит колонну, в которой анионы образовавшихся кислот нейтрализуются, и получается чистая вода. Ионообменные смолы превращают даже соленую морскую воду в пресную, пригодную для питья, и извлекают ценные металлы из промышленных сточных вод.
На ионообменной колонне смогли разделить смесь изотопов редкоземельных элементов. Радиоактивность каждой капли раствора, вытекающего из колонны, измерялась отдельно. Оказалось, что чем выше порядковый номер элемента, тем быстрее он выходит из колонны при хроматогра фическом разделении. И чередование элементов удивительным образом точно соответствует их взаимному положению в периодической системе элементов: америций (№ 95), кюрий (№ 96), берклий (№ 97) и калифорний (№ 98).[4, 11-16]
ГЛАВА 2. ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ ИОНООБМЕННОЙ ХРОМАТОГРАФИИ В АНАЛИЗЕ ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ
Внеколоночное образование ионной пары для разделения смеси карбоновых и оксикислот методом ион-парной вэжх[17]
Определение оптически неактивных окси- и карбоновых кислот как правило осуществляется методом ионной хроматографии с электрохимическим детектором. Проведение разделения и идентификации данных веществ с использованием УФ-детектора возможно при добавлении к элюенту «непрозрачных» в области рабочих длин волн реагентов, образовывающих с определяемым веществом ионную пару и реализацией метода ион-парной ВЭЖХ.
Целью работы было: оптимизация условий образования ассоциата физиологически важных окси- и карбоновых кислот с ион-парным реагентом, хроматографического поведения, разработка основ количественного определения веществ в многокомпонентных рецептурах.
Исследования проводили на хроматографе «Цвет-304» (Россия, г. Дзержинск) в изократическом режиме элюирования сорбатов с УФ-детектором (λ=254нм). Анализы выполняли на стальной аналитической колонке (100х5,4мм), заполненной суспензионным способом сорбентом Силасорб С18 (7,5 мкм). Состав подвижной фазы состоял из фосфатного буферного раствора с добавлением изо-пропилового спирта. В качестве ион-парного реагента были взяты – цетилпиридинийхлорид и бром-N,N,N,N,N,N-гексаэтилметантриамин.
В процессе оптимизации условий разделения и образования ион-парного ассоциата установлено влияние состава и рН элюента, природы и содержания органического растворителя в нем. Проведена сравнительная оценка эффективности применения катионных поверхностно-активных веществ в качестве ион-парных реагентов, а также возможности вне колоночного образования ионной пары.
Результаты исследования послужили основой для разработки методик количественного контроля содержания оптически неактивных окси- и карбоновых кислот в продуктах пищевой, косметической и животноводческой промышленности.
Определение полифенольных соединений подвидов подорожника большого[18]
Изучение состава вторичных метаболитов высших растений представляет интерес как с позиции дифференциации их подвидов, так и с точки зрения ресурсоведения, поскольку полифенольные соединения и флавоноиды обладают широким спектром полезной биологической активности.
Предложена и отработана схема экстракции полифенолов из двух подвидов подорожника большого (ssp. major и ssp. pleiosperma) на примере 114 образцов индивидуальных растений. Выполнено хроматографирование этилацетатных экстрактов методами ТСХ, БХ, колоночной и ионообменной хроматографии в различных элюирующих системах. Идентификацию полифенольных соединений проводили по стандартным образцам (рутин, кверцетин) методами УФ спектроскопии по характерным сдвигам максимумов поглощения соединений после добавления комплексообразующих веществ по стандартной методике или по значениям Rf на пластинках “Силуфол” в фиксированных условиях согласно справочным данным.
Достоверно установлено, что два рассмотренных подвида подорожника большого имеют различный полифенольный состав, что может служить экспресс-методом для их идентификации. Известно, что разделение подвидов по их морфологическим признакам трудоемко и возможно только после завершения вегетации растения осенью.
Анализ пива методом ионной хроматографии[19]
Диапазон компонентов, представляющих интерес для производства пива - от неорганических ионов, органических кислот, и горечи хмеля, определяющего общий вкус и горечь напитка - до протеинов, карбогидратов, и спиртов, которые определяются, чтобы определить длительность брожения. Готовое пиво может быть проанализировано на определение концентрации добавленных консервантов и красителей, для дополнительного гарантирования соблюдения производственной технологии.
Первый шаг в производстве пива это процесс замачивания ячменя, или иногда другого зерна, в теплой воде. Присутствующие в ячмене ферменты перерабатывают крахмал в зернах, производя при этом по большей части глюкозу, мальтозу и другие олиго- и полисахариды. Этот процесс называется размягчением и в результате получается сладкое сусло. Сладкое сусло затем смешивается с хмелем и получается хмелевое сусло. При добавлении дрожжей сахариды бродят и производят спирт. Из-за различия концентраций, химического поведения, диапазона молекулярных масс различных компонентов в пиве их выделение и определение очень трудная задача. Ионная хроматография, использующая полимерные смолы, обеспечивает мониторинг многих из этих компонентов во время пивоварения и в готовом продукте.
Эта статья описывает использование ионообменной и ионо-эксклюзионной хроматографии для определения пяти классов компонентов, представляющих интерес для производства пива, включая: карбогидраты, спирты, органические кислоты, неорганические анионы и неорганические катионы. Для детектирования используются импульсный электрохимический или кондуктометрический детекторы.
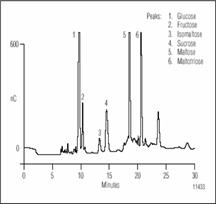
Рисунок 1. Разделение ферментных сахаров в сусле методом ионообменной хроматографии с импульсным амперометрическим детектором.
Проба перед дозированием была разбавлена в 10 раз.

Рисунок 2. Разделение моно-, ди- и трисахаридов в Американском пиве с помощью ионообменной хроматографии с импульсным амперометрическим детектором. Перед дозированием пробу разбавили 1:10.
Анализ карбогидратов
Карбогидраты и другие вещества, содержащие гидрооксильные группы, могут быть детектированы измерением тока при их окислении на золотом электроде. Используется последовательное повторение приложения трех потенциалов, первый для окисления карбогидратов, и затем очистки электрода от продуктов реакции окисления преложением большого положительного и затем отрицательного потенциалов. Эта последовательность повторяется каждую секунду для устранения загрязнения электрода и тем самым гарантии воспроизводимости сигнала. Без этого высота пика будет стабильно уменьшаться а поверхность электрода загрязнится. Из-за того что карбогидраты имеют pK a между 12 и 14, они могут быть разделены как анионы методом ионообменной хроматографии. Для проведения реакции окисления на рбочем электроде элюент должен иметь рН 12, при этом смола колонок полимерная и стабильна в диапазоне pH 0-14. Используя гидрооксидный градиент, сахара были разделены на колонке следующей последовательности: моносахариды, дисахариды и трисахариды.
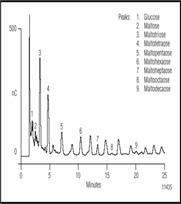
Рисунок 3. Разделение малто-олигосахаридов в Американском пиве с помощью ионообменной хроматографии с импульсным амперометрическим детектором. Перед дозированием пробу разбавили 1:10.
Условия разделения показаны для хроматограмм представленных на рисунках 1 и 2 показаны в табл. 2. Карбогидраты наиболее важные в пивном производстве ферментные сахара. В основном сахариды больше чем DP3 не бродят; однако, они вносят вклад в цвет и общий аромат пива и являются главными. На рисунке 1 показано разделение бродильных сахаров (< DP3) в пробе хмелевого сусла. Эти сахара превращаются в спирт. Если сравнить рисунок с разделением показанным на рис. 2., то отличие между готовым пивом и пивом в процессе производства очевидно. Как и ожидалось, концентрация бродильных сахаров в сусле выше, чем в готовом пиве. Сложные сахара, крахмал и декстрины разлагаются ферментами и образуют сусло с высоким брожением, состоят из глюкозных элементов. Мальтоза простейший из сложных сахаров образован двумя молекулами глюкозы соединенных 1,4 связями. Приняты названия в соответствии с числом единиц глюкозы связанных в сложных сахарах. Так малтотетроза (DP4), например, состоит из 4-х молекул глюкозы связанных 1,4 связями. Рисунок 3 показывает разделение мальтозных олигосахаридов от DP3 до DP10. Великолепное разделение олигомеров мальтозы вплоть до DP15 возможно, благодаря быстрому профилю градиента. Элюент содержит ацетат натрия с добавлением гидрооксида натрия. Ацетат натрия увеличивает силу элюента, что приводит к уменьшению времени удерживания олигосахаридов. Разделение возможно и без ацетата натрия, но время анализа очень долгое.
Анализ спиртов
Обычно только два спирта присутствуют в высокой концентрации в пиве - это этанол и глицерол. Глицерол - важный компонент в пиве, он значительно больше чем глюкоза влияет на аромат и сладость. Этанол и глицерол могут быть разделены методом ион-эксклюзионной хроматографии с последующим импульсным амперометрическим детектированием. Рисунок 4 показывает разделение этанола и глицерола в пиве.
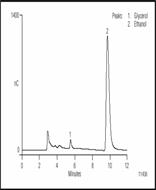
Рисунок 4 Разделение глицерола и этанола в американском пиве методом ион-экслюзионной хроматографии с импульсным амперометрическим детектированием. Перед дозированием проба была разбавлена 1:10.
Анализ органических кислот
Измерение органических кислот во всех фазах производства пива может помочь для контроля метаболитов брожения и коррекции вкуса пива. Один из методов разделения органических кислот - ион-эксклюзионная хроматография с кондуктометрическим детектированием. Колонка ICE-AS6 разработана для эффективного разделения алифатических органических кислот с низким молекулярным весом, а также алифатических спиртов и гликолей. Используемый механизм разделения, ионизированных частиц основан на различии их pKa. Сильные неорганические кислоты не удерживаются на стационарной фазе.
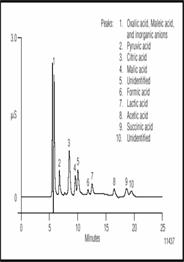
Рисунок 5 Разделение органических кислот в британском портере. Перед дозированием проба была разбавлена 1:40.
Рисунок 5 показывает разделение серии органических кислот в портере. Перед дозированием проба была разбавлена 1:40 и дегазирована. Щавелевая и малеиновая кислоты элюируются на "хвосте" "вотер пика" и маскируются сильными анионами такими как фторид и хлорид. Пуриват, цитрат, малат, формат, лактат, ацетат и сацинат хорошо разделяются. Присутствие ацетата определяется окислением, в то время как пуриват является промежуточным продуктом превращения глюкозы в спирт. Лактат производится бактериями молочной кислоты что превращает глюкозу и другие сахара в молочную кислот, его содержание минимально в большинстве сортов пива. Несколько не идентифицированных пиков также разделены.
Неорганически анионы
Неорганические анионы вносимые в пиво с исходной водой имеют важное влияние на вкус пива. Таким образом, вода может быть контролирована ионной хроматографией для гарантии ее чистоты и состава. Не смотря на надуманное добавление высоких концентраций некоторых анионов таких как сульфат, чрезмерные количества сульфатов и хлоридов могут ухудшать вкус пива. В добавок, высокие концентрации таких анионов как нитрат (если он превращается в нитрит) могут повредить дрожжи в процессе брожения. Следовательно, мониторинг анионного состава важный шаг в производстве пива. Неорганические анионы разделяются на анионообменной колонке и определяются кондуктометрическим детектором. Для эффективного градиентного элюирования используется гидрокись вместо карбоната из-за низкой электропроводности гидроокиси.
Рисунок 6 показывает одновременное разделение смеси органических и неорганических кислот в Американском эле. Перед дозированием проба разбавлялась 1:40. Концентрация гидрооксида натрия в элюенте 2 достаточно слаба чтобы разделить фторид и слабоудерживаемые моновалентные органические кислоты. Добавление метанола в элюент меняет селективность колонки для более гидрофобных анионов, и позволяет увеличить разделение сацината и малата а также тартарата и малеата, которые в противном случае выходят одним пиком. Таким образом можно разделять не только анионы сильных кислот, то также различные органические кислоты. Воспроизводимость метода 0.5% для времен удерживания и 2% для площадей пиков при хорошей линейности детектирования (r 2 =0.999) в диапазоне 1.5 порядков. Первый неорганический анион фторид, часто добавлен в водопроводную воду, чтобы предохранить разрушение зубов, он безвреден для пивоварения. Хлорид элюируется вторым, и на уровнях выше 250 мг/л его присутствии увеличивает сладость пива. Тем не менее, это может также препятствовать дрожжевой флокуляции.
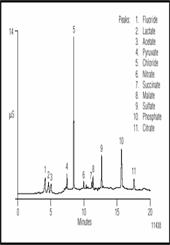
Рисунок 6 Разделение неорганических анионов и органических кислот в Американском эле.
Перед дозированием проба была разбавлена 1:40.
Нитрат раньше рассматривался как проблема для процесса пивоварения, но оказалось что - это нитрит полученный из нитрата, влияет на дрожжевой метаболизм и вызывает слабое или незаконченное брожение. Сульфат присутствует в природной воде, но наделяет острый, сухой привкус на хорошо хмельное пиво и следовательно поддерживается на минимуме. Наконец, фосфат присутствует в солоде и буферизует месиво в немного кислое pH.
Неорганические катионы
Как и в случае с неорганическими анионами, большинство неорганических катионов попадает в пиво с исходной водой. Четыре наиболее распространенных катиона в пиве - это натрий, калий, кальций и магний.
Некоторые из них влияют на рН месива, в то время как другие влияют на вкус пива. Другие металлы такие как свинец, медь и цинк также контролируются с целью гарантировать их отсутствие поскольку они ядовиты даже в незначительных количествах. Эта статья фокусирует внимание на щелочных и щелочно-земельных металлах. Неорганические катионы разделены методом ионообменной хроматографии с кондуктометрическим детектированием градиент позволяет разделять барий и стронций в дополнение к пяти катионам показанным на рис. 7. Переход на 5 мин от более слабого к сильному элюенту позволяет сузить пики для двух-валентных катионов. Воспроизводимость метода 0.5% по времени и 2% по площадям пиков.
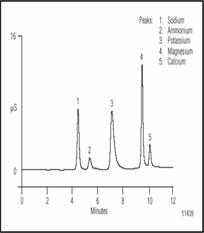
Рисунок 7 Разделение неорганических катионов, разбавленных 1:40, в американском легком пиве.
Линейность великолепная (два порядка для магния) при коэффициенте детерминации r 2 = 0.999, для всех компонентов кроме аммония. Если нет необходимости контролировать барий и стронций, то условия можно изменить и анализировать пять катионов показанных на рис. 7 в изократическом режиме за 10 мин. Рис. 7 показывает разделение основных катионов в пиве. Проба была дегазирована и разбавлена перед дозированием 1:40. натрий элюируется первым. При концентрации 75-150 мг/л, это дает солоноватость пиву когда связывается с хлоридом. Если также много сульфата, натрий придает неприятную резкость во вкусе. Калий элюируется следующим, и подобно натрию придает пиву слегка соленый вкус. Он также может тормозить действие некоторых ферментов в месиве. Магний - важное питательное вещество для дрожжей на уровнях около 10-20 mg/L, но наделяет острый, горько-кислый вкус на уровнях значительно выше чем 20 mg/L.
Кальций наиболее важный металл, однако его реакция с фосфатом в солоде уменьшает рН месива и сусла. Он также помогает действию ферментов, но не влияет на вкус.
Использование ионообменного разделения при определении мышьяка в природных объектах методом ИВА[20]Прямое определение мышьяка методом ИВА в объектах природного происхождения ввиду сложности их компонентного состава в большинстве случаев невозможно из-за мешающего влияния некоторых элементов, таких как медь, железо, ртуть. Из-за близости потенциалов анодные пики указанных металлов маскируют пик мышьяка, изменяют форму остаточного тока, ухудшают воспроизводимость результатов. Присутствие 500- кратного избытка железа (III) и 50- кратного меди (II) делает определение мышьяка невозможным.
В связи с этим для устранения мешающего влияния меди (II), железа (III), ртути (II) при определении мышьяка в природных объектах предложен метод ионного обмена. Находясь в растворе в анионной форме или в виде нейтральных молекул, мышьяк проходит в фильтрат, в то время как катионы указанных металлов поглощаются на катионите.
При выборе оптимальных условий сорбции меди (II), железа (III), ртути (II) из модельных растворов были исследованы катионообменники КУ-2, КБ-2Э, КБС, КБ-2Т; получены их физико-химические характеристики (набухаемость, кислотность, полная обменная емкость). Сорбцию Ме 2+ изучали в статических условиях при постоянном перемешивании в зависимости от времени сорбции, навески ионита, температуры, рН и концентрации исходных растворов. Степень сорбции железа (III) и меди (II) контролировали методом ИВА на золотоуглеродистом электроде. Было установлено, что при навеске 0,0500 г ионитов КБ-2Э, КБС и КБ-2Т достигается полное извлечение ионов за 30 минут при рН 3-5; на КУ-2 при рН 1-5 и навеске 0,1000 г - за 60 минут.
Полученные данные указывают на возможность включения в стадию пробоподготовки ионообменное отделение мешающих определению мышьяка примесей при анализе природных объектов. Методику ионообменного отделения меди (II), железа (III), ртути (II) применили для определения мышьяка методом ИВА в пробах почв, какао, чая, моллюсков. Метод экспрессен, не требует применения инертного газа. Анализ одной пробы длится 1-2 минуты.
Электроды с откликом на некоторые лекарственные препараты[21]
В последнее время все более широкое распространение в аналитической практике получают электроаналитические методы, основанные на использовании ионоселективных электродов. Объясняется это тем, что по сравнению с традиционными методами анализа указанные эдектроаналитические методы обладают рядом важных преимуществ, в частности позволяют проводить исследования биологических объектов как in vivo, так и in vitro с целью определения концентрации (активности) физиологически важных ионов, например некоторых лекарственных препаратов. Это в свою очередь облегчает диагностирование заболеваний, позволяет выбрать оптимальный курс лечения и вести постоянный контроль за интенсивностью последнего.
В качестве лекарственных средств для ионометрического контроля с использованием ионоселективных электродов были выбраны широко используемые в медицинской практике препараты: нитроксолин, норсульфазол, стрептоцид. Ионоселективные электроды с твердой мембраной были изготовлены на основе ионных ассоциатов соответствующих лекарственных препаратов с гетерополикислотами: фосфорномолибденовой, фосфорновольфрамовой. Изготовленные электроды обладают удовлетворительными метрологическими характеристиками. Время отклика не превышает 40 сек, электродная функция линейна до концентраций 10-4 моль/л, крутизна электродной функции (при 200С) составляет 40-55 мВ/декаду. Последний параметр несколько ниже теоретического, однако, в ряде случаев это не препятствует практическому использованию таких электродов для анализа. Оценен диапазон pH, в котором электроды сохраняют работоспособность и селективность в отношении некоторых мешающих ионов. Таким образом, основные характеристики изготовленных электродов позволяют предполагать, что они могут найти применение при анализе некоторых биологических объектов, а также контроле технологических процессов, связанных с изготовлением соответствующих лекарственных препаратов.
Особенности распределения форм тяжелых металлов в поверхностных водах озера Кучак[22]
Метод атомно-абсорбционной спектрофотометрии в комбинации с мембранной фильтрацией и ионообменной хроматографии применен для изучения распределения Mn, Cu, Zn, Cd среди сосуществующих форм в воде оз. Кучак.
Несмотря на то, что наблюдение за оз. Кучак ведется с 1954 г. и оно использовалось для рыборазведения и нагула рыб ценных пород, определение содержания ТМ не проводилось. Отбор проб и анализ их на содержание ТМ, проведенный нами в 2001-2003гг. показал, что в некоторых зонах наблюдается превышение ПДК по Мn (в 16-34 раза), Zn (в7-155 раз), Си (в 11-50 раз).
Определение форм нахождения ТМ проводили в пробах воды, отобранных в наименее биологически активный период (февраль-март) с двух горизонтов: поверхностного и придонного. Взвешенные формы ТМ отделяли путем мембранной фильтрации проб воды через фторопластовые мембраны со средним размером пор 0,45 мкм. Для разделения химических форм элементов по знаку заряда пробы воды пропускали через катионит КУ-2 в Nа+-форме. Определения проводили и использованием ААС с электротермической атомизацией пробы “Спираль-17”.
Установлено, что в воде преобладают растворенные формы металлов: доля их для Cd составляет 65-77%, для Мп 76-98%, Си 63-89%, Zn 66-86%. Исключение составляет РЬ: для него преобладающей является взвешенная форма. “Свободные” и связанные в малопрочные комплексы ионы исследуемых металлов составляют 22-42% для Cd, 82-91% для Мп, 17-56% для Си, 27% для РЬ и 6-41% для Zn от общего содержания растворимых форм. Большая часть Cd (58-78%), Zn (59-94%) и Си (44-83%) находится в составе комплексных соединений с РОВ, преимущественно анионного характера, среди которых доминируют продукты метаболизма водных растений и животных и гумусовые вещества. Содержание органического вещества (27,5 мг/дм3) оценено по величине бихроматной окисляемости, а по соотношению перманганатной и бихроматной окисляемости (44,0%) установлено, что терригенный гумус преобладает по сравнению с планктонным гумусом.
ГЛАВА 3. АППАРАТУРНОЕ ОФОРМЛЕНИЕ

Ионный хроматограф ICS–90 фирмы DIONEX (США)
Это самый простой и дешевый прибор в линейке хроматографов ICS от компании Dionex, но в тоже время в нем отражены все передовые разработки от лидера в области ионной хроматографии. Система ICS-90 – интегрированная, одноканальная, изократическая хроматографическая система, позволяющая анализировать анионы и катионы в различных объектах всего за 10–20 мин. Система ICS-90 предназначена для рутинного анализа, являясь компактной и не дорогой в обслуживании.

Ионный хроматограф ICS-1000 фирмы DIONEX (США)
Комплексная, конфигурированная система, предназначенная для изократического ионнохроматографического разделения с кондуктометрическим детектированием. Система включает в себя двухплунжерный насос, термостатируемую кондуктометрическую ячейку, дополнительный термостат для колонок, и on-line вакуумный дегазатор. Хроматограф ICS-1000, снабженный системой подавления фоновой проводимости (AutoSuppression®) сочетает в себе высокую производительность с простотой в использовании. Автоматически осуществляется полный контроль и сбор данных посредством ПК.[23]
ЛИТЕРАТУРА
1. Фритц Дж., Гьертде Д., Поланд К. Ионная хроматография. М.:Мир. 221 с.
2. Шпигун О. А, Золотов Д.А. Ионная хроматография и её применение в анализе вод. Издательство МГУ, 1990. - 150c.
3. Несмеянов А. И., Несмеянов Н. А. Основы органической химии. М: Изд. Химия. 1983. Т.2. С.169 - 180.
4. Карпов Ю.А., Савостин А.П. Пробоподготовка в экологическом анализе. М.:Бином, 2003. – 235с.
5. Другов Ю.С. Экологическая аналитическая химия. С.-Пб.: Анатолия, 2002. – 468 с.
6. Основы аналитической химии / Под ред. Ю.А. Золотова. В 2-х т. М.: Высш. шк., 2000. – 345 с.
7. Основы аналитической химии. Практическое руководство / Под ред. Ю.А. Золотова. М.: Высш. шк., 2001. – 249 с.
8. Кунце У., Шведт Г. Основы качественного и количественного анализа / Пер. с нем. М.: Мир, 1997. – 321 с.
9. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х т. М.: Химия, 1990. – 450 с.
10. Юинг Г. Инструментальные методы химического анализа / Пер. с англ. М.: Мир, 1989. – 427 с.
11. Дерффель К. Статистика в аналитической химии / Пер. с нем. М.: Мир, 1994. – 341 с.
12. Кузьмин Н.М., Золотов Ю.А. Концентрирование следов элементов. М.: Наука, 1988. – 237 с.
13. Москвин Л.Н., Царицына Л.Г. Методы разделения и концентрирования в аналитической химии. Л.: Химия, 1991. – 364 с.
14. Тельдеши Ю. Радиоаналитическая химия / Пер. со словац. М.: Энергоатомиздат, 1987. – 267 с.
15. Шараф М.А., Иллмен Л., Ковальски Б.Р. Хемометрика / Пер. с англ. Л.: Химия, 1989. – 223с.
16. Айвазов Б.В. Введение в хроматографию. М.: Высш. шк., 1983. – 349 с.
17. В.Н. Филимонов, С.И. Сирицо, Л.Н. Балятинская Внеколоночное образование ионной пары для разделения смеси карбоновых и оксикислот методом ион-парной вэжх.
18. Суслова А.Д., Корнилов С.Н., Ившин Н.В., Ившина Т.Н. Определение полифенольных соединений подвидов подорожника большого.
19. Анализ объектов окружающей среды /под ред. Р. Сонияси. М.: Мир, 1993.
20. Августинович О.В., Наумова Л.Б., Хустенко Л.А., Шелковников В.В.Использование ионообменного разделения при определении мышьяка в природных объектах методом ИВА.21. Давыдова Н.Н., Заболотная А.А., Сергеева Л. В. Электроды с откликом на некоторые лекарственные препараты.
22. Шуталева Е. А. Особенности распределения форм тяжелых металлов в поверхностных водах озера Кучак.
23. http://www.eliks.ru
Похожие работы
... . Комбинированные методы дают дополняющую друг друга информацию, позволяющую произвести правильную идентификации веществ, которые не могут быть опознаны с помощью какого- либо одного метода.[11-12] Глава 3. Примеры применения хроматографии в анализе объектов окружающей среды Анализ состояния водной среды с помощью метода газовой хроматографии[13-15] Метод газовой хроматографии для анализа ...
... щелочноземельных элементов и магния методом ионной высокоэффективной жидкостной хроматографии Разработка и совершенствование методов, позволяющих решать задачи анализа вод- важная проблема аналитической химии. Развитие высокоэффективной жидкостной хроматографии высокого давления стимулировало развитие нового направления в ионообменной хроматографии- так называемой ионной хроматографии. Синтез ...
... до молекулярного уровня, делая реальным полностью автоматизированные , со всеобъемлющим программным обеспечением, сложные многоцелевые и в то же время компактные, полностью автономные системы слежения за качеством окружающей среды в замкнутом пространстве. Экологические принципы, лежащие в основе конструирования,изготовления и эксплуатации ЛА. Самолет, как и любая система, использующая энергию ...
... и 2 чашек Петри, вставленных одна в другую для антикруговой ТСХ. Для увеличения пиковой емкости в ТСХ используют методы проточной, многократной, градиентной и двумерной ТСХ. [1] Глава 2. Контроль качества пищевых продуктов посредством метода ТСХ 2.1 Определение ддт, ддэ, ддд, альдрина, дильдрина, гептахлора, кельтана, метоксихлора, эфирсульфоната и других ядохимикатов в продуктах питания ...

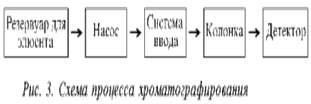




0 комментариев