Навигация
1 моль
8) Из (2): ![]() (CuCl2) =
(CuCl2) = ![]()
9) ![]() (CuCl2) =
(CuCl2) = ![]()
Þ CuCl2 – в избытке
10) ![]() (CuCl2) =
(CuCl2) = ![]() (CuCl2) -
(CuCl2) - ![]() (CuCl2) = 0,5моль – 0,1моль = 0,4моль
(CuCl2) = 0,5моль – 0,1моль = 0,4моль
11) Из (3): ![]() (Cl2) =
(Cl2) = ![]()
12) ![]() (CuCl2) =
(CuCl2) = ![]() (Cl2) = 0,4моль, значит весь CuCl, оставшийся в растворе после реакции (2), подвергся электролизу.
(Cl2) = 0,4моль, значит весь CuCl, оставшийся в растворе после реакции (2), подвергся электролизу.
13) После всех процессов в электролизе останутся Cu(NO3) – из (2)
![]() (Cu(NO3)2) =
(Cu(NO3)2) = ![]()
![]() (AgNO3) =
(AgNO3) = ![]() = 0,1моль
= 0,1моль
m2(Cu(NO3)2) = 0,1моль 188г/моль = 18,8г
14) mисход р-ра = m р-ра AgNO3 + m р-ра CuCl2 = 1000г + 500г = 1500г
15) mконеч р-ра = mисход р-ра – m1(O2) – m3(Cl2) – m3(Cu) – m1(Ag) – m2(AgCl)
16) ![]() (O2) =
(O2) = ![]()
m1(O2) = 0,025моль 32г/моль = 0,8г; m1(Ag) = 10,8г (по условию)
17) m3(Cl2) = ![]() (Cl2) М(Cl2) = 0,4моль 71г/моль = 28,4г.
(Cl2) М(Cl2) = 0,4моль 71г/моль = 28,4г.
m3(Cu) = ![]() (Cu) М(Cu) = 0,4моль 64г/моль = 25,6г
(Cu) М(Cu) = 0,4моль 64г/моль = 25,6г
18) m2(Ag Cl) = ![]() (Ag Cl) М(Ag Cl) = 0,2моль 143,5г/моль = 28,7г
(Ag Cl) М(Ag Cl) = 0,2моль 143,5г/моль = 28,7г
19) mконеч р-ра = 1500г – 0,8г – 28,4г – 25,6г – 10,8г – 28,7г = 1405,7г
20) ![]()
Ответ: ![]()
VIII. Примеры решения задач на расчеты по законам электролиза М. Фарадея
Задача № 1
Через последовательно включенные в цепь постоянного тока растворы
нитрата серебра (I), сульфата меди (II) и хлорида золота (III) пропускали ток силой в течение 20 мин. Рассчитайте массы металлов, осевших на катоде.
Решение
р-ры Ag NO3
CuSO4
AuCl3
I = 5A
F = 20мин = 1200с
F = 96500 Кл/моль
m (Ag) - ?
m (Cu) - ?
m (Au) - ?
1) Все металлы, катионами которых образованы данные соли, находятся в ряду активности металлов «после водорода» в ряду активности металлов «после водорода», значит на катодах будет протекать реакция восстановления только металлов:
![]() Ag+ + 1
Ag+ + 1![]() Ag 0 ; n=1, M(Ag) = 108 г/моль
Ag 0 ; n=1, M(Ag) = 108 г/моль
![]() Cu+ + 2
Cu+ + 2![]() Cu0 ; n=2, M(Cu) = 64 г/моль
Cu0 ; n=2, M(Cu) = 64 г/моль
![]() Au+ + 3
Au+ + 3![]() Au 0 ; n=3, M(Au) = 197 г/моль
Au 0 ; n=3, M(Au) = 197 г/моль
2) По формуле объединенного закона электролиза:
m (в-ва) = ![]() вычисляем массы металлов:
вычисляем массы металлов:
m(Ag) = 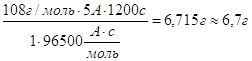
m(Cu) = 
m(Au) = 
Ответ: m(Cu) = 2г , m (Ag) = 6,7г , m(Au) = 4г.
Задача № 2
Вычислить массу газа, выделившегося на аноде при электролизе раствора серной кислоты, производившегося в течение 10 мин при силе тока 1,5А.
Решение
р-р H2SO4
F = 10мин = 600с
I = 1,5 A
F = 96 500 Кл/моль
m (O2) - ?
1) См. схему реакции электролиза и электронные полуреакции в примере №10 (часть IV). Электролиз раствора серый кислоты сводится к электролизу воды:
ί
2H2O = O2↓ + 2H2↑ ;
на аноде выделяется кислород: 2H2O- 4![]() = O2 ↑+ 4H+ ;
= O2 ↑+ 4H+ ;
значит n = 4
2) m(O2) = 
Ответ: m(O2) = 0,075г
Задача № 3
При действии постоянного тока силой 6,4А на расплав соли трехвалентного металла на катоде в течение 30 мин выделилось 1,07г металла, а аноде – 1344мл. (н.у.) газа, относительная плотность паров которого по гелию составляет 17,75. Определите состав соли, расплав которой подвергли электролизу.
Решение
I = 6,4 A
F = 30мин = 1800с
m(Me) = 1,07г
V(газа) = 13,44 = 22,4л (н.у.)
соль - ?
![]() на катоде : Me 3+ + 3
на катоде : Me 3+ + 3![]() Me0
Me0
на аноде : - ?
1) По условию: ДНе(газа) = 17,75
Значит, M(газа) = ДНе(газа) M(He) = 17,75 4г/моль =
71г/моль = M(Cl2)
![]() Значит,
Значит, ![]() на аноде : 2Cl— - 2
на аноде : 2Cl— - 2![]() Cl20
Cl20
2) По формуле объединенного закона электролиза:
M(Me) = 
M(A1) = 27г/моль Значит, соль – хлорид аммония
Ответ: хлорид аммония.
Задача № 4
При прохождении через раствор сульфата никеля (II) тока силой 2А масса катода увеличилась на 2,4г. Рассчитайте время электролиза, если выход по току равен 0,8.
Решение
р-р NiSO4
I = 2 A
∆m = 2,4г
= 0,8
F - ?
1) По условию, масса катода увеличилась, значит, на катоде восстановился никель массой 2,4г.
mпр(Ni) = 2,4г ; mт(Ni) = ![]()
![]() Ni2+ + 2
Ni2+ + 2![]() Ni0
Ni0
2) По формуле объединенного закона электролиза:
F![]() =
= 
Ответ: время электролиза составляет 4907с.
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... . - Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять уравнения химических реакций, протекающих при электролизе растворов и расплавов электролитов.- Воспитание самостоятельности, организованности, формирование умения работать в группе, развитие творческих способностей, логического мышления, внимания, памяти. Оборудование: компьютер, ...
... его с кислородом или воздухом). Глава 3. Методические разработки по "Водород. Кислоты. Соли" Цели урока: Обучающие: создать условия для обобщения и систематизации знаний учащихся по теме: «Водород. Кислоты. Соли», продолжить формировать умение классифицировать неорганические вещества; закрепить основные понятия «оксиды», «кислоты», «соли», «индикатор»; уметь выделять главное. Развивающие: ...
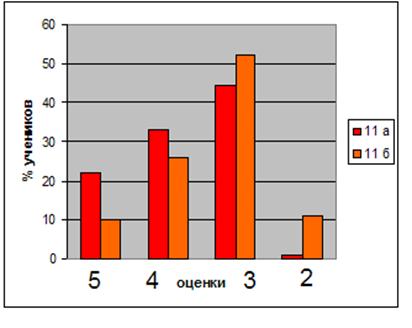
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...





0 комментариев