Навигация
Источники сырья для электрохимического получения хлора, едкого натра и водорода
2. Источники сырья для электрохимического получения хлора, едкого натра и водорода
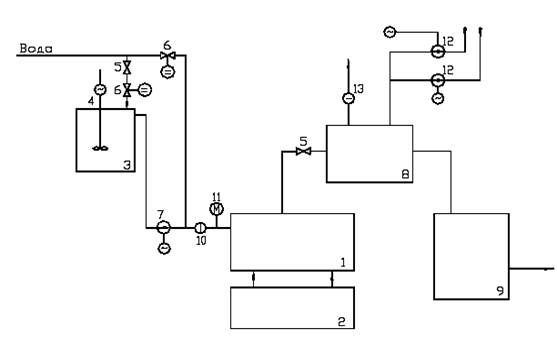
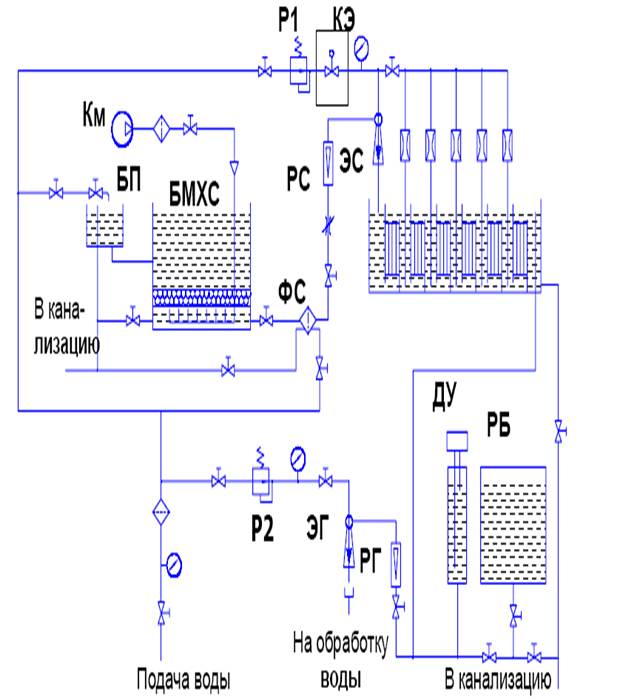
Сырьем для электролиза служит хлорид натрия в виде каменной соли, самоосадочной соли или подземного рассола. Подготовка сырья к электролизу включает операции растворения (при использовании твердой соли), очистки рассола от механических примесей и удаления ионов кальция и магния.
Механические примеси удаляют отстаиванием рассола с последующим фильтрованием осадка, а ионы кальция и магния, которые отрицательно влияют на процесс электролиза, обработкой рассола раствором карбоната натрия или известковым молоком:
СаСl +Na2CO3 → СаСО3+ 2NaCl
с последующей нейтрализацией избыточной щелочности соляной кислотой. Осадок карбонатов кальция и магния удаляют фильтрованием.
Полученный рассол должен иметь концентрацию соли 310–315 г./л, чтобы обеспечить, возможно, более низкий потенциал разряда ионов при электролизе. Также существуют допустимые пределы содержания ионов кальция и магния.
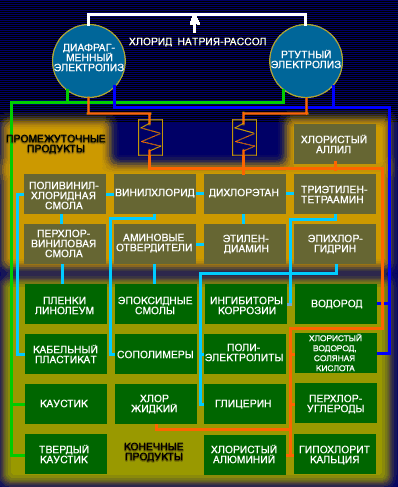
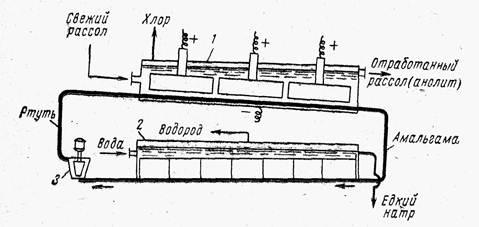
Рассол, поступающий на электролиз, представляет многокомпонентную систему, в которой содержатся ионы натрия, хлора, гидроксоний-катион и гидроксид-анион. Последовательность их разряда и образующиеся продукты определяются в соответствии с «правилом разряда» величиной их потенциалов разряда, которые зависят от условий электролиза и, весьма существенно, от материала катода. Различают два варианта технологического процесса электролиза водного раствора хлорида натрия: электролиз с твердым железным катодом (диафрагменный метод) и электролиз с жидким ртутным катодом.
Аноды электролизеров в обоих случаях изготавливают из одинаковых материалов: искусственного графита, пропитанного для уменьшения износа льняным маслом, или из титана, покрытого слоем оксидов рутения и титана. Аноды второго типа позволяют вести электролиз при высоких плотностях тока и более низком напряжении. Такие условия снижают расход электроэнергии на 10–12%. Поэтому оксидно-рутениевые аноды вытесняют графитовые: ими оснащено в настоящее время до 70% всех установок электролиза.
3. Современные промышленные способы получения хлора и едкого натра
Технический электролиз водных растворов может осуществляться без выделения металлов или с их выделением на катоде. Среди электрохимических процессов разложения водных растворов без выделения металлов наибольшее распространение получил электролиз водных растворов хлорида натрия.
Электролиз водных растворов хлорида натрия. При электролизе водных растворов хлорида натрия получают хлор, водород и едкий натр (каустическая сода).
Хлор – при атмосферном давлении и обычной температуре газ желто-зеленого цвета с удушливым запахом. при атмосферном давлении температура кипения хлора –33,6° С, температура замерзания -102° С. Хлор растворяется в воде, органических растворителях и обладает высокой химической активностью.
Хлор потребляется прежде всего химической промышленностью для производства различных органических хлорпроизводных, идущих для получения пластических масс, синтетических каучуков, химических волокон, растворителей, инсектицидов и т.п. В настоящее время более 60% мирового производства хлора используется для органического синтеза. Помимо этого хлор используют для производства соляной кислоты, хлорной извести, хлоратов и других продуктов. Значительные количества хлора идут в металлургию для хлорирования при переработке полиметаллических руд, извлечения золота из руд, а также его используют в нефтеперерабатывающей промышленности, в сельском хозяйстве, в медицине и санитарии, для обезвреживания питьевой и сточных вод, в пиротехнике и ряде других областей народного хозяйства. В результате развития сфер использования хлора, главным образом благодаря успехам органического синтеза, мировое производство хлора составляет более 20 млн. т/год.
Едкий натр, или каустическая сода, – кристаллическое непрозрачное вещество, хорошо растворимое в воде, имеющее при атмосферном давлении температуру плавления 328° С. В промышленности выпускается твердый едкий натр и его водные растворы. Едкий натр широко используется во многих отраслях промышленности – целлюлозно-бумажной, химических волокон, нефтеперерабатывающей, органического синтеза, мыловаренной, лакокрасочной и в ряде других.
Водород – газ, температура кипения которого при атмосферном давлении –252,8 °С. Водород используют для синтеза важнейших неорганических и органических продуктов: аммиака, метанола и других спиртов, для гидрогенизации жиров, твердых и жидких топлив, очистки нефтепродуктов и др.
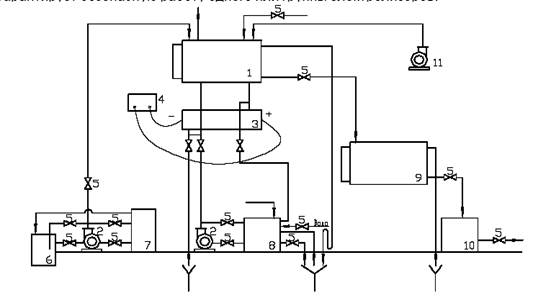
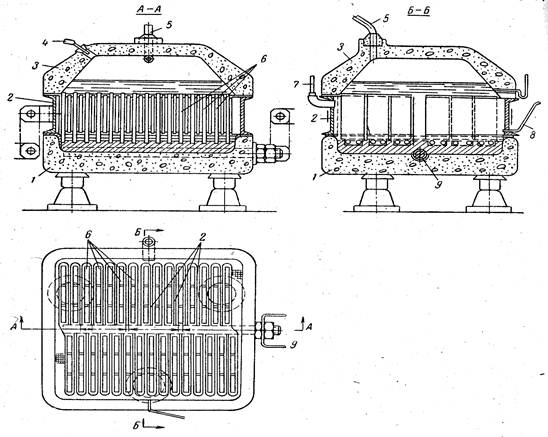
Сырьем для производства хлора и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые гидроокиси кальция и магния, которые нарушают нормальный ход электролиза. Очистка рассолов производится раствором соды и известковым молоком. Помимо химической очистки, растворы освобождаются от механических примесей отстаиванием и фильтрацией. Электролиз растворов поваренной соли производится в ваннах с твердым железным (стальным) катодом и с диафрагмами и в ваннах с жидким ртутным катодом. Промышленные электролизеры, применяемые для оборудования современных крупных хлорных цехов, должны иметь высокую производительность, простую конструкцию, быть компактными, работать надежно и устойчиво.
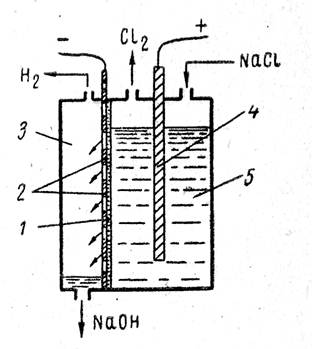
Электролиз растворов хлорида натрия в ваннах со стальным катодом и графитовым анодом позволяет получать едкий натр, хлор и водород в одном электролизере. При прохождении постоянного электрического тока через водный раствор хлорида натрия можно ожидать выделения хлора, а также кислорода:
2OH- – 2ē→1/2О2+Н2О
или
2Cl- – 2ē→Cl2
Нормальный электродный потенциал разряда OH – – ионов составляет +0,41 В, а нормальный электродный потенциал разряда ионов хлора равен +1,36 В. В нейтральном насыщенном растворе хлорида натрия концентрация гидроксильных ионов около 1·10-7 г-экв/л. При 25° С равновесный потенциал разряда гидроксильных ионов будет φар=0,82 В. Равновесный потенциал разряда ионов хлора при концентрации NaCl в растворе 4,6 г-экв/л равен φар=1,32 В. Следовательно, на аноде с малым перенапряжением должен в первую очередь разряжаться кислород. Однако на графитовых анодах перенапряжение кислорода много выше перенапряжения хлора и поэтому на них будет происходить в основном разряд ионов Cl- с выделением газообразного хлора по реакции (а). Выделение хлора облегчается при увеличении концентрации NaCl в растворе в следствии уменьшения при этом равновесного потенциала. Это является одной из причин использования при электролизе концентрированных растворов хлорида натрия, содержащих 310–315 г./л. На катоде в щелочном растворе происходит разряд молекул воды по уравнению
H2O + ē→H + OH-
Атомы водорода после рекомбинации выделяются в виде молекулярного водорода:
2H→H2
Разряд ионов натрия из водных растворов на твердом катоде невозможен в следствии более высокого потенциала их разряда по сравнению с водородом. Поэтому остающиеся в растворе гидроксильные ионы образуют с ионами натрия раствор щелочи. Процесс разложения NaCl можно выразить следующими реакциями:
2Cl- – 2ē→Cl2
Н2О + ē=2Н + ОН-
2H→H2
Просуммировав уравнения получим:
2Н2О + 2Cl-→ Cl2 + H2 + 2ОН-
или
2Н2О + 2NaCl→ Cl2 + H2 + 2NaOH
То есть на аноде идет образование хлора, а у катода – водорода и едкого натра. При электролизе наряду с основными описанными процессами могут протекать и побочные, один из которых описывается уравнением (б). Помимо этого, хлор, выделяющийся на аноде, частично растворяется в электролите и гидролизуется по реакции
Cl2 + Н2О↔НОCl + НCl
В случае диффузии щелочи (ионов ОН-) к аноду или смешения катодных и анодных продуктов хлорноватистая и соляная кислоты нейтрализуются щелочью с образованием гипохлорита и хлорида натрия:
НОC + NaOH=NaOC + Н2О
HCl + NaOH=NaCl + Н2О
Ионы ClO – на аноде легко окисляются в ClO3- Следовательно, из-за побочных процессов при электролизе будут образовываться гипохлорит, хлорид и хлорат натрия, что снижает выход по току и коэффициент использования энергии. В щелочной среде облегчается выделение кислорода на аноде, что также будет ухудшать показатели электролиза. Чтобы уменьшить протекание побочных реакций, следует создать условия, препятствующие смешению катодных и анодных продуктов. К ним относятся разделение катодного и анодного пространств диафрагмой и фильтрация электролита через диафрагму в направлении, противоположном движению ОН – – ионов к аноду. Такие диафрагмы называются фильтрующими диафрагмами и выполняются из асбеста.
Похожие работы
... питьевой воды на станциях водоподготовки и обеззараживания сточных и оборотных вод. Производительность свыше 100 кг. активного хлора в сутки более 100 тыс. кубометров воды в сутки. 3. Расчет экономической эффективности очистки технической воды: 3.1 Определение затрат труда 3.1.1. Определим оплату труда обслуживающего персонала в год Сп = Тм*aз*nм, где Тм – 167 часов –норма времент в ...
... получаемых продуктов. В связи с этим проведение электрохимических процессов целесообразно только на базе дешевой электрической энергии. Сырье для получения гидроксида натрия. Для производства гидроксида натрия, хлора, водорода используют раствор поваренной соли, который подвергают электролизу Поваренная соль встречается в природе в виде подземных залежей каменной соли ...
... ; при фильтровании получается осадок, который может быть легко отделен и подвергнут дальнейшей переработке. 3.2 Ртуть из шламов процесса производства хлора и щелочи При производстве хлора и гидроксидов щелочных металлов путем электролиза растворов хлоридов щелочных металлов в электролизерах с ртутным катодом происходит накопление отходов с высоким содержанием гидроксида щелочного металла и ...
... парах. После охлаждения лампы ртуть оседает на ее поверхности мелкими капельками, которые видны невооруженным глазом. Поэтому разбивать такие лампы совершенно недопустимо. Амальгамы Еще одно замечательное свойство ртути: способность растворять другие металлы, образуя твердые или жидкие растворы – амальгамы. Некоторые из них, например амальгамы серебра и кадмия, химически инертны и тверды ...

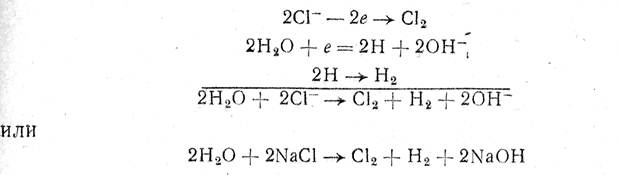
0 комментариев