Навигация
Окислительно-восстановительные реакции
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственный технический университет
Окислительно-восстановительные реакции
Методические указания
к выполнению лабораторных работ и решению задач
по дисциплине «Общая и неорганическая химия»
для студентов всех специальностей
всех форм обучения
Одобрено
редакционно-издательским советом
государственного
технического университета
2008
Цель работы: проведение качественных опытов, раскрывающих окислительные и восстановительные свойства отдельных веществ. Приобретение навыков составления окислительно-восстановительных уравнений методом электронного баланса.
Общие указания к выполнению лабораторных работЛабораторные работы являются неотъемлемой частью курса общей химии, одним из важнейших звеньев учебно-педагогического процесса. При изучении химии как науки, основанной на эксперименте, выполнение лабораторных работ ― обязательный элемент учебного процесса. Выполнение лабораторных работ укрепляет знания в данной области, развивает у студентов экспериментаторские навыки и самостоятельность. Приступая к выполнению лабораторной работы, необходимо изучить основные теоретические положения по выполняемой теме, представлять цель и план проведения работы, принять меры предосторожности.
При выполнении лабораторной работы необходимо записать в рабочий дневник тему работы, указать цель опыта, сформулировать его теоретическое обоснование, записать наблюдения, уравнения протекающих реакций, сделать выводы.
Правила техники безопасности1. К любой работе следует приступать только тогда, когда все этапы ее известны и не вызывают сомнений.
2. Работать в химической лаборатории нужно аккуратно, без спешки. На рабочем столе должны находиться только необходимые приборы и рабочий дневник.
3. Для защиты одежды от действия химических реактивов необходимо работать в халате.
4. Все опыты с ядовитыми веществами, концентрированными кислотами, летучими и едкими веществами проводить только в вытяжном шкафу, открыв дверцу шкафа на 1/3.
5. Не следует пользоваться реактивами, если они хранятся в посуде без этикеток.
6. Нельзя выливать в раковину остатки кислот, щелочей и огнеопасных веществ: их нужно сливать в специально предназначенные склянки, находящиеся в вытяжном шкафу.
7. При разбавлении концентрированной серной кислоты вливать кислоту в воду (а не наоборот) небольшими порциями, помешивая.
8. Запрещается работать с огнеопасными веществами вблизи включенных горелок или электрических приборов.
9. Нельзя выбрасывать в раковину непрореагировавшие остатки металлов.
10. Горячие жидкости нельзя выливать в тонкостенную посуду.
11. Во избежание ранения осколками стекла следует соблюдать меры предосторожности при работе со стеклянной посудой.
12. Не допускать попадания кислоты или щелочи на руки! При попадании кислоты на кожу обожженное место промойте большим количеством проточной воды, а затем обработайте разбавленным раствором (1-3%-ным) бикарбоната натрия. При попадании щелочи на кожу вначале также промойте проточной водой, а затем разбавленным раствором (3%-ным) уксусной или борной кислоты.
13. При термическом ожоге кожу следует обмыть спиртом, а затем смазать мазью от ожогов.
14. При попадании реактивов в глаза следует промыть их струей воды и обратиться к врачу.
15. При отравлении газами необходимо обеспечить пострадавшему приток свежего воздуха.
Пренебрежение требованиями техники безопасности в работе может привести к несчастным случаям, жертвами которых часто становятся не сами нарушители, а их товарищи по работе. Все работающие в лаборатории должны уметь оказывать первую помощь при ожогах и отравлениях.
ОСНОВНЫЕ ПОНЯТИЯ
Степень окисления элементов и сущность окислительно-восстановительных явлений
Окислительно-восстановительные реакции имеют очень широкое распространение и являются чрезвычайно важными для обмена веществ в живых организмах, для многих промышленных процессов, связанных с получением химических веществ. Они имеют огромное значение в теории и практике.
Окислительно-восстановительные реакции - это такие реакции, которые протекают с изменением степени окисления атомов элементов, входящих в состав реагирующих веществ.
Например,
NaOH + HCl = NaCl + H2O ― реакция идет без изменения степени окисления. Такого типа реакции называются обменными.
Zn0 + HCl- = H20 + Zn2+Cl2 – реакция протекает с изменением степени окисления, следовательно, это окислительно-восстановительная реакция (ОВР).
![]() Zn0 - 2e ® Zn2+
Zn0 - 2e ® Zn2+
Похожие работы
... , а в нейтральных и щелочных растворах ионы О реагируют с образованием гидроксид-ионов НОН + О = 2ОН . Применяются в основном два метода составления уравнений окислительно-восстановительных реакций: 1) электронного баланса – основан на определении общего количества электронов, перемещающихся от восстановителя к окислителю; 2) ионно-электронный – предусматривает раздельное ...
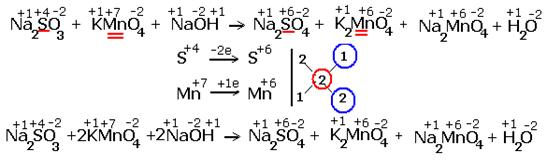
... окисления химических элементов. Подчёркнуты химические элементы, в которых изменились степени окисления. 2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов. За вертикальной чертой ставим число электронов, перешедших при окислительном и восстановительном процессах. Находим наименьшее общее кратное ( взято в красный кружок). Делим это ...
... электроны, понижает свою степень окисления, восстанавливается, а вещество Red2 с меньшим сродством к электрону (восстановитель) окисляется. Окисленная и восстановленная формы реагирующих в ОВР веществ образуют окислительно-восстановительные (оксред-, редокс-) пары ОХ1/Red1 и OX2/Red2, а превращения типа OX+ze - Red называют оксред - (редокс) - переходами или окислительно-восстановительными ...
... - + 14H+ → 2MnO4- + 5Bi3+ + 7H2O №37: 3HNO2 = HNO3 + 2NO + H2O Восстановитель: HNO2 Окислитель: HNO2 Данная окислительно-восстановительная реакция относится к реакциям диспропорционирования, т.к. молекулы одного и того же вещества (HNO2) способны окислять и восстанавливать друг друга. Это происходит потому, что вещество HNO2 содержит в своем составе атомы азота в промежуточной ...
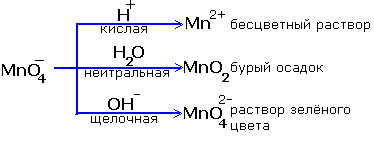
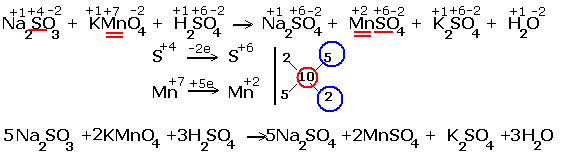
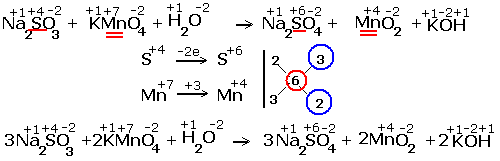
0 комментариев