Навигация
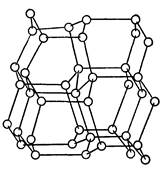
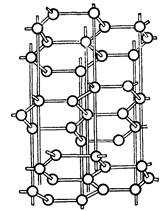
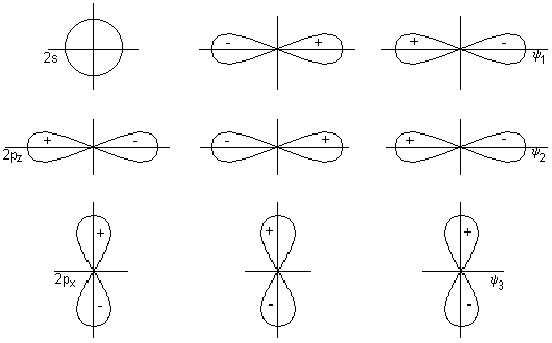
Подгруппа углерода
ЛАБОРАТОРНАЯ РАБОТА № 1
ТЕМА: ”ПОДГРУППА УГЛЕРОДА”
Опыт № 1. Получение углерода термическим разложением древесины
Оборудование и реактивы: Штатив с лапкой, спиртовка, спички, резиновые прокладки, сосуд Ландольта, пробка со вставленной в нее стеклянной трубкой, синий лакмус, химический стакан, стружки сухого дерева.
Ход работы: Одно колено сосуда Ландольта заполняют плотно сухими стружками. Закрепляют прибор в штативе. Другое колено опускают в стакан с холодной водой. Равномерно прогрев весь сосуд, сильно нагревают стружки. Из стеклянной трубки выходит белый дым, его поджигают. Во втором колене собирается желтоватая смесь, состоящая из воды и жидких органических веществ. Нагревают до тех пор стружки, пока они не обуглятся и не прекратится выделение газов. Затем дают сосуду остыть, открывают пробку и высыпают уголь. Жидкостью из второго колена сосуда Ландольта пропитывают синюю лакмусовую бумагу. Покраснение лакмусовой бумаги свидетельствует о наличии в смеси кислоты.
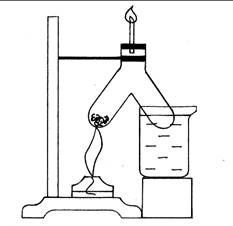
Рис. 22. Термическое разложение древесины.
Техника безопасности: Перед нагреванием стружек равномерно прогреть сосуд Ландольта.
Утилизация: Жидкие продукты разложения древесины поместить в нейтрализатор.
Опыт № 2. Поглощение углем растворенных веществ и газов
а) Поглощение углем газов.
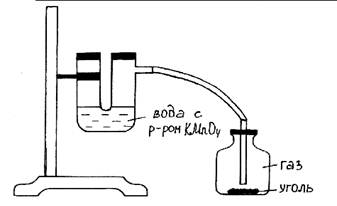
Рис.23. Поглощение углем газов.
Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, U-образная трубка, стеклянная банка, пробка со вставленной в нее стеклянной трубкой, резиновая трубка, раствор перманганата калия, активированный уголь, соляная кислота (конц.), перманганат калия (кристал.), шпатель.
Ход работы: В U-образную трубку наливают воду, подкрашенную раствором перманганата калия, затем закрепляют ее в лапке штатива. Стеклянную банку заполняют хлором или оксидом азота (IV). U-образную трубку соединяют газоотводными трубками герметично с банкой и окрашенными газами. Открыв пробку в банке, быстро помещают активированный уголь и вновь герметично закрывают. Склянку с углем и газом сильно встряхивают. Подкрашенная вода в одном колене U-образной трубки поднимается. Объяснить наблюдаемые явления.
Техника безопасности: 1. Проводить опыт получения токсичных окрашенных газов в вытяжном шкафу. 2. Не допускать попадание газа (Cl2, NO2) в атмосферу класса.
3. Прокалить активированный уголь в вытяжном шкафу и использовать вновь.
Утилизация: Продукты реакции после получения хлора утилизировать по схеме в теме “Галогены”. Продукты реакции после получения оксида азота (IV) утилизировать по схеме в теме “Азот” (взаимодействие меди с азотной кислотой).
б) Поглощение углем растворенных веществ.
Оборудование и реактивы: Штатив с лапкой, резиновые прокладки, хлоркальциевая трубка, химический стакан, вата, слабый раствор перманганата калия или фуксина, активированный уголь.
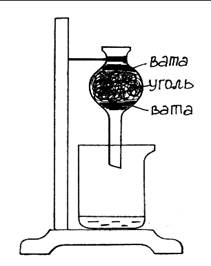
Рис. 24. Поглощение углем растворенных веществ.
Ход работы: Хлоркальциевую трубку заполняют последовательно слоем ваты, слоем активированного угля и слоем ваты. Хлоркальциевую трубку закрепляют в штативе и наливают в нее воду, подкрашенную раствором перманганата калия (очень слабый раствор). В подставленный химический стакан стекает чистая прозрачная вода.
Опыт № 3. Взаимодействие углекислого газа со щелочью
Оборудование и реактивы: Аппарат Киппа, цилиндр, лучинка, спички, раствор соляной кислоты (1:2), мрамор, раствор гидроксида натрия (конц.), шпатель.
Ход работы: Заряжают аппарат Киппа на получение углекислого газа. В цилиндр без носика наливают 15-20 мл концентрированного раствора гидроксида натрия и опускают газоотводную стеклянную трубку от аппарата Киппа до поверхности раствора, но не в раствор. Открывают зажим и дают сильный ток углекислого газа, чтобы быстро вытеснить весь воздух. Затем вынимают трубку из цилиндра и перекрывают ток углекислого газа. Цилиндр быстро закрывают ладонью и слегка покачивают. Углекислый газ реагирует с гидроксидом натрия. В цилиндре возникает разрежение, давление падает, ладонь плотно прижимается к отверстию цилиндра. Демонстрируют подъем цилиндра открытой ладонью руки.
Протекает химический процесс: CO2 + 2NaOH ® Na 2CO3 + H2O
Чтобы убедиться в образовании карбонатов, в цилиндр по стенке осторожно приливают раствор соляной кислоты. Происходит вспенивание - активное выделение углекислого газа.
Техника безопасности: 1. Не допускать попадания газа в атмосферу класса.
2. Концентрированную щелочь приливать в цилиндр под тягой. 3. Соблюдать технику безопасности при зарядке аппарата Киппа.
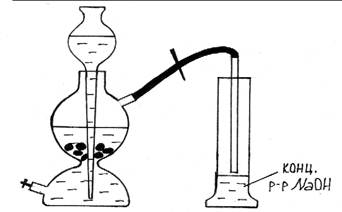
Рис. 25. Взаимодействие CO2 с концентрированным раствором едкого натра.
Утилизация: Отработанную соляную кислоту в аппарате Киппа утилизировать по схеме, описанной в теме: “Вода. Растворы. Основания,” VIII класс, опыт № 8. Раствор щелочи с примесью карбоната натрия использовать многократно. При значительном насыщении раствора карбонатом натрия, содержимое перенести в емкость-нейтрализатор.
Опыт № 4. Получение оксида углерода (IV) и изучение его свойств
Оборудование и реактивы: Две пробирки, пробка со вставленной в нее газоотводной трубкой, мрамор, соляная кислота (1:5), известковая вода, разбавленный раствор гидроксида натрия, фенолфталеин, лакмус, шпатель.
Ход работы: В пробирку поместить несколько кусочков мела или мрамора и прилить разбавленный раствор соляной кислоты. Закрыть пробирку пробкой с газоотводной трубкой. Пропустить выделившийся углекислый газ в пробирки:
а) с водой, подкрашенной раствором лакмуса;
б) с известковой водой: CO2 + Ca (OH)2 ® CaCO3 + H2O
в) с раствором щелочи и несколькими каплями фенолфталеина:
2NaOH + CO2 ® Na2CO3 + H2O
Объяснить наблюдаемые явления.
Утилизация. Перенести содержимое щелочных растворов в емкость– нейтрализатор. Содержимое пробирки-реактора утилизировать по схеме, описанной в теме: “Вода. Растворы. Основания”, VIII класс, опыт № 8.
Опыт № 5. Распознавание карбонатов
Оборудование и реактивы: Штатив с пробирками, разбавленные растворы углекислого натрия, хлорида бария, нитрата серебра, азотной кислоты, соляной кислоты, мрамор, шпатель.
Ход работы: 1. В пробирку налить раствор углекислого натрия объемом 1 мл и прилить раствор хлорида бария такого же объема. Образуется белый осадок карбоната бария BaCO3.
Na2CO3 + BaCl2 ® BaCO3↓+ 2NaCl
К осадку прилить раствор соляной кислоты. Осадок растворится.
2. В пробирку налить раствор углекислого натрия объемом 1 мл и прилить несколько капель раствора нитрата серебра. Образуется осадок: Na2CO3 + 2AgNO3 = 2NaNO3 + Ag2CO3↓. К осадку прилить разбавленный раствор азотной кислоты малыми порциями до полного его растворения.
Ag2CO3↓ + 2HNO3 ® 2AgNO3 + H2O + CO2
Похожие работы
... инертны и практически не взаимодействуют ни с какими простыми и сложными веществами. Исключение составляет аморфный кремний, реагирующий с фтором. При нагревании углерод и кремний взаимодействуют с галогенами, с элементами подгруппы серы, азотом, водородом и многими металлами. В последнем случае образуются соединения, называемые карбидами и силицидами. С углеродом и кремнием взаимодействуют ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... (вода, спирты, аммиак) за счет притяжения разноименных зарядов. Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи. Билет №4. Классификация химических реакций в неорганической химии. Классификация по составу исходных веществ и продуктов реакции. Реакции соединения — из нескольких веществ (простых или сложных) образуется сложное вещество: Реакции ...
... подгрупп одной группы — химические антиподы: для одних должны быть более характерны свойства металлов, а для других — неметаллов. Но при сравнении членов обеих подгрупп можно заметить, что «противоположности» сближаются. У элементов побочной подгруппы все более усиливаются свойства неметаллов, характерные для главной подгруппы, и наоборот. Ванадий в этом отношении служит примером. В высшей ...
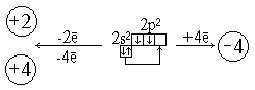





0 комментариев