Навигация
1.2 Типы химических реакций
В химической кинетике рассматривается несколько типов химических реакций.
Необратимыми (односторонними) называют реакции, которые идут только в одном направлении. В таких реакциях продукты представляют осадок, газы или мало диссоциируемые химические соединения.
Двусторонними (обратимыми) реакциями называются реакции, которые протекают одновременно в противоположных направлениях.
Параллельными называют реакции, идущие одновременно по нескольким направлениям (стадиям) с образованием различных продуктов.
Скорость процесса из параллельных стадий определяется самой быстрой стадией.
Последовательные реакции состоят из нескольких стадий, следующих друг за другом. Скорость процесса из последовательных стадий определяется самой медленной.
Цепные реакции - это самоподдерживающиеся химические реакции, при которых первоначально появляющиеся продукты принимают участие в образовании новых продуктов. Цепные реакции проходят три главные стадии: зарождения (инициирования), развития и обрыва цепи.
Фотохимические реакции связаны с воздействием света на вещество (например, фотосинтез). Отношение числа молекул продукта к числу квантов света, инициирующих реакцию, называется квантовым выходом.
1.3 Влияние температуры на скорость химической реакции
Скорости большинства реакций с повышением температуры увеличиваются. Существует приближенное правило Вант-Гоффа: при повышении температуры на каждые 10° скорость реакции увеличивается в 2-4 раза. В соответствии с этим правилом повышение температуры на 100 К приводит к повышению скорости реакции примерно в З10 ≈ 60 тысяч раз. Большинство простых реакций подчиняются этому правилу, но имеются исключения. Например, для гидролиза метилацетата константа скорости при 308 К в 1,82 раза больше константы скорости при 298 К, а для гидролиза сахарозы при том же увеличении температуры скорость возрастает в 4,13 раза.
Температурная зависимость константы скорости выражается уравнением Аррениуса:
К = Ко exp(-Ea/RT) = Ко e –Еа / RT, (5)
где К - предэкспоненциальный множитель, который не зависит или почти не зависит от температуры;
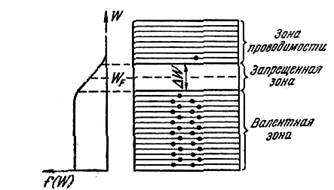
Еа - энергия активации - это минимальная энергия (в расчете на 1 моль или 1 кмолъ), которой должны обладать реагирующие (исходные) частицы, чтобы столкновение между ними привело к реакции.
До последнего времени энергию активации рассматривали в теории химической кинетики как эмпирическую постоянную. Но в настоящее время появилась возможность ее приближенной оценки с помощью квантовой химии.
За величину энергии активации приближенно принимают превышение средней энергии активированного комплекса над средним уровнем энергии исходных веществ. Она зависит от природы реагирующих (исходных) веществ и характеризует изменение скорости реакции от температуры. Чем больше энергия активации,тем быстрее увеличивается с ростом температуры скорость реакции.
Если уравнение (5) прологарифмировать, то получим:
1пК = 1пК0 - Еа /RT. (6)
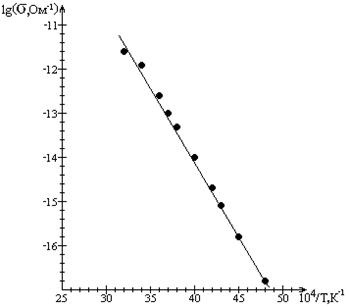
В системе координат 1пК - 1/Т соотношение (6) - прямая линия. Это так называемый аррениусовский график, и считается, что реакции, дающие в этих координатах прямую линию, проявляют аррениусовское поведение.
Уравнение Аррениуса достаточно хорошо выполняется для простых гомогенных и многих гетерогенных реакций. Отклонение от этого закона указывает на сложный характер протекающей реакции. Форма аррениусовского выражения может быть получена из следующих рассуждений.
Предположим, что константа скорости реакции второго порядка является результатом бимолекулярной реакции. Для ее протекания необходимы два условия.
Прежде всего молекулы должны встретиться друг с другом, т.е. должно произойти их соударение. Обозначим через Z скорость, с которой происходят эти соударения в единице объема в газовой фазе. В газе при атмосферном давлении частота столкновений равна приблизительно 1028 1/с см3 даже при комнатной температуре. Если бы наличие столкновений было бы единственным фактором, необходимым для протекания реакции, то все газовые реакции заканчивались бы за 10 -9 с (происходил бы взрыв), но это не так. Более того, частота столкновений зависит от квадратного корня из температуры. Следовательно, если учитывать только число столкновений молекул, то получается абсурдно большая скорость реакции и абсурдно невероятная ее зависимость от температуры.
Другим необходимым условием для осуществления реакции является то, что молекулы при столкновении должны обладать достаточной энергией. Слабое столкновение не ведет к реакции, столкновение должно быть сильным. Если предположить, что для осуществления реакции столкнувшиеся молекулы должны иметь, по крайней мере, энергию Еа, то частота столкновений должна быть умножена на долю молекул, сталкивающихся с энергией Еа. Эта доля определяется уравнением Больцмана и равна exp(-Ea/RT) для данной системы при температуре Т. Из этого следует, что температурная зависимость скорости реакции может быть выражена уравнением:
W = Z*exp(-Ea/RT), (7)
где Z - число соударений.
При обычных температурах доля энергетически достаточных столкновений очень мала, поэтому приведенное выражение предсказывает скорость, которая значительно меньше, чем величина Z. Более того, оно предсказывает экспоненциальную температурную зависимость скорости реакции, поскольку доля энергетически достаточных столкновений экспоненциально увеличивается с температурой.
Таким образом, уравнение (7) качественно схоже с уравнением Аррениуса, но дает меньшее значение скорости химической реакции. Связано это с тем, что в реакции могут участвовать частицы с энергией, не только равной Еа, но и с большей энергией. Фактически экспериментальная температурная зависимость скорости реакции значительно сильнее, чем зависимость Z от корня квадратного из температуры.
Например, для типичных энергий активации (около 50-100 кДж/моль) скорость удваивается при повышении температуры на 10° , но частота столкновений изменяется только в (308/298)1/2 = 1,02 раза при этом же повышении температуры. С ростом температуры влияние этого фактора уменьшается.
Опытные данные показывают, что энергия активации, как правило, значительно меньше энергии разрывающихся при данной реакции химических связей, т.е. энергии диссоциации реагирующих молекул. Это можно объяснить тем, что затрата энергии на разрушение старых связей сопровождается выделением энергии при образовании новых химических связей в продуктах реакции, т.е. происходит частичная компенсация энергетических затрат. Для количественной оценки этого явления российским ученым Г.К. Боресковым была предложена величина % названная степенью компенсации:
χ = (ЕД -Еа)/Ед, (8)
где Ед - энергия диссоциации реагирующих молекул;
Еа - энергия активации реакции.
При полном разрыве связей, без компенсации образования новых связей, энергия активации совпадает с Е д и χ =0. Уменьшение энергии активации соответствует все большей компенсации и при Еа =0 величина χ =1 компенсация полная. Для некаталитических реакций со стабильными молекулами степень компенсации обычно не превышает 70%.
Похожие работы
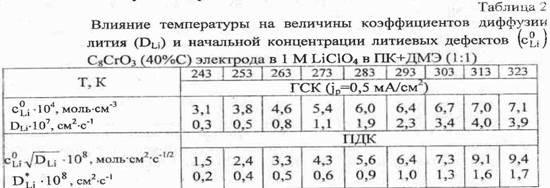
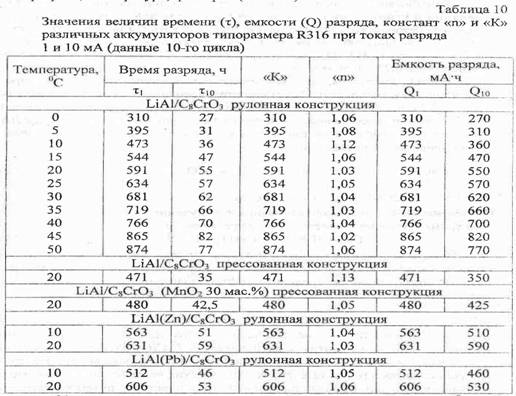
... основные закономерностей активации LiAl, LixC6 и С8С3 электродов путем механических, физико-химических и электрохимических воздействий, а также изучние обратимой работа модифицированных электродов, работающих по "принципу электрохимического внедрения, в макетах литиевых аккумуляторов. Задачи исследования. Для достижения поставленной цели потребовалось: -провести комплексное систематическое ...
... можно судить с тех же позиций, которые применяются в координационной химии для связи металл-лиганд, для характеристики изменений свойств лиганда (т.е. его активации). Основные понятия координационной химии В основе современных представлении о природе комплексов лежит координационная теория Вернера (1893 г.). Основные положения теории А. Вернер вывел, рассматривая соединения, которые либо ...
... или кислот; так получают, например, золь гидроксида железа(III), имеющий следующее строение: {[Fe(OH)3]m n FeO+ · (n–x)Cl–}x+ x Cl– 4.2.2 Агрегативная устойчивость лиофобных коллоидов. Строение коллоидной мицеллы Лиофобные коллоиды обладают очень высокой поверхностной энергией и являются поэтому термодинамически неустойчивыми; это делает возможным самопроизвольный процесс уменьшения ...
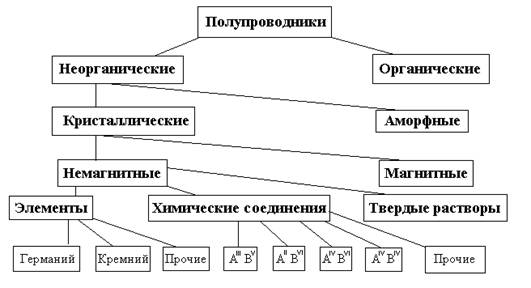
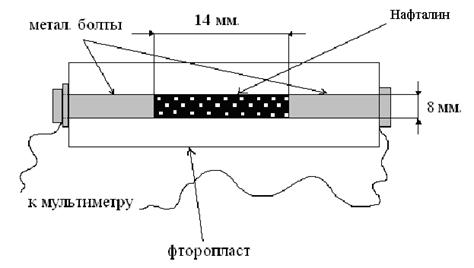
... : ,(2.8) где фотопроводимость; — константа для данного образца; — термическая энергия активации проводимости (обычно 0,1—0,3 эв). Знак световых носителей тока у большинства органических полупроводников дырочный. Некоторые адсорбированные пары и газы существенно изменяют фотоэлектрическую чувствительность органических полупроводников. Зависимость фототока от освещенности выражается ...

0 комментариев