Навигация
Г мочевины растворяют в 100 мл 96%-ного спирта и добавляют 20 мл 2 н раствора соляной кислоты;
5 г мочевины растворяют в 100 мл 96%-ного спирта и добавляют 20 мл 2 н раствора соляной кислоты;
ж) проявители на альдозы: 1 — анилинфталат
1,66 г фталевой кислоты и 0,93 г перегнанного анилина растворяют в 100 мл этилового спирта, насыщенного водой;
2 — анилиноксалат:
0,93 г перегнанного анилина растворяют в 50 мл 96%-ного этанола, после чего смешивают с равным объемом 0,2 М раствора щавелевой кислоты в этаноле (можно также брать водный 0,2 М раствор щавелевой кислоты);
и) глюкоза, фруктоза, сахароза и другие сахара, 2%~ные растворы; к) другие реактивы для количественного определения сахаров по антроновому методу.
Ход работы: Навеску свежего растительного материала (10—-30 г) заливают (для фиксации) десятикратным объемом кипящего 96%-ного этанола, нагревают 2—3 мин., добавляя небольшое количество углекислого кальция или натрия в порошке для нейтрализации кислот (под контролем лакмуса или универсального индикатора). Зафиксированная навеска (в колбе или склянке с притертой пробкой) может храниться в течение нескольких месяцев (в темном и прохладном месте). Фиксация спиртом является и началом экстракции сахаров, которые частично переходят в раствор. Сахара экстрагируют горячим (70—80 ºС) 80%-ным этанолом 3 раза по 30 мин. Перед началом экстракции рекомендуется дополнительно растереть материал в ступке. Спирт, который служил для фиксации навески, объединяют со спиртовыми вытяжками. После каждой экстракции охлажденную спиртовую вытяжку центрифугируют. Объединенные спиртовые вытяжки сгущают в вакууме до объема 3 мл. Если материал богат хлорофиллом и каротиноидами, то сгущенную вытяжку несколько раз взбалтывают с петролейным эфиром. Эфирный раствор пигментов сливают, а остатки растворителя удаляют на водяной бане при 50—60°. Сгущенную вытяжку количественно переводят в мерную колбу на 5 или 10 мл. Для осаждения белков и других примесей прибавляют по каплям раствор уксуснокислого свинца. Проверив полноту осаждения, раствор в колбе доводят до метки, затем фильтруют или, еще лучше, центрифугируют. Для осаждения избытки свинца, не пошедшего в реакцию, добавляют одну каплю насыщенного раствора сернокислого натрия и снова центрифугируют или фильтруют. Нарезают полосы хроматографической бумаги длиной 50—55 см и шириной 13—19 см или другого размера (в зависимости от диаметра хроматографической камеры). Бумагу разлиновывают графитовым карандашом, оставляя с одной стороны листа одну, а с другой — две контрольные полосы шириной 2— 2,5 см. Низ хроматограммы вырезают зубцами, что способствует равномерному скапыванию растворителя и предотвращает наблюдающийся иногда перекос пятен. Затем на линию старта отдельными пятнами по одному на основной части хроматограммы и на каждой из контрольных полос наносят с помощью микропипетки или капилляра определенный точный объем испытуемого раствора (например, по 0,01; 0,02 или 0,03 мл в пятно). Количество экстракта, наносимого в пятно, должно соответствовать примерно 30—50 мг сырого веса исследуемого материала в том случае, если в нем содержится 5—7 мг глюкозы, фруктозы и сахарозы на 1 г сырого веса ткани. Для установления оптимальной концентрации сахаров, вносимых в пятно, ставят отдельно две контрольные хроматограммы с нанесением различных объемов опытного экстракта (0,01—0,04 мл в пятно). На те же полосы наносят также и метчики — растворы сахаров (по 0,004 мл 2%-ных растворов). После нанесения растворов на бумагу приступают к разделению сахаров в соответствующей смеси растворителей (н-бутанол — пиридин — вода, 6:4:3; н-бутанол — уксусная кислота — вода, 4:1:5). Хроматография нисходящая. Продолжительность разделения 2—3 суток. После разделения хроматограммы высушивают в токе воздуха (в вытяжном шкафу) до полного удаления следов растворителя. Следующей задачей является определение положения пятен на основной части хроматограммы, так как сахара элюируют из непроявленной части бумаги. Для этого от основной хроматограммы отрезают контрольные полосы (а), (б) и (в) и опрыскивают две из них, например (а) и (б), проявителями на кетозы — резорцинфосфатом (реакцией Ф.Ф. Селиванова):
или раствором N-хлормочевины:
а (в) — проявителем на альдозы — анилинфталатом (анилиноксалатом):
Полосу, опрыснутую резорцинфосфатом, прогревают 3—4 мин. в сушильном шкафу при температуре 85—95ºС. Пятна фруктозы, сахарозы, раффинозы и олигосахаридов, содержащих фруктозу, окрашиваются в интенсивно розовый цвет. При нагревании хроматограммы, опрыснутой раствором хлормочевины, в течение 5 мин. при 105 ºС пятна альдоз принимают синее окрашивание. Полосу, обработанную раствором анилинфталата или анилиноксалата, нагревают при 105—110 ºС. При обработке хроматограммы анилинфталатом глюкоза и галактоза проявляются в течение 5 мин. при 105°С в виде желтовато-коричневых пятен; пятна пентоз вишнево-красного цвета. Мальтоза и лактоза дают желто-коричневые пятна при нагревании в течение 20 мин. при 105 ºС. При проявлении анилиноксалатом (110°С, 5—6 мин.) пятна альдоз имеют коричневое окрашивание. Проявленные контрольные полосы (а), (б) и (в) прикладывают к основной части хроматограммы (в) и таким образом определяют положение пятен отдельных сахаров на полосе (в), не проявляя ее. Участки бумаги, содержащие не проявленные пятна глюкозы, фруктозы, сахарозы и олигосахаридов, вырезают, разрезают на маленькие кусочки («лапшу») и элюируют сахара водой три раза по 30 мин. при 60—70°. Элюаты фильтруют через маленькие бумажные фильтры, выпаривают на водяной бане до небольшого объема, снова фильтруют и доводят до определенного объема. В растворе определяют содержание сахара с помощью антронового реактива.
Определение восстанавливающих сахаров колориметрическим методом (по И. С. Лурье)
Метод основан на взаимодействии восстанавливающих сахаров при нагревании со стандартным щелочным раствором красной кровяной соли. При этом ее часть восстанавливается в желтую кровяную соль.
С6Н12О6 + 2K3[Fe(CN)6] + 2KOH = СН2ОН(СНОН)4СООН + 2K4[Fe(CN)6] + Н2О
Избыток феррицианида определяют на фотоэлектроколориметре по характерному поглощению в области 420...440 нм (синий светофильтр). Расчет восстанавливающих сахаров ведут по калибровочной кривой. Метод удобен для серийных анализов и применим в тех случаях, когда испытуемый раствор не содержит других веществ, взаимодействующих с феррицианидом, а также веществ, имеющих поглощение в данной области спектра. При работе с биологическим материалом, исследуемые вытяжки бывают очень сложны по своему составу, часто опалесцируют, поэтому требуется определенная подготовка образца. Метод очень удобен для изучения накопления восстанавливающих сахаров под действием ферментов, гидролизующих углеводы, в экспериментах, моделирующих технологический процесс. В этом случае исследователя интересует не абсолютное содержание восстанавливающих сахаров, а их увеличение за счет ферментативной реакции. При этом факторы, влияющие на величину оптической плотности, нивелируются контрольными или нулевыми замерами.
Реактивы и материалы: а) 1 %-ный раствор феррицианида (10 г в 1 дм3). б) 1,25 н. раствор КОН (70 г в 1 дм3). в) 1 %-ный исходный раствор глюкозы. г) 0,1 %-ный и 0,2 %-ный рабочие растворы глюкозы.
Ход работы.
1.Выполнение анализа: В коническую колбу на 100 см3 вносят 10 см3 раствора феррицианида, 5 см3 раствора щелочи и от 1 до 5 см3 испытуемого раствора. Если объем пробы меньше 5 см3, то недостающее количество компенсируют водой. Колбочку прикрывают часовым стеклом и на слабом огне доводят до кипения. Кипятят ровно 1 минуту. Затем содержимое колбочки охлаждают до комнатной температуры и измеряют оптическую плотность на ФЭКе при синем светофильтре (420 нм). Количество сахара в испытуемом растворе определяют по калибровочной кривой.
2.Построение калибровочной кривой: Концентрацию исходного раствора глюкозы устанавливают по методу Бертрана. Для этого берут три пробы по 5 см3 1 %-ного раствора глюкозы, добавляют к каждой пробе по 15 см3 воды и 40 см3 реактива Феллинга. Концентрацию исходного раствора глюкозы рассчитывают как среднее значение из трех параллельных определений. Точную концентрацию рабочих растворов глюкозы рассчитывают по данным анализа исходного раствора. Сухие конические колбочки на 100 см3 заполняют согласно табл. 2.
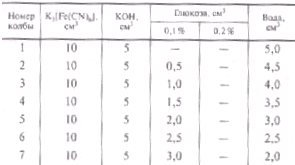


В заполненных колбочках проводят определение содержания глюкозы колориметрическим методом и строят калибровочную кривую в координатах «оптическая плотность — количество глюкозы, мг».
Определение восстанавливающих сахаров методом Шомадьи — Нельсона (предшественник метода Фолина-Ву)
Колориметрический метод Шомадьи — Нельсона основан на реакции восстанавливающих сахаров с реактивом Шомадьи — Нельсона, в результате которой образуется окрашенное соединение «молибденова синь» общего состава MonO3n-xголубого цвета. Интенсивность окраски пропорциональна содержанию восстанавливающих углеводов, которые определяют по величинам оптических плотностей при 508 нм, по калибровочной кривой, составленной с применением модельных растворов. Метод неспецифичен, трудоемок.
Реактивы и материалы: а) Реактив Шомадьи.
a 24 г карбоната натрия и 12 г тартрата калия — натрия (калий натрий виннокислый средний) помещают в коническую колбу вместимостью 500 см3 и добавляют 250 см3 дистиллированной воды. Затем приливают 40 см310 % раствора сульфата меди, перемешивают и добавляют 16 г гидрокарбоната натрия.
b.18 г Na2SO4 растворяют в 500 см3 горячей дистиллированной воды. Раствор кипятят в течение 40 минут для удаления СО2, затем охлаждают.
Cмешивают (a+b) в мерной колбе на 1 дм3, доводят до метки дистиллированной водой и перемешивают. В течение первых двух-трех суток хранения реактива Шомадьи оседает небольшое количество меди с примесями. Этот осадок отфильтровывают, готовый раствор хранят в темной склянке.
б) Реактив Нельсона.
a 25 г модибдата аммония помещают в мерную колбу на 500 см3 и растворяют в 150 см3 Н2О. Раствор перемешивают, к нему осторожно небольшими порциями добавляют 21 см3 концентрированной H2SO4 (х. ч.) при непрерывном перемешивании.
b 3 г гептагидрата гидроортоарсената натрия (Na2HAsO4 • 7Н2О) растворяют отдельно в химическом стаканчике в 50 см3 Н2О
(a+b). Получается прозрачный раствор светло-желтого цвета, его доводят до метки водой и выдерживают в термостате при 37 "С в течение 2 суток. После выдержки раствор готов к употреблению.
Ход работы.
1.Проведение анализа: К 1 см3 испытуемого раствора добавляют 1 см3 реактива Шомадьи, перемешивают и выдерживают на кипящей водяной бане в течение 15 минут:
СuSO4 + 2NaOH [гидролитический] ¾¾® Cu(OH)2 + Na2SO4
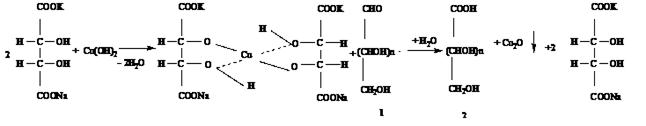
Затем к охлажденной смеси добавляют 1 см3 реактива Нельсона и доводят объем до 10 см3 дистиллированной водой:
Na2HAsO4 + 15H2SO4 + 12(NH4)2MoO4 [в реактиве Нельсона]¾¾® (NH4)3H4[As(Mo2O7)6] + 21(NH4)2SO4 + Na2SO4 + 10H2O
2(NH4)3H4[As(Mo2O7)6] + Cu2O ¾¾® 4Mo6O17 + 2CuO +(NH4)2SO4 + 2(NH4)2HAsO4 + 3H2O
Оптическую плотность полученного раствора измеряют при 590 нм с использованием кюветы с шириной грани 5 мм.
2.Построение калибровочной кривой. Калибровочную кривую строят после проведения колориметрической реакции модельных растворов глюкозы с концентрацией от 0,02 до 0,14 мг/см3. Изучаемая зависимость выражается прямой линией, выходящей из начала координат.
Определение фруктозы и других кетосахаров (по Мак-Рери и Слаттери)
Определение основано на способности кетосахаров давать вишневую окраску с резорцином в кислой среде:
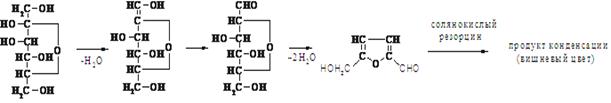
Реактивы и материалы: а) Спиртовой раствор резорцина
1 г резорцина растворить в 1 дм3 95%-ного этанола.
б) 30 %-ный раствор НС1 (не должен давать окраску с резорцином).
в) Стандартный раствор фруктозы
100 мг фруктозы растворяют в 100 см3 насыщенного водяного раствора бензойной кислоты.
г) Рабочий раствор фруктозы
1 см3 стандартного раствора фруктозы разводят в мерной колбе на 100 см3
Ход работы. В пробирку вносят 5 см3 испытуемого раствора (содержащего от 1 до 8 мг фруктозы в 100 см3 раствора), 5 см3 спиртового раствора резорцина и 15 см3 30 %-ного раствора НСI. Содержимое пробирки перемешивают и помещают на 20 минут в водяную баню при температуре 80 °С. Затем содержимое пробирки охлаждают до комнатной температуры и измеряют оптическую плотность на ФЭКе при 540 нм (зеленый светофильтр). В качестве контроля используют раствор, в котором вместо 5 см3 испытуемого раствора берется 5 см3 Н2О. Количество фруктозы определяют по калибровочной кривой. Для этого готовят серию разведений рабочего раствора фруктозы, в каждом из которых проводят определение фруктозы по описанной выше методике. Калибровочную кривую строят в координатах: «оптическая плотность — количество фруктозы, мг».
Газохроматографическое определение отдельных сахаров
Метод основан на переводе углеводов типа глюкозы, фруктозы, арабинозы, ксилозы, галактозы, сахарозы, мальтозы, лактозы, раффинозы, а также полиолов — сорбита и инозита в пищевых продуктах в триметилсилильные производные с последующей их идентификацией на газовом хроматографе.
Аппаратура, реактивы и материалы: а) Газовый хроматограф с пламенно-ионизационным детектором и устройством для программирования температуры. б) Стеклянная насадочная колонка длиной 2...3 м и диаметром З...4 мм или капиллярная колонка длиной 25...30 м с нанесенной фазой. в) Микрошприц емкостью 1,0...10мкл. г) Роторный испаритель. д)Гексан, х.ч. е)Гексаметилдисилазан. ж) Трифторуксусная кислота или триметилхлорсилан. з) Пиридин, х.ч., безводный. и) Ксилит, х.ч. или инозит. й) Свинец уксуснокислый, х.ч. к) Неподвижные фазы для ГЖХ SE-30, OV-17, ХЕ-60, СКТФТ-50. л) Инертный носитель для ГЖХ: хромосорб-W DMCS, хроматон-N DMCS.
Ход работы.
1. Подготовка образцов к анализу углеводов. Для получения достоверных результатов анализа необходимо учитывать содержание жира и лимонной кислоты в испытуемом образце. Предварительно содержание этих компонентов в пищевых продуктах можно оценить по «Таблицам химического состава пищевых продуктов» и на основании этого выбрать один из следующих способов подготовки образца к анализу.
Похожие работы
... присутствует сахар различных производителей и различных марок (сахар-песок, сахарная пудра, сахар-рафинад), а также различной фасовки. Предметом исследования послужили характеристики сахара-песка (фасовкой по 800 грамм) трех производителей: -"Русский сахар" Никифоровского завода, -"Услад" Добринского завода, -"Кристалл-Бел" Чернянского завода. Нами были отобранные пробы в соответствии с ...
... воде, а зная концентрацию SH-групп в тканях рыб и их возраст можно оценить "интегральное биологическое воздействие" нефтяного загрязнения природных вод на гидробионты. Кинетический метод определения йода в пищевых продуктах и продовольственном сырье Среди каталитических методов получил применение рода-нидно-нитритный метод. Он основан на реакции окисления роданид-иона смесью нитрат- и нитрит- ...
... приносит прибыль. Это все переменные составляющие предприятия от сырья и до денежных средств, которыми располагает предприятие. Из этого напрямую следует, что от эффективности использования оборотных средств зависит размер прибыли и само существование предприятия, потому что в реалиях современного рыночного механизма, когда оно перестанет оборачиваться – оно перестанет существовать. 1.2 ...
... биохимических, бактериологических показателей мясо используют на пищевые цели после санитарной обработки (зачистки измененных мест и обезвреживание проваркой) или направляют на техническую утилизацию. 3. МЕТОДЫ ОПРЕДЕЛЕНИЯ СВЕЖЕСТИ МЯСА 3.1 Органолептический метод Большое значение при оценке степени свежести мяса придается органолептическому методу. Однако этот метод субъективен и бывает, ...









0 комментариев