Навигация
Ответ: Wпрактический
выход (C6H5-NH2) = 97.75%
Билет №18
3.Частные реакции на сульфат-анионы SO42-.
![]() SO42- - определяемый ион, реактив Ва2+ дает белый осадок.
SO42- - определяемый ион, реактив Ва2+ дает белый осадок.
![]() Na2SO4 + BaCl2 = 2NaCl + BaSO4
Na2SO4 + BaCl2 = 2NaCl + BaSO4
![]() 2Na+ + SO42- + Ba2+ + Cl- = 2Na+ + 2Cl- + BaSO4
2Na+ + SO42- + Ba2+ + Cl- = 2Na+ + 2Cl- + BaSO4 ![]()
![]() SO42- + Ba2+ = BaSO4
SO42- + Ba2+ = BaSO4
Билет №19
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано: 150г 20% х
m(H2SO4)= 150г Fe + H2SO4 = FeSO4 + H2
w(H2SO4)=20% m=98г V=22.4л
![]()
V(H2) - ? 1) w = m / M * 100% m = w * M / 100%
m = 150г * 20% / 100%
m = 30 г
![]()
![]() 2) 98г(H2SO4) 22.4л(H2) х = 6.86л
2) 98г(H2SO4) 22.4л(H2) х = 6.86л
![]() 30г(H2SO4) х
30г(H2SO4) х
Ответ: V(H2) = 6.86л
Билет №20
3.Частные реакции на карбонат-анионы СO32-.
СО32- - определяемый ион, Н+ - ион, используемый для определения.
![]()
![]() СаСО3 + НСl = CaCl2 + H2CO3
СаСО3 + НСl = CaCl2 + H2CO3
![]() H2O CO2
H2O CO2
Образующийся газ пропускают через раствор известковой воды Са(ОН)2 и наблюдают помутнение раствора из-за образования нерастворимого СаСО3 :
![]() CO2+ Са(ОН)2 = H2O + СаСО3
CO2+ Са(ОН)2 = H2O + СаСО3
Углекислый газ не поддерживает горения. При опускании горящей лучинки с колбу с CO2 она тут же гаснет.
Билет №21
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано:
m (C2H4) = 1.2т Составляем схему реакции:
![]() С2Н4 + Н2О = C2H5OH
С2Н4 + Н2О = C2H5OH
![]() m (C2H5OH) - ? Составим пропорцию:
m (C2H5OH) - ? Составим пропорцию:
![]() 2.8 г С2Н4 46г C2H5OH
2.8 г С2Н4 46г C2H5OH
![]() 1.2 т С2Н4 х х = 1.9 т C2H5OH
1.2 т С2Н4 х х = 1.9 т C2H5OH
Ответ: m (C2H5OH) = 1.9 т
Билет №22
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано:
m (CaC2) = 1 кг CaC2 + 2Н2О = Са(ОН)2 + C2H2
w (примесей) = 20% m=64г V=22.4л
![]()
![]()
![]() V (C2H2) - ? 64 г CaC2 22.4 л C2H2
V (C2H2) - ? 64 г CaC2 22.4 л C2H2
![]() 1000 * 0.8 «CaC2 – х» C2H2 х = 1000 * 0.8 * 22.4 = 280 л
1000 * 0.8 «CaC2 – х» C2H2 х = 1000 * 0.8 * 22.4 = 280 л
64
Ответ: 280 л C2H2.
Билет №23
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано:
m (Al4C3) =57.6 г Al4C3 + 12Н2О = 3СН4 + 4Al(OH)3
w (примесей) = 20% Mасса Al4C3 М = 57.6 * 0.8 = 46.04г
![]() Составим пропорцию:
Составим пропорцию:
![]() V (воздуха) -? 144 г Al4C3 67.2 л СН4
V (воздуха) -? 144 г Al4C3 67.2 л СН4
![]()
![]() 46.04 г х х = 46.04 * 67.2 = 21.5 л
46.04 г х х = 46.04 * 67.2 = 21.5 л
144
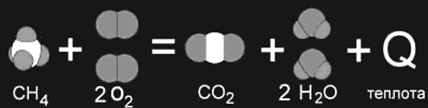
Реакция горения метана: СН4 + 2О2 = СО2 + 2Н2О
![]()
![]()
![]() Составим пропорцию: 1 л СН4 2 л О2
Составим пропорцию: 1 л СН4 2 л О2
![]()
![]() 21.5 СН4 х х = 21.5 * 2 = 43 л
21.5 СН4 х х = 21.5 * 2 = 43 л
1
Ответ: V = 43 л
Билет №24
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано: 3CaO + 2Al = 3Ca + Al2O3
m (Ca) = 1 т Cоставим пропорцию:
![]()
![]()
![]() 2 * 27 кг Al 3 * 40 кг Са
2 * 27 кг Al 3 * 40 кг Са
![]() m (Al) - ? х Аl 1000 кг Са х = 450 кг
m (Al) - ? х Аl 1000 кг Са х = 450 кг
Ответ: m (Al) = 450 кг
Билет №25
![]() 3.Задача.
Решение:
3.Задача.
Решение:
Дано:
![]() m (C6H12) = 840 кг C6H6 + 3Н2 = C6H12
m (C6H12) = 840 кг C6H6 + 3Н2 = C6H12
![]() w (практ. выход)=80% 1) 840 кг 80 %
w (практ. выход)=80% 1) 840 кг 80 %
![]() х 100% х = 1050 кг C6H12
х 100% х = 1050 кг C6H12
(теорет. выход)
m (C6H6) - ?
![]() 2) 78 г C6H6 84 г C6H12
2) 78 г C6H6 84 г C6H12
![]() х 1050 кг C6H12 х = 975 кг C6H6
х 1050 кг C6H12 х = 975 кг C6H6
Ответ: m (C6H6) = 975 кг C6H6
Похожие работы
... в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии. 2. Применение теплового эффекта на практике Тепловые эффекты химических реакций нужны для многих технических расчетов. Например, рассмотрим мощную российскую ракету "Энергия", способную выводить на орбиту космические корабли и другие полезные ...
... коэффициенты в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии. 2. Применение теплового эффекта на практике Тепловые эффекты химических реакций нужны для многих технических расчетов. Например, рассмотрим мощную российскую ракету "Энергия", способную выводить на орбиту космические корабли и ...
... условия сдвига равновесия вправо .... Глава 2. Прикладные аспекты преподавания темы «Закономерности течения химических реакций» Прикладные аспекты преподавания темы «Закономерности течения химических реакций» на мой взгляд удобнее всего рассматривать на уроках, которые следуют сразу за рассмотрением скорости реакции и химического равновесия, - это производство серной кислоты. 2.1 ...
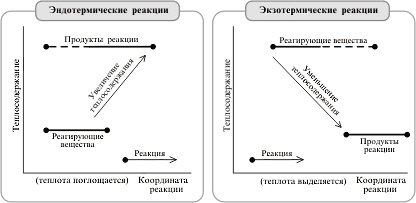
... , с другой. Реакции, протекающие с выделением энергии, называют экзотермическими, а реакции, при которых энергия поглощается, — эндотермическими. Термохимия Энергетические изменения, сопровождающие протекание химических реакций, имеют большое практическое значение. Иногда они даже важнее, чем происходящее при данной реакции образование новых веществ. В качестве примера достаточно вспомнить ...

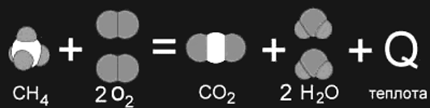







0 комментариев