Навигация
Графический метод решения химических задач
ВВЕДЕНИЕ
Решение расчетных задач – важнейшая составная часть школьного предмета «химия», так как это один из приёмов обучения, посредством которого обеспечивается более глубокое и полное усвоение учебного материала по химии и вырабатывается умение самостоятельного применения полученных знаний.
Чтобы научиться химии, систематическое изучение известных истин химической науки должно сочетаться с самостоятельным поиском решения сначала малых, а затем и больших проблем.
1. Математические способы решения расчетных задач по химии
Как бы ни были интересны теоретические разделы учебника и качественные опыты практикума, они недостаточны без численного подтверждения выводов теории и результатов эксперимента: ведь химия – количественная наука. Включение задач в учебный процесс позволяет реализовать следующие дидактические принципы обучения: 1) обеспечение самостоятельности и активности учащихся; 2) достижение прочности знаний и умений; 3) осуществление связи обучения с жизнью; 4) реализация предпрофильного и профильного политехнического обучения.
Решение задач является одним из звеньев в прочном усвоении учебного материала, так как формирование теорий и законов, запоминание правил и формул, составление уравнений реакций происходит в действии.
В решении химических задач целесообразно использовать алгебраические приёмы. В этом случае исследование и анализ ряда задач сводятся к преобразованиям формул и подставлению известных величин в конечную формулу или алгебраическое уравнение. Задачи по химии похожи на задачи по математике, и некоторые количественные задачи по химии (особенно на «смеси») удобнее решать через систему уравнений с двумя неизвестными.
Рассмотрим несколько таких задач
Задача 1.
Смесь карбонатов калия и натрия массой 7 г обработали серной кислотой, взятой в избытке. При этом выделившийся газ занял объем 1,344 л (н.у.). Определить массовые доли карбонатов в исходной смеси.
Решение .
Составляем уравнений реакций:
| xг | yл |
| Na2CO3 + H2SO4 = Na2SO4 + CO2^ + H2O | |
| 1моль | 1моль |
| 106г | 22,4л |
| (7-х)г | (1,344-у)л |
| K2CO3 + H2SO4 = K2SO4 + CO2^ + H2O | |
| 1моль | 1моль |
| 138г | 22,4л |
Обозначим через хг массу карбоната натрия в смеси, а массу карбоната калия – через (7-х)г. Объём газа, выделившегося при взаимодействии карбоната натрия с кислотой, обозначаем через у л, а объём газа, выделившегося при взаимодействии карбоната калия с кислотой, обозначаем через (1,344-у)л.
Над уравнениями реакций записываем введенные обозначения, под уравнениями реакций записываем данные, полученные по уравнениям реакций, и составляем систему уравнений с двумя неизвестными:
х/106 = у/22,4 (1)
(7-х)/138=(1,344-у) (2)
Из первого уравнения выражаем у через х:
у = 22,4х/106 (3)
(1,344-22,4х/106)•138=22,4•(7-х). (4)
Решаем уравнение (4) относительно х.
185,472-29,16х=156,8-22,4х
6,76х=28,672
х=4,24
Следовательно, масса карбоната натрия равна 4,24 г.
Массу карбоната калия находим вычитанием из общей массы смеси карбонатов массы карбоната натрия:
7г-4,24г=2,76г.
Массовые доли карбонатов находим по формуле:
w=(mком-та/mобщая)•100%
w(Na2CO3)=(4.24/7)•100%=60.57%
w(K2CO3)=(2.76/7)•100%=39.43%.
Ответ: массовая доля карбоната натрия равна 60,57%, массовая доля карбоната калия равна 39,43%.
Задача 2.
Смесь карбонатов калия и натрия массой 10 г растворили в воде и добавили избыток соляной кислоты. Выделившийся газ пропустили через трубку с пероксидом натрия. Образовавшегося кислорода хватило, чтобы сжечь 1,9 л водорода (н.у.). Напишите уравнения реакций и рассчитайте состав смеси.
Решение.
Составляем уравнения реакций:
| х г | y л |
| Na2CO3 + 2HCl = 2NaCl + H2O + СО2 (1) | |
| 1моль | 1моль |
| 106г | 22,4л |
| (10-x)г | (1.9-y)л |
| K2CO3 + 2HCl = 2KCl + H2O + CO2^ (2) | |
| 1моль | 1моль |
| 138г | 22,4л |
| х л | 0,95л |
| 2Na2O2 + 2CO2 = 2Na2CO3 + O2 (3) | |
| 2моль | 1моль |
| 44,8л | 22,4л |
| 1,9л | хл |
| 2Н2 + О2 = 2Н2О (4) | |
| 2моль | 1 моль |
| 44,8л | 22,4л |
Обозначим через х г массу карбоната натрия, а масса карбоната калия будет равна (10-х)г.
По уравнению (4) рассчитаем объем кислорода, образовавшегося в процессе реакции (3).
Для этого через х в уравнении обозначим объём кислорода и, исходя из объёма водорода, составим пропорцию и решим её относительно х:
1,9/44,8=х/22,4;
х=1,9•22,4/44,8;
х=0,95л (объём выделившегося кислорода).
Исходя из уравнения (3), рассчитаем объём углекислого газа, образовавшегося при обработке смеси карбонатов натрия и калия избытком соляной кислоты. Для этого составим пропорцию:
х/44,8=0,95/22,4;
х=0,95•44,8/22,4;
х=1,9л.
Через у л обозначим объём газа, выделившегося в процессе реакции (1), а через (1,9-у)л – объём газа, выделившегося в процессе реакции (2). Составим систему уравнений с двумя неизвестными:
х/106=у/22,4 (5)
(10-х)/138=(1,9-у)/22,4 (6)
Из уравнения (5) выражаем у через х и подставляем в уравнение (6):
у=22,4х/106
(10-х)/138=(1,9-22,4х/106)/22,44 (7).
Уравнение (7) решаем относительно х:
(1,9-22,4х/106)•138=22,4•(10-х);
262,2-29,16х=224-22,4х;
6,76х=38,2;
х=5,65г (масса карбоната натрия).
Масса карбоната калия находится как разность между массой смеси карбонатов натрия и калия и массой карбоната натрия:
10-5,65=4,35г (масса карбоната калия).
w(Na2CO3)=(5,65/10)•100%
w(Na2CO3)=56.5%
w(K2CO3)=(4.35/10)•100%
w(K2CO3)=43.5%/
Ответ: массовая доля карбоната натрия равна 56,5%, массовая доля карбоната калия равна 43,5%.
Задачи для самостоятельного решения
Задача 3
Смесь железа и цинка массой 12,1 г обработали избытком раствора серной кислоты. Для сжигания полученного водорода необходимо 2,24л кислорода (давление 135,6 кПа, температура – 364К). Найдите массовую долю железа в смеси.
Задача 4
Смесь метиловых эфиров уксусной кислоты и пропионовой кислоты массой 47,2г обработали 83,4мл раствора гидроксида натрия с массовой долей 40% (плотность 1,2г/мл). Определите массовые доли эфиров ( в %) в смеси, если известно, что гидроксид натрия, оставшийся после гидролиза эфиров, может поглотить максимально 8,96л оксида углерода (IV).
Эти задачи можно решать и другими способами, но этот способ решения задач по химии способствует развитию логического мышления, даёт возможность показать взаимосвязь математики и химии, формирует умение составлять и применять алгоритмы последовательности действий при решении, дисциплинирует и направляет деятельность на правильное использование физических величин и корректное проведение математических расчётов.
Задача 1. Рассчитайте массы растворённого вещества и растворителя, которые необходимо взять для приготовления 150 г 20%-ного раствора.
Решение задачи начинаем с построения системы координат. Конечно, удобнее использовать специальную миллиметровую бумагу, но и обычный тетрадный лист в клетку позволяет получить ответ с достаточной точностью. На оси х откладываем массу раствора 150 г, на оси у — 100% (рис. 1). Строя перпендикуляры из этих точек, находим точку их пересечения. Соединяем её прямой линией с точкой начала координат. Полученный отрезок является основой для решения задачи.
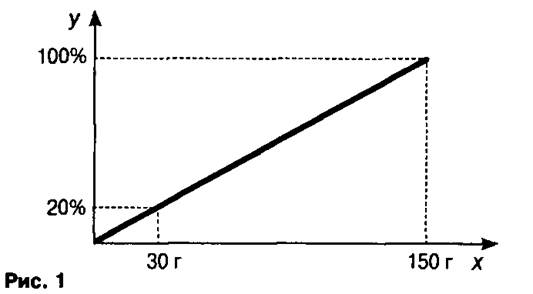
Затем на оси у находим точку, соответствующую 20%, восстанавливаем из неё перпендикуляр до пересечения с отрезком, а из точки пересечения опускаем перпендикуляр на ось х. Это ответ задачи. О т в е т: 30 г.
Задача 2. К 150 г 20%-ного раствора соли добавили 30 г соли. Определите массовую долю соли в полученном растворе.
Начало решения аналогично решению задачи 1: для исходного раствора находим массу растворённого вещества (30 г) (рис. 2). Затем строим новый отрезок для нового раствора, полученного в результате добавления соли к исходному. На оси х от точки, соответствующей массе исходного раствора, откладываем вправо 30 г (масса добавленной соли), это масса полученного раствора. Восстанавливаем из неё перпендикуляр до пересечения с прямой, проходящей через отметку 100% на оси у. Точку их пересечения соединяем с началом координат — получаем отрезок, соответствующий новому раствору
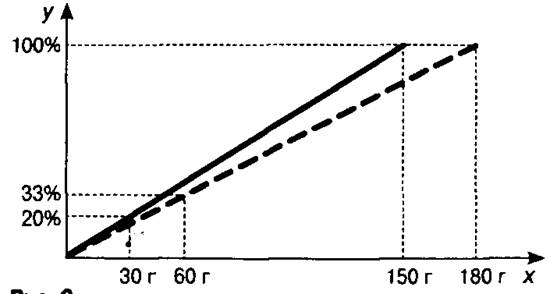
(показан пунктирной линией). На оси х от точки, показывающей массу соли в первом растворе, откладываем вправо 30 г (масса добавленной соли) и получаем массу соли во втором растворе. Восстанавливаем из неё перпендикуляр до пересечения с пунктирным отрезком, а из точки пересечения — перпендикуляр на ось у. Значение^ равно массовой доле соли во втором растворе. О т в е т: 33%.
Задача 3. Из 170 г 9%-ного раствора выпарили 50 г растворителя. Определите массовую долю соли в полученном растворе.
Построив отрезок, соответствующий начальному раствору, находим массу растворённого в нём вещества (рис. 3). Затем от массы первого раствора откладываем влево 50 г — получаем массу второго раствора. Восстанавливаем из этой точки перпендикуляр до пересечения с прямой, проходящей через точку 100%, точку пересечения соединяем с началом координат. Мы построили отрезок (обозначен пунктиром) для второго раствора. На него восстанавливаем перпендикуляр из точки, показывающей массу соли в исходном растворе, а из точки пересечения, в свою очередь, опускаем перпендикуляр на ось, где находим ответ задачи. Ответ: 13%.
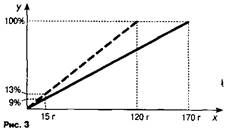
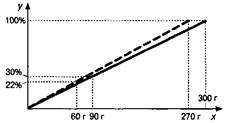
Задача 4. Насыщенный при 70 °С раствор имеет массу 300 г и массовую долю растворённого вещества 30%. При его охлаждении до 20 °С выпал осадок массой 30 г. Определите массовую долю соли из полученном растворе.
Строим отрезок для начального раствора и находим для него на оси х точку, соответствующую массе растворённого вещества (рис. 4). Затем от массы первого раствора влево откладываем 30 г и находим массу нового раствора, восстанавливаем из этой точки перпендикуляр до пересечения с линией 100%, полученную точку соединяем с началом координат. Получили отрезок для второго раствора (обозначен пунктиром). От массы растворённого вещества в первом растворе на оси масс откладываем влево 30 г - получаем массу соли во втором растворе. Из соответствующей ей точки восстанавливаем перпендикуляр на пунктирный отрезок и из полученной точки пересечения — перпендикуляр на ось процентов, где и находим ответ задачи. Ответ: 22%.
Задача 5. Определите массовую долю вещества в растворе, полученном в результате сливания 120 г 16%-ного раствора с 60 г 20%-ного раствора.
Строим отрезок, соответствующий первому раствору, и находим массу растворённого в нём вещества (рис. 5). Из точки, обозначающей массу первого раствора, проводим вспомогательную ось у для построения отрезка (обозначен пунктиром), характеризующего второй раствор, и нахождения с его помощью массы растворённого в нём вещества. После проведения указанных операций на оси масс
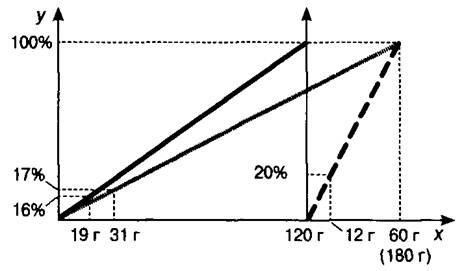
имеются два отрезка, соответствующие массам исходных растворов. Так как начало второго отрезка совпадает с концом первого, то их общая длина соответствует массе третьего раствора. Соединив точку пересечения перпендикуляров, проходящих через точки 100% и 180 г (на графике она уже получена при построении отрезка для второго раствора), с началом основной системы координат, получаем отрезок для третьего раствора (обозначен серой линией ).
Кроме этого, на оси х отложены два отрезка, соответствующие массам растворённых в исходных растворах веществ. Переместим отрезок, равный массе растворённого во втором растворе вещества, из вспомогательной системы координат в основную, отложив его от конца отрезка, равного массе растворённого вещества в первом растворе. Полученный суммарный отрезок соответствует массе растворённого вещества в третьем растворе. Остаётся восстановить из его конечной точки перпендикуляр на отрезок, характеризующий третий раствор, а из полученной точки пересечения провести перпендикуляр на ось процентов. Найденная на ней точка даёт искомый ответ задачи. О т в е т: 17%.
Конечно, данный способ решения не может рассматриваться как замена алгебраического метода решения, но он позволяет разнообразить деятельность учащихся, сделать её более интересной. Каждый ученик может выбрать тот метод решения, который ему наиболее понятен, что повышает эффективность образовательного процесса.
Похожие работы
... с помощью двухэтапного метода, совпадает с решением, полученным в среде MS Excel с помощью программной надстройки «Поиск решения». 7. ПРИМЕРЫ ПОСТАНОВОК, ФОРМАЛИЗАЦИИ И РЕШЕНИЯ ПЕРСПЕКТИВНЫХ ОПТИМИЗАЦИОННЫХ УПРАВЛЕНЧЕСКИХ ЗАДАЧ Одним из методов решения задач линейного программирования является графический метод, применяемый для решения тех задач, в которых имеются только две переменные, ...
... проектов в обучении химии; · использование цифровых лабораторий как современного информационного оборудования в проведении химического эксперимента, в частности использование цифровой лаборатории «Архимед» [20]. Дистанционное и открытое образование. В основе концепции открытого образования лежит творческий характер обучения. Такая форма образовательного процесса включает ученика в ...
... , и что оптимизация программы может быть достигнута максимизацией (минимизацией) линейной целевой функции. В металлургической технологии наибольшее распространение получила задача составления технологических смесей, а конкретно, задача оптимизации химического состава сплавов. Для того, чтобы исследовать метод «Оптимизации химического состава сплава», я воспользовался данными из прокатного цеха ...
... , таблица). Метод моделирования позволяет активизировать познавательную деятельность учащихся на уроке. 2.2. Опытно – экспериментальная работа. Анализ ее результатов Изучив теоретические положения по использованию моделирования при решении задач в 5 классе, у автора возникло желание и интерес реализовать это на практике. Для того чтобы доказать или опровергнуть предположение, что ...

0 комментариев