Навигация
Генерация движения микрофиламентами
5. Генерация движения микрофиламентами
Микрофиламенты могут генерировать движение двумя различными способами: путем скольжения — согласно этому механизму актиновые и миозиновые нити скользят друг относительно друга – или же просто путем сборки и дезагрегации пучков микрофиламентов. Опять мы сталкиваемся с удивительным соответствием между системой микрофиламентов и системой микротрубочек: обе системы генерируют движенце, одними и тещи же способами. Это представляет интерес с эволюционной точки зрения, поскольку указывает на то, что системы, которые возникли, по-видимому, независимо друг от друга, решили проблему генерации движения одинаково, хотя и с помощью различных материалов.
Модель скольжения микрофиламентов, описывающая зависимые от актомиозина движения немышечных клеток, исходит из данных о сокращении мышц, модель которого можно применить с незначительными модификациями к микрофиламентам.
В немышечных клетках такая система подвижности состоит из актиновых микрофиламентов, один конец которых прикреплен к каким-либо структурам клетки (к клеточной мембране, микротрубочкам или другим органеллам, а другой конец свободен;, менаду свободными концами двух противолежащих актиновых микрофиламентов находятся биполярные миозиновые нити. Когда два противолежащих актиновых микрофиламента скользят вдоль миозиновой нити, их свободные концы сближаются, а закрепленные концы тянут за собой те структуры, к которым они присоединены. В мышцах всё это происходит в структурах, специально предназначенных для генерации движения (саркомерах). Саркомер состоит из двух пучков актиновых нитей (они прикреплены к Z-мембранам, ограничивающим саркомер) с миозиновыми нитями между ними. В результате скольжения нитей саркомер укорачивается, что соответствует сокращению мышцы. В немышечных клетках такое скольжение приводит к сближению структур, к которым прикреплены противоположные концы микрофиламентов
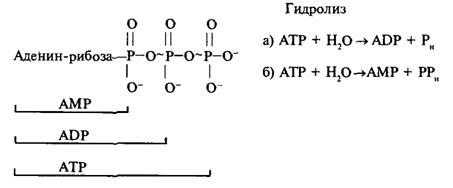
Рассмотрим теперь, как же при взаимодействии актиновых и миозиновых нитей возникает скольжение. Инициатором является миозин, точнее головки его молекулы, где находятся центры АТРазной активности. Миозиновые головки отличаются большим сродством к АТР, и при его избытке каждая головка связывает одну молекулу АТР.

Рисунок 12. «Модели взаимодействия актина и миозина. Вверху, мышце; посередине и внизу: в немышечных клетках».
Связав АТР, миозиновая головка сразу же переходит в активированное состояние с высоким сродством к актину и прикрепляется к одной из актиновых субъединиц ближайшего микрофиламента. Связывание с актином немедленно вызывает гидролиз АТР, за счет выделившейся - при этом энергии головка поворачивается на небольшой угол, что немного перемещает актиновый филамент, к которому головка прикреплена. При утилизации новых порций АТР такой цикл повторяется многократно, скольжение становится заметным. Мы привели весьма упрощенное описание процессов, связанных с актомиозинзависимой сократимостью мышечных волокон. Более полное описание читатель найдет в другой книге этой же серии (R. Μ. Simmons Muscle Contraction"). Этот основной механизм взаимодействия актина и миозина можно, по-видимому, распространить также и • на немышечные клеточные системы.
5.1 Регуляция скольжения белками микрофиламентов
В мышечных клетках актиновые нити содержат (кроме, актина) два регуляторных белка — тропомиозин и тропонин, благодаря которым скольжение чувствительно к концентрации ионов Са2+. Связывание комплекса миозин — АТР с актином возможно только в присутствии Са2+, т. е. Са2+ служит, регулятором мышечного сокращения. Концентрация Са2+ внутри саркомеров регулируется высвобождением его из саркоплазматического ретикулума при деполяризации мембраны.
Тот факт, что миозин действительно присутствует в микрофиламентах животных клеток, был продемонстрирован с помощью антител к миозину, меченных флуоресцеином. Возможно также, что в немышечных клетках миозиновые молекулы существуют не в виде типичных нитей с выступающими головками, а просто как двуглавые мономеры, сохраняющие способность связывать актиновые микрофиламенты. Другая модель, которую предложили Марута и Корн, предполагает, что одиночные, миозиновые молекулы присоединены к актиновому филаменту стержневыми участками тяжелых цепей, так что свободные головки могут взаимодействовать с соседними актиновыми филаментами. В этом случае подвижность обеспечивалась бы непосредственно скольжением двух актиновых микрофиламентов друг относительно друга, т, е. так, как скользят микротрубочки в ресничках и жгутиках. Согласно этой модели, одноглавый миозин, который, по-видимому, не способен образовывать биполярные нити (как, например, миозин Acanthamoeba), тоже мог бы участвовать в генерации движения.
Поскольку подвижность зависит от взаимодействия актина и миозина, факторы, регулирующие это взаимодействие, можно рассматривать как регуляторы клеточной подвижности. В мышечных клетках управление сокращением осуществляется с помощью ионов Са2+ и системы тропомиозин — тропонин, связанной с актиновыми нитями. В немышечных клетках регуляция еще недостаточно изучена. Ясно, однако, что в клетках различных типов может, быть много разных регуляторных систем — одни из них основаны на действии Са2+, а Другие реализуют другие механизмы.
Ферментативная активность при взаимодействии очищенных препаратов актина и миозина из немышечных клеток не зависит, как правило, от концентрации Са2+, однако известны примеры Са2+ чувствительной АТРазной активности актомиозина из тканей мозга, из лейкоцитов, тромбоцитов и плазмодия миксомицета Physarum polycephalum . Чувствительность к Са2+ можно определить, регистрируя сокращение актомиозиновых нитей в клеточных экстрактах (это сделано на амебах и некоторых других клетках). Данные in vivo о подвижности, чувствительной к Са2+, в которой участвуют микрофиламенты, получены при исследовании токов цитоплазмы у Amoeba proteus, Chaos carolinensis и Physarum, а также АТР-зависимого сокращения изолированных полосок щеточной каемки кишечного эпителия.
В мышечных клетках сокращение регулируется Са2+-связывающим белком системы тропомиозин — тропонин, поэтому некоторые исследователи искали подобные белки и в немышечных клетках. Белки, подобные тропомиозину, удалось найти в тромбоцитах, в тканях мозга, в поджелудочной железе и в культуре фибробластов мышц; Са2+-связывающий белок, похожий на тропонин мышц, недавно выделили из мозга куриных эмбрионов. Белки, придающие, актомиозиновому комплексу чувствительность к Са2+, выделены из Physarum и Dictyosteиит, однако эти данные нуждаются в дальнейшей проверке.
Наряду с кальциевой регуляцией, несомненно, существуют и другие регуляторные системы, контролирующие взаимодействие актина и миозина.
Одной из них может быть регуляция фосфорилирования миозина. Было показано, например, что в тромбоцитах АТРазная активность миозина, стимулированная актином, возрастает приблизительно в 5 раз, когда легкая (17 000) цепь миозина фосфорилируется особой протеинкиназой в присутствии АТР. Это позволяет предполагать, что фосфорилирование прямо влияет на взаимодействие актина и миозина. Однако относительно этой системы пока еще преждевременно делать окончательные выводы.
Из приведенных выше примеров должно быть ясно, что в настоящий момент еще нет единой теории регуляции актомиозинового взаимодействия в немышечных клетках. Отчасти это обусловлено сравнительной скудостью сведений, которыми мы располагаем по этому вопросу, а отчасти—сложностью самой проблемы. Вероятно, что в регуляции взаимодействия актина с миозином в немышечных клетках участвует многих систем. Для некоторых клеток важное значение имеют ионы Са2+, о других механизмах регуляции известно пока еще слишком мало.
Есть еще один способ генерировать движение, который используется не для перемещения всей клетки как целого, а для движения отдельных ее частей (например, мембран); речь идет о подвижности, обусловленной полимеризацией и деполимеризацией пучков актиновых филаментов. В этом случае движение обусловлено не скольжением, а ростом пучков микрофиламентов, которые при этом отталкивают ту часть клетки, которая контактирует с зоной их роста (обратный процесс, как можно представить себе, происходит при деструкции микрофиламентов).
Пример движения такого типа — уже упоминавшаяся акросомальная реакция. В процессе этой реакции менее чем за 10 с, формируется прямой пучок микрофиламентов, выпячивающий мембрану сперматозоида в направлении яйца.
В цитоплазме некоторых немышечных клеток нередко обнаруживают другой тип надмолекулярной организации актиновых мономеров: вместо обычных пучков микрофиламенты образуют тонкую трехмерную сеть.
Это явление можно воспроизвести in vitro; оно известно под названием процесса желатинизации. Такие, как их еще, называют, переходы золь — гель имеют, по-видимому, существенное значение для регуляции вязкости цитоплазмы и изменения формы клетки, и, хотя эти функции могут быть косвенно связаны с движением клетки, их нельзя считать истинной подвижностью.
Список используемой литературы
1.Биологический энциклопедический словарь. / Гл. ред. М. С. Гилярон; Редкол.: А. А. Баев, Г. Г. Винберг, Г. А. Заварзип и др. — 2-е изд., исправл. — М.: Сов. энциклопедия, 1989. — 864 с, ил.
2.Варфоломеев С. Д., Гуревич К. Г. Биокинетика: Практический курс. – М.: ФАИР-ПРЕСС, 1999.– 720 с: ил.
3.Мецлер Д. Биохимия: Химические реакции в живой клетке. В 3-х томах том 1, 2, 3. Пер. с англ. – М.: Изд-во «Мир», – 1980.
4.Ченцов Ю.С. Введение в клеточную биологию: Учебник для вузов. – 4-е изд., перераб, и доп. / Ю.С. Ченцов. – М.: ИКЦ «Академкнига», 2004. – 495 с: ил.
5.Юрина Н. А., Радостина А. И. Гистология: Учебник. – М.: Медицина, 1995. – 256 с; ил.
6.Гистология: Учебник. 2-е изд., перераб, и доп. / Под ред. Э.Г. Улумбекова, Ю./ Челышева. – М.: ГЭОТАР-МЕД, 2002. – 672 с: ил.
Похожие работы
... подавления активности ферментов служит одним из способов расшифровки механизма их действия. Подходом к решению последней задачи является изучение специфичности действия ферментов. В свою очередь, это требует корректного измерения кинетических параметров в присутствии изучаемого аналога субстрата. Рассмотрим способы определения характера взаимоотношений субстратов, их аналогов и ингибиторов ...
... Escherichia coti около 1 мкм за 25 с. Кроме того, способ сегрегации может определяться скоростью роста микроорганизма: у медленно растущих клеток Escherichia coii он близок к биполярному, а у быстро растущих становится днсперсивным. Построение клеточной перегородки В изучении механизмов регуляции данного этапа клеточного цикла важную роль сыграли специфические мутанты, особенно мутанты ...
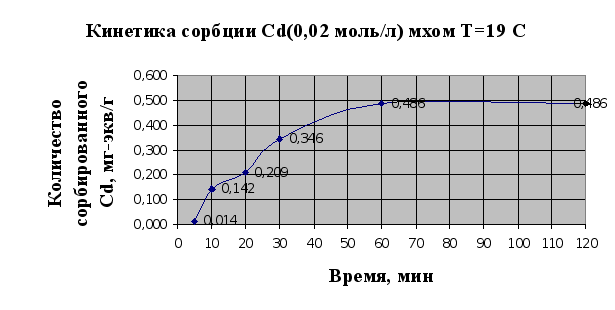
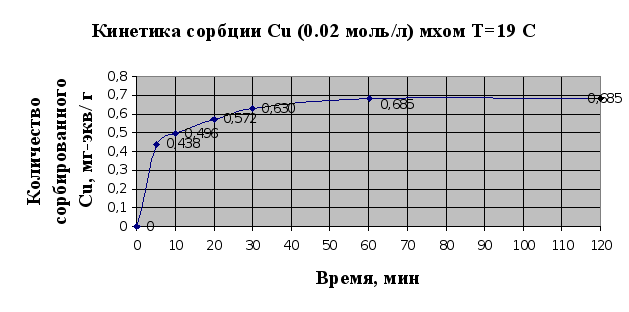
... Листов Пров. 1 2 Консульт. БГТУ 7140607 2004 Н. контр. Утв. Целью данной дипломной работы является изучение сорбционных свойств мха по отношению к микроорганизмам и тяжелым металлам, а также изучение сорбционной способности системы «мох-микроорганизмы» и выявление доли участия каждого компонента этой ...
... переломов ослабленных костей / Тр. конгресса Человек и его здоровье. СПб, 1999 - с. 55. 44. Воложин А.И., Курдюмов С.Г., Орловский В.П., Баринов С.М. и др. Создание нового поколения биосовместимых материалов на основе фосфатов кальция для широкого применения в медицинской практике // Технологии живых систем. 2004. Т.1, №.1. С. 41-56. 45. Безруков В.М., Григорян А.С. Гидроксилапатит как ...





0 комментариев