Навигация
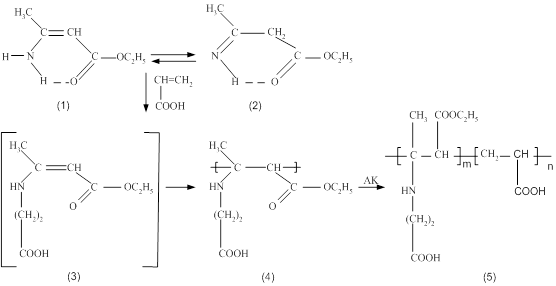
Реакция присоединении Михаэля с последующей радикальной полимеризацией синтезирован новый полиамфолит на основе этил-
1. Реакция присоединении Михаэля с последующей радикальной полимеризацией синтезирован новый полиамфолит на основе этил-
3- аминокротоната и акриловой кислоты. Определен состав сополимера, равный [ЭЭАКК]:[АК]=22,99:77,01мол%.
1. Изучено поведение синтезированного сополимера от ионной силы, смешанного растворителя, температуры, рН-среды. Обнаружено, что с ростом ионной силы полиэлектролитный эффект, обнаруживаемый в водных растворах полностью подавляется. Поведение полимерных частиц в смешанных растворителях обусловлено термодинамическим качеством растворителя и гидрофобно- гидрофильным балансом в смесях различного состава. Температура в интервале 25-600С существенно влияет на размеры макромолекулы. Определена ИЭТ сополимера, которая находится в области рН 2,0-2,5.
2. Изучено образование бинарных и тройных полимер-металлических комплексов в системах [ЭЭАКК/АК-Sr2+] и [ЭЭАКК/АК-Sr2+-ПЭГ].
Определены средние координационные числа и константы устойчивости для комплексов [сополимер]:[Sr2+]= 1:1; 2:1; 4:1; 6:1. Определен состав комплексов, равный [сополимер]:[Sr2+]= 2:1.
Обнаружено, что образование тройного полимер-металлическогоо комплекса возможно для систем [ЭЭАКК/АК-ПЭГ]: [Sr2+ ] и [ПЭГ-Sr2+]:[ЭЭАКК/АК].
3. Изучено влияние на комплекс ЭЭАКК/АК-Sr2+ =2:1 действий смешанного растворителя, ионной силы, температуры, рН. Обнаружено, что образующийся полимер-металлический комплекс устойчив к действию температуры, смешанного растворителя, ионной силы. Эти факторы способствуют компактизации полимер-металлического клубка. Выявлено, что в близи ИЭТ происходит высвобождение ионов металла вследствие сильного электростатического притяжения между противоположно заряженными участками полиамфолита.
Рецензия
на магистерскую работу Темергалиевой Кумисжан Кыдыргалиевны
на тему: “ Исследование комплексообразования в системах сополимер этилового эфира аминокротоновой кислоты / акриловой кислоты- ионы Sr2+”.
Работа магистранта Темергалиевой Кумысжан посвящена исследованию взаимодействия нового полиамфолита на основе этил 3-аминокротоната и акриловой кислоты (ЭЭАКК-АК) с ионами стронция. Полиамфолит на основе этил 3-аминокротоната и акриловой кислоты (ЭЭАКК-АК) был синтезирован реакцией присоединения Михаэля с радикальной последующей полимеризацией. Этил 3-аминокротонат (ЭЭАКК) фирмы “Aldrich”, степень чистоты 99%, использовался без дополнительной очистки.
Акриловая кислота (АК) фирмы “Aldrich”, степень чистоты 99,5%, использовалась без дополнительной очистки.
Полиамфолит на основе ЭЭАКК и АК получается реакцией радикальной полимеризации в массе, в воде, в этаноле и в смесях вода-этанол (1:1 по объему). ЭЭАКК (1,9 мл, 0,5 моль) и АК (1,1 мл, 0,5 моль) помещаются в стеклянную ампулу, добавляется инициатор –2,2-азобисизобутиронитрил (3 мг) и соответствующий растворитель (мольное отношение растворителя и мономерной смеси всегда 1:1). Через смесь пропускают аргон в течение 5 мин и затем термостатируют при 70ºС в течение 2-3 мин. Образующийся полимер промывается ацетоном несколько раз и высушивается под вакуумом до постоянного веса.
Потенциометрическое титрование линейного полиамфолита осуществлялось с помощью рН/кондуктометра “Mettler Toledo, MPC 227” (Швейцария).
Вязкость растворов полимеров измерялась в вискозиметрах Уббелоде. Использованные химические реактивы и растворители соответствовали марке “хч” и “чда”.
Данные подтверждают присутствие аминных и карбоксильных групп в полимерных цепях, что позволяет рассматривать синтезированный сополимер как новый полиамфолит.
Содержание карбоксильных и амино-групп в образце синтезированного полиамфолита определялось потенциометрическим титрованием. Состав использованного сополимера, определенный потенциометрическим титрованием кислотных и основных групп, равен [ЭЭАКК]: [АК]=22,99:77,01 моль %. Из кривой потенциометрического титрования было рассчитано значение константы диссоциации карбоксильных групп сополимера рКα=7,37.
Ранее было показано, что сополимер этил 3-аминокротоната и акриловой кислоты линейной и слабо сшитой структуры весьма склонен к реакциям комплексообразования с ионами переходных металлов. Однако, взаимодействие этого сополимера с ионами стронция не было изучено.
Для определения среднего координационного числа иона-комплексообразователя были оттитрованы растворы сополимера и соли стронция (С=1.10-2моль/л) в отношении [сополимер]: [Sr2+]=1:1; 2:1; 4:1 и 6:1 0,1 н раствором щелочи. Кривые титрования в присутствии соли расположены ниже кривой титрования чистого сополимера, что связано с выделением в раствор протонов вследствие образования комплекса полимер-ион металла. Наибольшее смещение рН наблюдается для отношения [сополимер]: [Sr2] =2:1 (рН=5,3 по сравнению с рН чистого полиамфолита рН=6,7).
Кривые образования позволяют определить среднее координационное число и константу устойчивости комплексов полимер-ион металла. Наибольшее значение Куст, как и наибольшее смещение по рН получено для соотношения [сополимер]: [Sr2]=2:1. Среднее координационное число для комплекса [сополимер]: [Sr2]=2:1 равно единице, т.е. только одна вакансия иона-комплексообразователя занята функциональной группой полимера.
Таким образом, показана возможность образования тройных полимер-металлических комплексов и комплексов полимер-ион металла для системы сополимер этилового эфира аминокротоновой кислоты/ акриловой кислоты- ионы Sr2+.
Темергалиевой Кумысжан проведена большая экспериментальная работа, полученные результаты грамотно интерпретированы. Считаю, что по постановке задачи, объему выполненной работы, полученным результатам и их интерпретации работа Темергалиевой Кумысжан на тему «Исследование комплексообразования в системах сополимер этилового эфира аминокротоновой кислоты/ акриловой кислоты-ионы Sr2+» соответствует требованиям, предъявляемым к магистерским диссертациям, а сама Темергалиева Кумысжан заслуживает присуждения академической степени магистра.
Реферат
Тема: «Исследование комплексообразования в системах сополимер этилового эфира аминокротоновой кислоты / акриловой кислоты – ионы Sr2+ стронция»
Объектом исследования является новый полиамфолит на основе этил 3-аминоктротоновой (ЭЭАКК) и акриловой кислоты (АК), синтезированный реакцией присоединения Михаэля с последующей радикальной полимеризацией.
Цель работы: исследование свойств нового полиамфолита и изучение возможности образования бинарных и тройных полимер-металлических комплексов.
Работа выполнена на кафедре химии Семипалатинского Государственного университета имени Шакарима.
В работе были использованы методы вискозиметрии и потенциометрии.
Были исследованы:
1) Гидродинамические свойства самого полиамфолита в зависимости от ионной силы, температуры, природы органического растворителя, рН-среды.
2) Возможность образования комплекса полимер-металл и стабильность его к действию различных факторов (ионная сила, температура, природа органического растворителя, рН-среды).
3) Возможность образования тройного полимер-металического комплекса в системе ЭЭАКК/АК-Sr2+-ПЭГ
Экспериментальная часть
Получение и очистка исходных веществ
Мономер : СООС2Н5
![]() Этил 3-аминокротонат (ЭЭАКК) [-СН2-СН-СН-]m
Этил 3-аминокротонат (ЭЭАКК) [-СН2-СН-СН-]m
NH2
был синтезирован реакцией присоединения Михаэля с последующей радикальной полимеризацией. Этил 3-аминокротонан (ЭЭАКК) фирмы
“Aldrich”, степень чистоты 99%, использовался без дополнительной очистки.
![]() Акриловая кислота (АК) [CH2-CH-]n
Акриловая кислота (АК) [CH2-CH-]n
COOH
фирмы “Aldrich”, степень чистоты 99,5%, использовалась без дополнительной очистки.
Полиамфолит на основе ЭЭАКК и АК получается реакцией радикальной полимеризации в массе, в воде, в этаноле и в смесях вода-этанол (1:1 по объему). ЭЭАКК (1,9 мл, 0,5 моль) и АК (1,1 мл, 0,5 моль) помещаются в стеклянную ампулу, добавляется инициатор –2,2-азобисизобутиронитрил (3 мг) и соответствующий растворитель (мольное отношение растворителя и мономерной смеси всегда 1:1). Через смесь пропускают аргон в течение 5 мин и затем термостатируют при 70ºС в течение 2-3 мин. Образующийся полимер промывается ацетоном несколько раз и высушивается под вакуумом до постоянного веса.
Динитрил азоизомасляной кислоты (ДАК) NC-C(CH3)2-N-N-C(CH3)2-CN Марки «ч» дважды перекристаллизовывали из абсолютного этанола.
Тпл= 374 К.
Полимер
Полиэтиленгликоль (ПЭГ) –(СН2-СН2-О-)- использовали полимерический оразец МW = 4*103 .Полиамфолит этиленовый эфир аминокротоновой кислоты/ акриловая кислота (ЭЭАКК/АК)
O
(CH2-C=CH-C )n (-CH2-CH-)n
NH2 OC2H5 COOH
Растворители:
Этиловый спирт (С2Н5ОН)- очищали обычной перегонкой.
Ткип. = 56,24 С0; n20g =1,3558; r20 = 0,7908.
Соль
Нитрат стронция Sr(NO3)2- марки «ч.д.а.» использовали без дополнительной очистки.
Оборудование
Весы аналитические «Весы лабораторные равноплечие ВЛР-200» 2-го класса модели, весы лабораторные технические марки «OWA LABOR» NAGEMA, шкаф сушильный электрический прямоугольный «ГП-20», вискозиметр Убеллоде, термостат «UTU-4», рН-метр «иономер ЭВ-74», секундомер CОС пр-2б-2-000 «Агат», концентрационный фотоколориметр марки «КФК-2».
Методы исследования
рН-метрическое титрование проводили при помощи иономера ЭВ-74 (точностью измерения + 0,05 ед рН) со стеклянными и хлорсеребряными электродами. Титрование проводили при температуре t-250С и постоянной силе раствора (М=0,1). Ионную силу создали раствором нитрата калия. Исходные растворы раствора нитрата стронция стандартизовали комплексонометрическим титрованием NaЭДТА по госту 10398-76 в присутствии индикатора мурексида. Значение титра КОН определили титрованием НС1, приготовленного из стандарт титра (фиксонала) в присутствии индикатора. Градуировку электродной системы осуществляли до и после каждого титрования по стандартными буферными растворами в интервале рН =1-12,5.
В стакан для титрования наливают 10 мл соответствующей соли (Sr(NO3)2). Титрование ведут 0,1 н. раствором NaOH при постоянном перемешивании из микробюретки. Измерение рН производят через каждые 0,05 мл добавленной щелочи до рН-12. Результаты отображают в виде графика, где на оси абцисс- объем прилитой щелочи. Константу устойчивости образованных комплексов рассчитывали по модифицированному методу Бьеррума. Среднее координационное число n- при определенных концентрациях металла и лиганда рассчитывается по уравнению:
n = [At]-[AH]-[A]
[Mt]
где-[At],[Mt]- общая концентрация лиганда и ионов металла;
[AH],[A]- концентрация протонированных и свободных (не вступивших в комплексообразование) лигандных групп. Концентрация свободного лиганда определяются непосредственно из калибровочного графика, построенного по данным титрования.
Вязкость растворов водных и водно-солевых растворов измеряем в капиллярных вискозиметрах Убеллоде в термостатируемой камере при 25 + 0,10С и вычисляем по формуле:
h пр = hуд / С.
где-hуд = (t-t0)/t0; t0 – время истечения чистого растворителя, t- время истечения раствора, С- концентрация полимера г/дл.
Рассчитанное количество ЭЭАКК/АК растворяют в 0,1 н. КС1, фильтруют через фильтр Шотта. Отбирают 5 мл этого раствора и наливают в ячейку вискозиметра, помещенного в термостат, где поддерживается постоянная температура. Вискозиметр представляет собой капиллярную трубку, соединенную с измерительным шариком. Вискозиметр погружен в термостат. Раствор засасывается грушей из резервуара вискозиметра в шарик выше верхней метки над измерительным шариком. Измеряется время истечения жидкости между верхней и нижней метками измерительного шарика. Вязкость каждого раствора измеряется 3-раза. Определяется время истечения раствора полимера (t) после каждого разбавления Результаты представляются графически в виде зависимости hуд / С от С.
| t0 Vисх. 5мл | t1(+0,5) | t2(+1,0) | t3(+1,5) | t4(+2,0) | С,г/дл | hуд=t/t-1 | hуд / С ,дл/г |
| 319,6 319,4 319,5 | 310,0 310,0 310,0 | 305,0 305,0 305,0 | 297,2 297,2 297,4 | 293,0 293,0 293,0 | 0,27690 0,24011 0,21850 0,18740 0,17060 | 0,06281 0,05911 0,05583 0,05289 0,05024 | 4,4085 4,0621 3,9173 3,5432 3,3954 |
Приложение-1
Определение рКaполиамфолита.
| РН | a | 1-a | Lg a 1-a | рН – lg a 1-a |
| 6,61 6,81 7,06 7,27 7,47 7,67 7,88 8,09 8,29 | 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 | 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 | -0,9452 -0,6020 -0,3679 -0,1760 0 0,1760 0,3679 0,6020 0,9452 | 7,56 7,41 7,43 7,44 7,47 7,50 7,51 7,48 7,34 |
рН – lg a
1-a
![]() -
-
7,6 -
 *
*
7,5 - *
*
7,4 - *
7,3 -
7,2 -
![]() 7,11 ||||||||| a
7,11 ||||||||| a
0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
Кривые образования комплекса ЭЭАКК/АК-Sr2+ при соотношениях [полимер]:[металл]= 1:1; 2:1; 4:1; 6:1.
![]()
n
 2 -
2 -
(4)
1,5 -
( 2)
![]()
![]() 1,0 -
1,0 -
(3)
![]() 0,5 - (1)
0,5 - (1)
![]() | | |
| | |
| | |
| | |
-6 -5 -4 -3 -2 -1 p [HA]
[H+]
Среднее координационное число комплексов полимер –Sr+2
1- [сополимер]:[Sr+2]= 1:1; 2- [сополимер]:[Sr+2]= 2:1;
3- [сополимер]:[Sr+2]= 4:1; 4- [сополимер]:[Sr+2]= 6:1;
Рисунок-9
Концентрационная зависимость приведенной вязкости сополимера в воде.
hуд/С
![]()
 24,0 -
24,0 -
*
20,0 -
*
16,0 -
12,0 - *
8,00 – *
*
![]() 4,00 - *
4,00 - *
![]()
![]() | || С, г/дл.
| || С, г/дл.
0,1 0,2 0,3
Рисунок-2
Концентрационная зависимость характеристической вязкости ЭЭАКК/АК в 0,1н. КС1.
hуд/С
28,0 ![]() -
-
24,0 -
 20,0
- *
20,0
- *
16,0 - *
12,0 - *
8,00 – *
![]() 4,00 -
4,00 -
![]()
![]() | || С, г/дл.
| || С, г/дл.
0,1 0,2 0,3
Рисунок-3
Влияние ионной силы на вязкость сополимера ЭЭАКК/АК (1) и комплекса ЭЭАКК/АК-Sr2+(2)
hуд/С
![]()
 12,0-
12,0-
10,0- *
8,0 - *

6,0 - * *
* *
4,0 – * * (2)
* * ___ ___ ___
![]() 2,0 -
(1)
2,0 -
(1)
![]()
![]() | || | | | | | m;н КС1
| || | | | | | m;н КС1
0,2 0,4 0,6 0,8 1,0 1,1 1,2 1,3
Рисунок-4
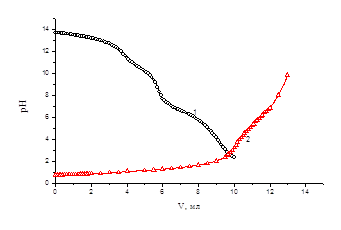
Кривая определения состава сополимера методом рН- метрического титрования

Рисунок-1
Кривые рН-метрического титрования сополимера ЭЭАКК/АК (1) в присутствии ионов Sr2+ при соотношениях [полимер]:[металл]= 1:1(2); 2:1(3); 4:1(4); 6:1(5).
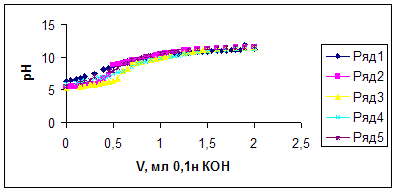
Рисунок- 8
Кривые рН-метрического титрования сополимера ЭЭАКК/АК (1) в присутствии ионов Sr2+ при соотношениях [полимер]:[металл]= 2:1(2)
 |
Зависимость вязкости сополимера ЭЭАКК/АК (1) и комплекса ЭЭАКК/АК-Sr2+ (2) от смешанного растворителя (0,1н КС1:С2Н5ОН)
h![]()
![]() уд/С h
уд/С h![]()
![]() уд/С
уд/С
![]()
 10,0 -*
10,0 -*
8,0 - *
 * *
* *
6,0-*
*
4,0 -
(2) * * __ __ __(1)
![]()
![]() 2,0 - * * *
2,0 - * * *
![]() | | |
| | |
0,1н КС1 50% об. С2Н5ОН
Рисунок-5
Зависимость вязкости сополимера ЭЭАКК/АК (1) и комплекса ЭЭАКК/АК-Sr2+ (2 ) от рН-среды
lg hуд/С
![]()
2,2 –
2,0 -

1,8 - (1)
* *
 1,6 -
* (2)
1,6 -
* (2)
*
1,4 - * *
*
1,2 - *
*
1,0 - *
* *
![]() 0,8 - *
0,8 - *
*
![]() 0,6 - *
0,6 - *
![]() 0,4 | | | | |
| | | | | рН
0,4 | | | | |
| | | | | рН
1 2 3 4 5 6 7 8 9 10
Рисунок-6
Зависимость вязкости сополимера ЭЭАКК/АК (1) и комплекса ЭЭАКК/АК-Sr2+ (2) от температуры.
hуд/С
![]()
20,0 -
16,0 -
 *
(1)
*
(1)
12,0 - *
8,0 -
![]() * * *
(2)
* * *
(2)
4,0 - *
![]() | |
| Т
| |
| Т
20 0 400 600
Рисунок-7
Кривые образования тройных полимер-металлических комплексов в системе ЭЭАКК/АК-Sr2+-ПЭГ

1- [Sr2+]/ [ПЭГ-ЭЭАКК/АК];
2 – [ЭЭАКК/АК]/[ПЭГ-Sr2+];
3 - [ПЭГ]/[Sr2+-ЭЭАКК/АК];
Рисунок –10
Похожие работы
... свойств составляющих их компонентов. Исследована эффективность первапорационного разделения смеси метанол-метилбутиловый эфир через хитозановую мембрану, модифицированную серной кислотой и четырьмя поверхностно-активными веществами. Для модифицированной серной кислотой хитозановой мембраны содержание метанола в пермеате составляет 70 вес.% при 250С. При 500С разделительный фактор снижается. ...
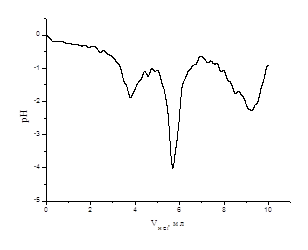
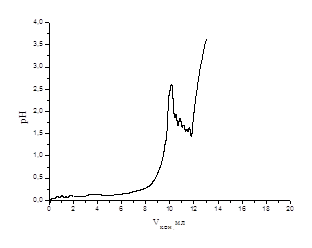
0 комментариев