Навигация
Ароматичні вуглеводні сполуки
Ароматичні вуглеводні сполуки
ВСТУП
Назва ароматичні сполуки виникла на початку 19-го ст., коли були вперше відкриті сполуки цього типу при їх виділенні із рослинних смол і бальзамів, що мали дуже приємні запахи. І хоч пізніше виявилось, що в основної більшості ароматичних сполук, навпаки, запахи неприємні, однак назва збереглася.
Ароматичні вуглеводні (арени) – це циклічні сполуки бензенового ряду, що мають специфічну властивість – ароматичність, яка зумовлює спільні ознаки в їх будові та реакційній здатності.
Структурним родоначальником аренів є бензен.
1 АРОМАТИЧНІСТЬ. БУДОВА МОЛЕКУЛИ БЕНЗЕНУ
Поняття ароматичність об¢єднує сукупність певних ознак, які визначаються за правилом Хюккеля:
Ароматичною називається замкнута система, що має плоский циклічний s–скелет і 4n+2 узагальнених p–електрони, де n = =1,2,3,…
Структура молекули бензену С6Н6 ідеально відповідає правилу ароматичності Хюккеля, оскільки в ній всі шість атомів С перебувають у стані sp2-гібридизації. Внаслідок цього осі трьох sp2-гібридизованих одноелектронних орбіталей знаходяться на одній площині під кутом 1200, а вісь четвертої, негібридизованої, рz-орбіталі розміщується перпендикулярно до них (рис. 13б). Кожний атом карбону утворює за рахунок гібридизованих орбіталей три s-зв¢язки: два – із сусідніми атомами карбону, а третій – при перекриванні зі сферичною s-орбіталлю атома гідрогену (рис. 13а). Отже, усі s-зв¢язки в молекулі С6Н6 копланарні, тобто лежать на одній площині. Таким чином, шість атомів С без напруження замикаються за допомогою s-зв¢язків у правильний шестикутник – так званий s-скелет молекули.
Шість негібридизованих рz-орбіталей, які розміщуються перпендикулярно до s-скелета і паралельно одна до одної, взаємно перекриваються, утворюючи єдину делокалізовану p-електронну хмару, тобто виникає колове спряження (рис.3в). Найбільша електронна густина в цій спряженій системі розміщується над і під площиною s-скелета молекули і охоплює всі шість атомів С у циклі. Завдяки коловому спряженню всі зв¢язки між атомами карбону вирівнюються, вони мають однакову довжину (0,139нм), яка є проміжною між довжиною подвійного зв¢язку в алкенах (0,133нм) і одинарного в алканах (0,154нм). Вирівнювання зв¢язків С–С у бензені графічно зображується правильним колом всередині правильного шестикутника
Колове спряження та вирівнювання довжини зв¢язків приводить до того, що зв¢язки у бензені не можуть вважатися одинарними чи подвійними. На основі точних фізико-хімічних методів дослідження встановлено, що насправді кратність зв¢язків С–С у молекулі бензену становить 1,67.

Рисунок 3 – Будова молекули бензену: а) s-скелет молекули; б) розташування негібридизованих pz-орбіталей перпендикулярно до площини σ-зв’язків; в) утворення колового спряження
Колове спряження дає виграш в енергії 150,7 кДж/моль. Нагадаємо, що енергетичний виграш за рахунок утворення спряженої системи називається енергією спряження, або енергією делокалізації, і дорівнює енергії, яку необхідно витратити для руйнування ароматичної системи.
Електронна будова і ароматичність бензену зумовлює його властивості, у тому числі високу термічну стійкість (він не розкладається навіть при нагріванні до 9000С), відсутність схильності до реакцій приєднання (незважаючи на велику ненасиченість), оскільки реакції приєднання супроводжуються порушенням ароматичності, а це енергетично невигідно.
2. КЛАСИФІКАЦІЯ. НОМЕНКЛАТУРА
За кількістю бензенових кілець арени поділяються на дві групи.
1Моноядерні арени – це бензен та його гомологи, в яких один чи декілька атомів гідрогену заміщені на аліфатичні бокові ланцюги (насичені чи ненасичені). Назви моноядерних аренів утворюються від родоначальної структури – бензену (стара назва бензену, яка трапляється досить часто, – бензол) із зазначенням природи замісників та їх положення. Для багатьох гомологів бензену вживають тривіальні назви, які набули настільки широкого розповсюдження, що їх було введено у правила номенклатури IUPAC. Якщо бензенове кільце містить два радикали, то залежно від їх взаємного розташування використовуються додаткові префікси: орто- (1,2-положення), мета- (1,3-положення) і пара- (1,4-положення). Приклади моноядерних аренів:

Бензен Толуол Кумол

n-Ксилол м-Цимол Етилбензен
(1,4-диметилбензен) (3-ізопропілметилбензен)
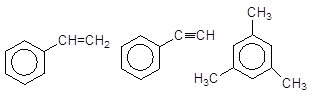 Стирен Фенілацетилен Мезитилен
Стирен Фенілацетилен Мезитилен
Дуже часто для називання складних сполук необхідно знати назви ароматичних радикалів – арилів, які умовно позначаються спільним символом Ar:
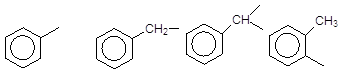
(С6Н5-) (С6Н5-СН2-) (С6Н5-СН=) (о-СH3-С6Н4-)
Феніл Бензил Бензиліден о-Толіл
2Поліядерні арени, які складаються з декількох бензенових ядер. Вони, у свою чергу, поділяються на конденсовані та неконденсовані, або ізольовані.
Назви неконденсованих (ізольованих) поліаренів утворюються згідно із замісниковим і радикально-функціональним способами IUPAC:
![]()
Дифеніл Дифенілметан м-Фенілтолуол
Для конденсованих поліядерних аренів вживаються такі назви:

Нафталін Антрацен Фенантрен
У монозаміщених похідних нафталіну однотипні атоми карбону позначаються грецькими буквами a і b, у дизаміщених – цифрами від 1 до 8, при цьому атоми С, спільні для обох циклів, не нумеруються. В неконденсованих поліядерних аренах одне кільце нумерується цифрами без штрихів, а всі інші – із штрихами, наприклад:

b-Метилнафталін 1,5-Диметилнафталін

3¢¢ - Метилтрифенілметан
ІЗОМЕРІЯ МОНОЯДЕРНИХ АРЕНІВ
Ізомерія монозаміщених моноядерних аренів зумовлена будовою замісника, наприклад:

Пропілбензен Ізопропілбензен
У ди- і багатозаміщених гомологів бензену виникає ще один вид ізомерії, зумовлений різним положенням замісників:
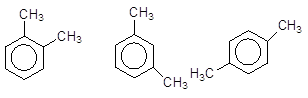
орто-Ксилол мета-Ксилол nара-Ксилол
ФІЗИЧНІ ВЛАСТИВОСТІ
Моноядерні арени – безбарвні леткі рідини з густинами 0,8-0,9г/мл, нерозчинні у воді, але добре розчинні у малополярних розчинниках.
Самі вони також є добрими розчинниками. Температури кипіння гомологів бензену зростають із підвищенням молекулярної маси: кожна нова метиленова група –СН2– збільшує температуру кипіння у середньому на 20-300. Всі арени мають характерні запахи, деякі (толуол) виявляють помітну наркотичну дію.
Бензен і більшість конденсованих поліаренів належать до високотоксичних речовин. Вдихання їх парів викликає головний біль, а при високих концентраціях – отруєння. Пари бензену вражають слизисту оболонку ока. А рідкий бензен може проникати через шкіру. Для нього характерна кумулятивність, тобто виявлення токсичної дії при поступовому накопиченні в організмі.
Поліядерні арени – білі тверді речовини, майже без запаху, слизькі на дотик, нерозчинні у воді.
ХІМІЧНІ ВЛАСТИВОСТІ БЕНЗЕНУ
Незважаючи на велику ненасиченість аренів, для них не характерні реакції приєднання. Більш того, ненасиченість бензену не відкривається за допомогою звичайних якісних реакцій: він не знебарвлює ні бромну воду, ні розчин KMnO4.
Хімічні властивості аренів зумовлюються у першу чергу наявністю спряженої системи і високою енергією делокалізації, тому бензен і його гомологи вступають переважно в такі реакції, при яких зберігається їх ароматичність.
І Реакції електрофільного заміщення SE
Механізм реакцій електрофільного заміщення за участю аренів складається з декількох послідовних стадій.
1 Генерування електрофільної частинки у відповідних умовах під впливом каталізатора, який сприяє спочатку поляризації, а потім і розриву зв¢язків у молекулі реагенту:
Поляризація
молекули d+ d– Розрив зв¢язку
Е – А –––––––––––––à E – A –––––––––––––––à E+ + A-.
Каталізатор
2 Утворення p-комплексу. Початкова атака електрофілом Е+ p-електронної хмари бензенового кільця проходить швидко і без порушення ароматичності системи:
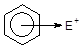
![]() Швидко
Швидко
+ Е+ ––––––––––à
ß–––––––––
p-Комплекс
3 Утворення s-комплексу – повільна стадія, під час якої електрофіл Е+ утворює s-зв¢язок з одним із атомів карбону за рахунок двох p-електронів, які вилучаються із спряженої системи. При цьому атом карбону переходить із sp2- у sp3-гібридизований стан, ароматичність системи порушується, тому що у кільці залишаються тільки чотири p-електрони, які розподіляються на п¢ять sp2-гібридизованих атомів карбону. Молекула перетворюється в s-комплекс – карбкатіон, точніше – аренонієвий катіон:

![]() Повільно
Повільно
–––––––à sp3-Гібридизований атом карбону
p-Комплекс s-Комплекс (аренонієвий катіон)
4 Повернення ароматичності. Оскільки втрата ароматичності енергетично невигідна, система прагне повернути її найпростішим шляхом, а саме – відщепленням протону Н+ від s-комплексу. Внаслідок цього два електрони, що утворювали зв¢язок С-Н, приєднуються до тих чотирьох p-електронів, які залишалися в s-комплексі. Тому замкнута шестиелектронна система поновлюється і молекула переходить в ароматичний стан:

 Швидко
Швидко
–––––––––à + H+.
s-Комплекс Продукт Протон
5 Утворення побічного продукту. Відщеплений протон взаємодіє з негативно зарядженим аніоном А-, що утворився при розриві зв¢язків у молекулі реагенту на перший стадії:
Н+ + А- –––––––à HA.
Побічний продукт
У загальному вигляді механізм реакції електрофільного заміщення в аренах можна зобразити схемою
 + Е+ Û –––à
+ Е+ Û –––à
Субстрат Електрофіл p-Комплекс
 –H+
–H+
–––> –––––––>
s-Комплекс Продукт
Розглянемо найважливіші реакції електрофільного заміщення SE.
1 Галогенування бензену проходить тільки за наявності каталізаторів – так званих кислот Льюїса (речовин, здатних зв¢язувати вільну електронну пару): AlCl3, FeCl3, AlBr3, FeBr3, SnCl4, TiCl4, BF3. Практичного значення набули реакції хлорування та бромування, тому що реакція з хімічно активним F2 проходить деструктивно, а з І2 – дає надзвичайно малий вихід завдяки низькій реакційній здатності йоду.

80оC
+ Br2 –––––à + HBr,
AlВr3
Бромбензен
![]()
25оC
+ Cl2 ––––––––à + HCl.
AlCl3
2 Нітрування. Бензен реагує дуже повільно навіть з концентрованою HNO3 при нагріванні, але при дії на нього нітрувальною сумішшю (суміш концентрованих HNO3 i H2SO4) досить легко перетворюється на нітропохідні.
Електрофільною частинкою є нітроїл-катіон NO2+, який утворюється під впливом сірчаної кислоти:
HO-NO2(к) + 2H2SO4 (к) Û 2HSO4- + H3O+ + NO2+,

![]() 50оС
50оС
+ HO-NO2(к) --------à + H2O.
H2SO4 (к)
Бензен Нітробензен
Похожие работы
... плавить сталь. З ацетилену добувають вихідні речовини для виготовлення пластмас і синтетичних каучуків, він є сировиною для синтезу оцтової кислоти. -2- 1. Ароматизовані вуглеводні – органічні сполуки, що містять у своєму складі бензольні ядра , у яких можуть бути насичені або ненасичені бічні ланцюги. Загальна формула ...
... дношення в них окремих компонентів залежать від властивостей і складу робочої суміші, яка спалюється, а також від ступеня закінченості реакції горіння. Утворення шкідливих речовин багатостадійне і проходить наступним чином: альдегіди, оксид вуглецю, вуглеводні, сажа, канцерогенні речовини - з`являються внаслідок неповного окислення палива та його піролізу, а також синтезу нових речовин; оксиди ...
... розрахункових задач слід використовувати аналітико-синтетичний шлях, тобто той шлях, який використовують самі учні. Спираючись на дані аналізу методичної літератури, свої спостереження за учнями процес розв’язування розрахункових задач ми представили як ряд взаємних етапів. Перший етап: уважно прочитати текст задачі. Якщо текст задачі сформульований автором задачника не зовсім зрозумілий, можна ...
... , відсутнього в природі, - його роль у процесі нафтоутворення грають звичайні глини, глинисті вапняки й інші породи, що містять глинисті мінерали. Мета роботи полягає в проведенні аналізу літературних джерел щодо складу та первинної переробки нафти. Завдання роботи: 1) проаналізувати склад нафти; 2) розглянути основні властивості нафти; 3) проаналізувати основні особливості первинної ...

0 комментариев