Навигация
1.3. Физические свойства.
Название: основный карбонат меди, малахит, медная зелень, малахитовая зелень, плисовый малахит, атласная руда, павлиний камень, (CuOH)2CO3 - довольно хрупкий минерал.
Цвет: варьирует от сочного темно-зеленого до светлого бирюзово-.зеленого. Непрозрачен, в мелких кристаллах просвечивает. В плотных почковидных агрегатах окраска обычно распределяется ритмично, с чередованием темных и светлых зон. Тонкоигольчатый (плисовый) и порошковатый агрегаты окрашены равномерно.Более или менее одноцветные куски встречаются редко.
Твердость 3,5 – 4 по минералогической шкале;
удельный вес 3,9 - 4, г;
плотность 3,75 - 3,95 1 г/см;
Излом: раковистый.
Хрупкость: да
Блеск: матовый, бархатистый, у плисового - шелковистый. Плотные лучистые агрегаты имеют красивый шелковистый блеск. Необработанному малахиту присущ слабый стеклянный блеск, но на свежем изломе и в прожилках блеск у него часто шелковистый[7]
Сингония: моноклинная.
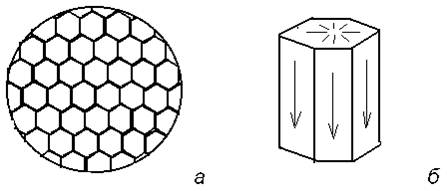
Вид кристалла: призматический, пластинчатый, игольчатый. Кристаллы имеют тенденцию к расщепленю с образованием сферокристаллов, тонковолокнистых сферолитов, сфероидолитовых дендритов[10]. Кристаллы отмечаются редко, обычно призматические с гранями (100), (110), (010), (201). Развиты двойники по (100). Чаще всего наблюдается в виде корочек, сферокристаллов, натечных почковидных агрегатов радиально-лучистого, параллельно-шестоватого и зонально-концентрического строения.
В кристаллической структуре малахита добавочные анионы (OH)1- связаны с ионами Cu2+, которые окружены в одной плоскости двумя ионами (OH)1- и двумя O2+, принадлежащими карбонат-аниону (СОз)2-.
Примеси: известны Zn (замещает изоморфно Cu), а также CaO, SiO2, Fe2Oз и другие.
1.4. Химические свойства .
Состав малахита отвечает формуле Cu2H2CO5. Всесторонние исследование привели к более содержательной формуле: Сu2 (ОН)2(СО3). С учетом современных знаний о составе ионных кристаллов мы можем записать формулу малахита:
[CuOH]22+CO32Состав малахита различные авторы выражают идентично (имея в виду ионный состав кристалла):
(CuOH)2CO3![]() Cu2(CO3)(OH)2
Cu2(CO3)(OH)2![]() Cu2((OH)2CO3)
Cu2((OH)2CO3) ![]()
CuCO3∙Cu(OH)2![]() Cu2CO3(OH)2
Cu2CO3(OH)2![]() Cu2(OH)2CO3.
Cu2(OH)2CO3.
У Н.С.Ахметова – СuСО3•3Сu(ОН)2, у Д.И.Менделеева – СuO2H2CuCO3.
Если иметь в виду кристаллическую структуру малахита, состав ионного кристалла наиболее полно и наиболее содержательно отражает такая запись:
[Cu22+(OH-)2CO32-]
С учетом электронно-ионных представлений формулу малахита можно представить таким образом:
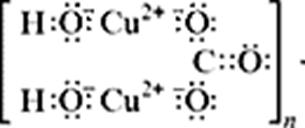
На схеме мы четко видим, что малахит – основный карбонат меди(II) (когда-то он так и назывался – основная углекислая медь). Данная запись отражает ионные взаимодействия.
В реальном кристалле имеют место другие типы взаимодействий – водородная связь между гидроксильными ионами и донорно-акцепторное взаимодействие между ионом меди и кислородом гидроксила:
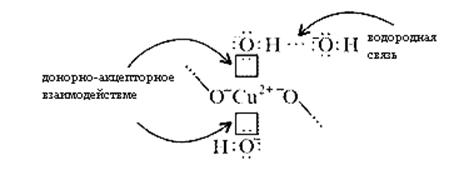
За счет этого достигается и плотная упаковка, и достаточно высокая механическая прочность, и небольшая твердость.
На уровне ионно-структурных представлений химическое строение малахита (для структурных частиц – химическое строение, для твердого тела – строение ионного кристалла) можно отразить следующим образом:
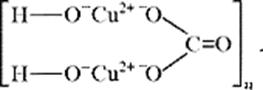
Следовательно, запись (CuOH)2CO3 – основная соль, дигидроксикарбонат меди(II) – наиболее полно отражает состав малахита.
Рассмотрим реакцию разложения малахита:
(CuOH)2CO3 →2CuO +H2O + CO2
В зависимости от этапа изучения химии она может быть описана:
а)

б) на ионно-структурном уровне:
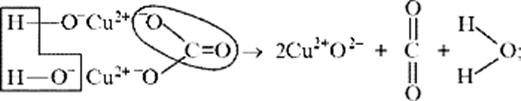
в) на электронно-ионном уровне:
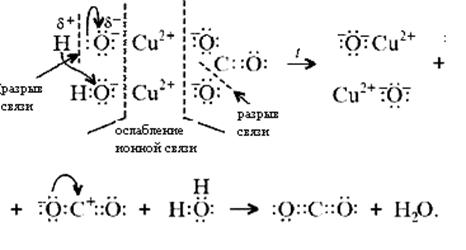
Знание свойств карбонатов и нерастворимых в воде оснований позволяет утверждать, что малахит будет растворяться в кислотах:
Примечание. Ион Н+ присоединяется к кислороду в составе гидроксид- и карбонат-ионов по донорно-акцепторному механизму:

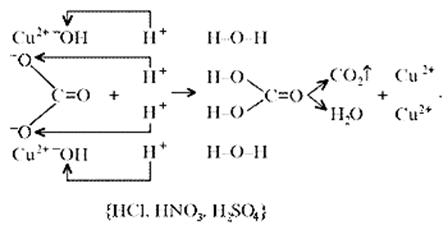
Малахит можно рассматривать как производное гидроксида меди(II), в котором часть гидроксильных ионов замещена на карбонат-ионы (таково, собственно, определение понятия «основная соль»). Кроме реакции с кислотами при определенных условиях он может реагировать с кислотными оксидами. Мысль совершенно невероятная, учитывая нерастворимость малахита в воде – главнейшее условие взаимодействия кислотных оксидов с основаниями, точнее со щелочами. Однако имеет место реакция:
(CuOH)2CO3 + CO2 = CuCO3)2 + Н2О
«Химические события» соответствуют такому механизму:
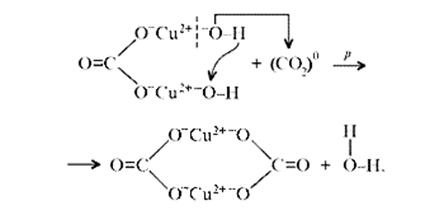
Обратим внимание на образование средней соли. Теперь считается доказанным, что карбонат меди(II) можно помещать в список солей угольной кислоты.[11]
Малахит, как известно, не растворяется в воде, но может подвергаться гидролизу (из-за гидролиза, собственно, невозможно получить осадок среднего карбоната меди):

Из-за способности ионов меди образовывать комплексные ионы малахит растворяется, в частности, в карбонатах щелочных металлов:
(CuOH)2CO3 + K2CO3 = K2[Cu(CO3)2] + Cu(OH)2.
темно-синий
Теоретическим обоснованием этому может служить запись:
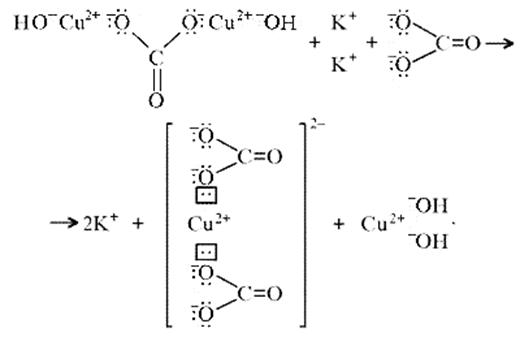
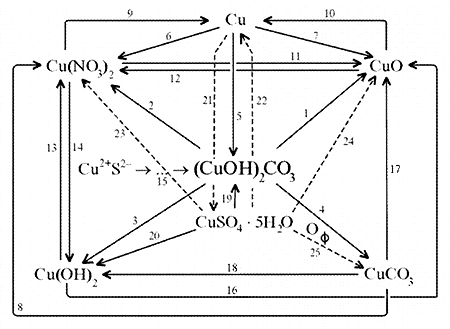
Схема генетических связей: образование и свойства малахита.
|
|
1. Разложение малахита.
2. Растворение малахита в кислотах.
3. Гидролиз малахита.
4. Реакция с углекислым газом.
5. Коррозия меди на воздухе (образование зеленого налета на медных предметах во влажном воздухе):
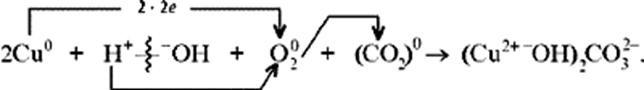
6. Растворение меди в азотной кислоте.
7. Прокаливание меди на воздухе.
8. Взаимодействие твердого тела карбоната меди(II) c крепким раствором азотной кислоты.
9. Восстановление меди из ее соли более активным металлом или в результате электролиза.
10. Восстановление меди из ее оксида водородом или другим удобным восстановителем (монооксид углерода, древесный уголь).
11. Нагревание твердого тела нитрата меди(II) до полного разложения.
12. Растворение оксида CuO в концентрированной азотной кислоте.
13. Нейтрализация основания Cu(OH)2 азотной кислотой.
14. Взаимодействие нитрата меди(II) с раствором щелочи.
15. Образование малахита в природных условиях. В самых общих чертах генезис сложных геохимических процессов можно представить так:

16. Нагревание твердого вещества Cu(ОН)2 (несильно, чтобы не перевести оксид CuO в оксид Cu2O) до полного разложения.
17. Нагревание CuCO3 до полного разложения на CuO и СО2.
18. Гидролиз карбоната меди(II).
19. Получение порошкообразного малахита в лабораторных условиях. Формально химизм образования дисперсного малахита можно выразить следующими уравнениями:
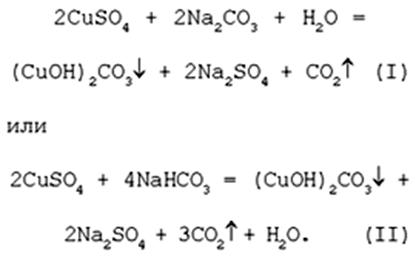
Однако это именно тот случай, когда «гладко пишутся бумаги, а кругом одни овраги».
Химизм образования малахита, если рассматривать его по стадиям, не может быть однозначно представленным, здесь допускается вариативность мышления.
Последовательность превращений для уравнения (I):
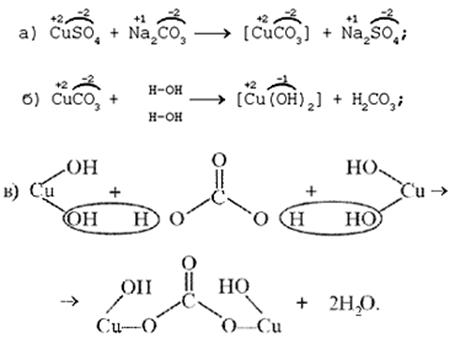
Последовательность ионных превращений для уравнения (II):

Этим и объясняется слоистая структура минерала. Концентрация ионов (СuОН)+, (FеОН)+, (ZnОН)+, Са2+, СО32-, РО43- при совместном присутствии в растворах минералов непостоянная. Поэтому испарение воды ведет к образованию своеобразного рисунка и различной величины кристаллов.
20. Взаимодействие сульфата меди(II) со щелочью аналогично п. 14.
21. Медную стружку обрабатывают концентрированной серной кислотой при несильном нагревании. Образовавшийся раствор упаривают до начала кристаллизации.
22. Восстановление меди из сульфата меди(II) аналогично п. 9.
23.К раствору сульфата меди(II), который образуется при растворении в воде медного купороса, приливают раствор нитрата бария.
Над образующимся осадком сульфата бария будет находиться раствор нитрата меди, который можно или декантировать, или отделить фильтрованием.
24. Если прогревать медный купорос в фарфоровой чашке, то постепенно будет происходить не только обезвоживание кристаллогидрата, но и разложение сульфата до оксида меди, сернистого газа и кислорода.
25. Знак ![]() (пустое множество) обозначает, что данную реакцию осуществить невозможно.
(пустое множество) обозначает, что данную реакцию осуществить невозможно.
Механизм образования малахита в близком к истине приближении видится таким (исходные и включающиеся в процесс вещества взяты в рамки):

Образование малахита из азурита поддается объяснению, если учесть, что нерастворимые ионные кристаллы не абсолютно нерастворимы:
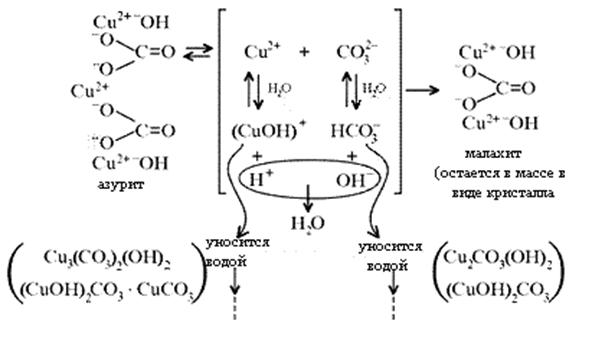 [8]
[8]
1. 5. Искусственный малахит.
Существует несколько способов получения искусственных минералов. Один из них – это создание композитных материалов спеканием порошка природного минерала в присутствии инертного связующего при высоком давлении. При этом происходит много процессов, из которых главные – это уплотнение и перекристаллизация вещества. Этот метод получил широкое распространение в США для получения искусственной бирюзы. Так же были получены жадеит, лазурит, другие полудрагоценные камни. В нашей стране композиты получали цементированием мелких обломков природного малахита размером от 2 до 5 мм с помощью органических отвердителей (наподобие эпоксидных смол) с добавлением в них красителей соответствующего цвета и тонкого порошка того же минерала в качестве наполнителя. Рабочую массу, составленную из указанных компонентов в определенном процентном отношении, подвергали сжатию при давлениях до 1 ГПа (10000 атм.) при одновременном нагревании свыше 100° С. В результате различных физических и химических процессов происходило прочное цементирование всех компонентов в сплошную массу, которая хорошо полируется. За один рабочий цикл таким образом получают четыре пластинки со стороной 50 мм и толщиной 7 мм. Правда, их довольно легко отличить от природного малахита.
Другой возможный способ – гидротермальный синтез, т.е. получение кристаллических неорганических соединений в условиях, моделирующих процессы образования минералов в земных недрах. Он основан на способности воды растворять при высоких температурах (до 500° С) и давлениях до 3000 атм. вещества, которые в обычных условиях практически нерастворимы – оксиды, силикаты, сульфиды. Ежегодно этим способом получают сотни тонн рубинов и сапфиров, с успехом синтезируют кварц и его разновидности, например, аметист. Именно этим способом был получен малахит, почти не отличающийся от природного. При этом кристаллизацию ведут в более мягких условиях – из слабощелочных растворов при температуре около 180°С и атмосферном давлении[5].
Сложность получения малахита в том, что для этого минерала главное – не химическая чистота и прозрачность, важная для таких камней как алмаз или изумруд, а его цветовые оттенки и текстура – неповторимый рисунок на поверхности отполированного образца. Эти свойства камня определяются размером, формой, и взаимной ориентацией отдельных кристалликов, из которых он состоит. Одна малахитовая «почка» образована серией концентрических слоев разной толщины – от долей миллиметра до 1,5 см разных оттенков зеленого цвета. Каждый слой состоит из множества радиальных волокон («иголочек»), плотно прилегающих друг к другу и подчас неразличимых простым глазом. От толщины волокон зависит интенсивность цвета. Например, тонкокристаллический малахит заметно светлее крупнокристаллического, поэтому внешний вид малахита, как природного, так и искусственного, зависит от скорости зарождения новых центров кристаллизации в процессе его образования. Регулировать такие процессы очень трудно; именно поэтому этот минерал долго не поддавался синтезу.
Получить искусственный малахит, не уступающий природному, удалось трем группам российских исследователей – в Научно-исследовательском институте синтеза минерального сырья (город Александров Владимирской области), в Институте экспериментальной минералогии Российской Академии наук (Черноголовка Московской области) и в Петербургском государственном университете. Соответственно было разработано несколько методов синтеза малахита, позволяющих получить в искусственных условиях практически все текстурные разновидности, характерные для природного камня – полосчатые, плисовые, почковидные. Отличить искусственный малахит от природного можно было разве что методами химического анализа: в искусственном малахите не было примесей цинка, железа, кальция, фосфора, характерных для природного камня. Разработка методов искусственного получения малахита считается одним из наиболее существенных достижений в области синтеза природных аналогов драгоценных и поделочных камней. Так, в музее упомянутого института в Александрове стоит большая ваза, изготовленная из синтезированного здесь же малахита. По всем своим свойствам синтетический малахит способен заменить природный камень в ювелирном и камнерезном деле. Его можно использовать для облицовки архитектурных деталей как внутри, так и снаружи зданий.
Искусственный малахит с красивым тонкослоистым рисунком производится также в Канаде, в ряде других стран.
II. Практическая часть. 2.1. Получение малахита.
Получение малахита по приведенному ниже методу является наиболее простым и удобным. Преимущество заключается в том, что эксперимент не требует много времени, используются доступные реагенты, причем в небольшом количестве, а так же обеспечивается высокий процент практического выхода.
Для получения малахита (Cu2(OH)2CO3) необходимо:
1)Реактивы:
NaHCO3 – 4,065 г.
CuSO4·5H2O – 5,5 г.
2) Приборы:
Фарфоровая ступка с пестиком – 1, термический стакан – 250 мл, штатив, стеклянная палочка – 2, воронка Бюхнера – 1, колба Бунзана – 1, фильтровальная бумага, пробирка, горелка.
Ход работы.
В фарфоровой ступке смешали 5,5 г. тонко стёртой сухой соли CuSO4 ·5H2O с гидрокарбонатом натрия 4,065 г.
В стакане нагрели до кипения 100 мл. воды. Смесь высыпали небольшими порциями в кипящую воду, быстро перемешивая. При этом наблюдается вспенивание. Следующую порцию смеси вносили после прекращения вспенивания. Содержимое стакана кипятили 10-15 мин для удаления из раствора СО2. В результате реакции образуется гидроксокарбонат меди:
2CuSO4 + 4NaHCO3 = CuCО3·Cu(OH)2↓ + 2Na2SO4+3CO2↑ + H2O. (*)
Осадку давали отстояться, затем промывали декантацией горячей водой, отмывая от иона SO42-; делали пробу на полноту промывания (4 раза). Основную соль сушили между листьями фильтровальной бумаги, а затем высушивали в сушильном шкафу при температуре около 40-60°С.
Расчёт и материальный баланс.
Массы исходных веществ:
m (NaHCO3)=4,065г
m (CuSO4*5Н2О)=5,5г
Вычислим их количество:
![]() (NaHCO3) = 4,065/84=0,048 моль
(NaHCO3) = 4,065/84=0,048 моль
![]() (CuSO4*5Н2О) =5,5/249=0,024 моль
(CuSO4*5Н2О) =5,5/249=0,024 моль
По уравнению (*) найдем количество малахита:
![]() (малахита) =0,011 моль
(малахита) =0,011 моль
mтеор (малахита) =0,011 * 222=2,442 г
Рассчитаем практический выход продукта:
mпракт (малахита)пр=2,21 г
![]()
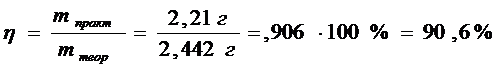
В результате мною было получено 2,21г малахита. Практический выход составил 90,6%
Проведем качественные реакции на обнаружение иона меди Cu2+ . Для этого насыпем малахит в три пробирки:
В первую пробирку добавим избыток раствора карбоната натрия, наблюдаем появление красивой синей окраски раствора:
Cu2(OH)2CO3 + Na2CO3 = Na2[Cu(CO3)2] + Cu(OH)2↓.
Во вторую прильем уксусную кислоту:
(CuOН)2CO3+ 4CH3СООН = 2Cu(CH3COO)2+ CO2↑ + ЗH2O.
К третьей добавим аммиак, который окрашивает при этом раствор в красивый темно-синий цвет:
Cu2(OH)2CO3 + 8NH3 = [Cu(NH3)4]CO3 + [Cu(NH3)4](OH)2.
К четвертой пробирке прильем концентрированный раствор HCl. Окраска станет ярко-зеленой:
Сu2(ОН)2СО3 + 2HCl = 2CuCl2 + CO2↑ + H2O.
Пятую пробирку нагреем над пламенем горелки. Наблюдаем выделение газа и образование черного осадка:
Сu2(ОН)2СО3=2CuO↓ + CO2↑+ H2O.
2. 2. Вывод.
При выполнении практической части я сократила количество используемых веществ в 2 раза по сравнению с методикой получения, так как в лаборатории находится малое количество данных реагентов. В результате опыта мной было получено 2,21г порошкообразного малахита. Практически выход продукта составил 90,6% от теоретического, что удовлетворяет поставленной цели. Потери вещества произошли во время промывания а также при высушивании на фильтровальной бумаге.
Список литературыМалахит. БСЭ, т. 15, с. 276;
Ферсман А.Е. "Рассказы о самоцветах" Л., Детгиз, 1952.
Марченков В.И. Ювелирное дело. М.: Высшая школа, 1975, с. 37; М., 1982;
Здорик Т.Б., Фельдман Л.Г. Минералы и горные породы, т. 1. М, «ABF», 1998 г.;
Степин Б.Д., Аликберова Л.Ю. Книга по химии для домашнего чтения. М., Химия, 1994.;
Г.Смит. Драгоценные камни. М., «Мир», 1980;
http://www.velund.ru/2008/04/15/malakhit.html физ свва
http://him.1september.ru/articlef.php?ID=200300705
Карякин Ю.В., Ангелов И.И. «Чистые химические вещества», Издательство «Химия», Москва, 1974 г.;
Реми Г. «Курс неорганической химии» том 1. Издательство «Химия», Москва 1967 г.;
Подчайнова В.Н., Медь, М., Свердловск: Металургиздат, 1991. – 24
Похожие работы
... происходят небольшие колебания. В данном периоде колебания произошли из-за того, что один сотрудник уходил в отпуск, и один сотрудник брал больничный. 2.2 Синтетический и аналитический учет затрат труда и его оплаты на предприятии ООО «Малахит» В практической части данной курсовой работы мы проведем расчет затрат труда и его оплаты сотрудников предприятия ООО «Малахит» за январь и февраль ...
ивнесение в "истинную" йогу некоторых пищевых запретов индуизма. В действительности, в классических текстах по йоге (Йога сутра Патанджали) ничего не сказано о каких-либо пищевых запретах, поскольку ничего религиозного в Йоге, отродясь, не было. Но, как говорится, "свято место пусто не бывает"! Очень быстро его "заполнили" вначале индуистские пищевые ограничения (отсюда представление о сугубо ...
... наук (Черноголовка Московской области) и в Петербургском государственном университете. Соответственно было разработано несколько методов синтеза малахита, позволяющих получить в искусственных условиях практически все текстурные разновидности, характерные для природного камня – полосчатые, плисовые, почковидные. Отличить искусственный малахит от природного можно было разве что методами химического ...
... к началу XIX века было могучим учреждением, которое контролировало работу свыше 150 заводов Урала. Здание Главного горного правления, построенное в 1736 году, было реконструировано архитектором М.П. Малаховым. Он составил проект, который был осуществлен в 1833 – 1835 годах. Внутренняя планировочная архитектура изменилась незначительно, однако был существенно увеличен объем за счет надстройки ...

0 комментариев