Навигация
Реакция разложения бертолетовой соли
3. Реакция разложения бертолетовой соли

Энтальпии образования известны примерно для 4000 веществ в различных агрегатных состояниях. Это позволяет чисто расчетным путем установить энергетические эффекты самых разнообразных процессов.
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц относительно друг друга.
Частицам (атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное.
Так, если, например, баллон с газом соединить с сосудом, то газ из баллона будет распределяться по всему объему сосуда. При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком).
Количественной мерой беспорядка является энтропия S.
Или другими словами: энтропия – мера неупорядоченности системы. Ее представляют как логарифмическое выражение вероятности существования вещества или различных его форм:
![]() ,
,
где S – энтропия, ![]() - коэффициент пропорциональности (к – постоянная Больцмана), W – термодинамическая вероятность существования вещества или какой-либо его формы, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
- коэффициент пропорциональности (к – постоянная Больцмана), W – термодинамическая вероятность существования вещества или какой-либо его формы, т.е. число возможных микросостояний, соответствующих данному макросостоянию вещества.
При переходе системы из более упорядоченного состояния в менее упорядоченное энтропия возрастает (DS > 0). Чтобы оценить изменение энтропии при переходе из состояния 1 в состояние 2 необходимо, как обычно, из величины какого-либо свойства, характеризующего конечное состояние, вычесть величину того же свойства, характеризующего начальное состояние:
![]()
II закон термодинамики: в изолированных системах энтропия самопроизвольно протекающего процесса возрастает, т.е. DS > 0.
Переход же системы из менее упорядоченного состояния в более упорядоченное связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере невероятно, чтобы газ самостоятельно собрался в баллоне.
В случае перехода системы из менее упорядоченного состояния в более упорядоченное энтропия системы уменьшается (DS < 0).
Нетрудно понять, что энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества, при расширении газов и т.д. Во всех этих случаях наблюдается уменьшение порядка в относительном расположении частиц. Наоборот, в процессах конденсации, кристаллизации веществ энтропия уменьшается.
Вероятность существования различных соединений вещества (газ, кристаллическое, жидкое) можно описать как некоторое свойство и количественно выразить значением энтропии S. [Энтропия может измеряться в энтропийных единицах 1 э.е. = 1 кал/(моль×град.) = 4,1868 Дж/моль×град.] Энтропии веществ, как и энтальпии их образования, принято относить к определенным условиям. Обычно это стандартные условия. Энтропию в этом случае обозначают ![]() и называют стандартной.
и называют стандартной.
В соответствии со степенью беспорядка энтропия вещества в газовом состоянии значительно выше, чем в жидком, а тем более – в кристаллическом. Например, ![]()
При данном агрегатном состоянии энтропия тем значительнее, чем больше атомов в молекуле. Например,
![]() ;
;
![]()
![]()
Чем больше твердость вещества, тем меньше его энтропия. Энтропия возрастает с увеличением степени дисперсности частиц вещества.
Для химических реакций в целом
![]()
изменение энтропии будет
![]() .
.
Об изменении энтропии в химической реакции можно судить по изменению объема в ходе реакции:
![]() ,
, ![]() и
и ![]() ;
;
![]()
![]() и
и ![]() .
.
Если в реакции участвуют только твердые и образуются только твердые вещества или число молей газообразного вещества не изменяется, то изменение энтропии в ходе ее очень незначительно.
В стандартных условиях энтропия простого вещества не равна нулю.
III закон термодинамики: энтропия чистых веществ, существующих в виде идеальных кристаллов при температуре 0 К, равна нулю.
Стремление системы к возрастанию энтропии называют энтропийным фактором. Этот фактор тем больше, чем выше температура. Количественно энтропийный фактор оценивается произведением Т·![]() .
.
Стремление системы к понижению потенциальной энергии называют энтальпийным фактором. Количественно эта тенденция системы выражается через тепловой эффект процесса, то есть значением ![]() .
.
Самопроизвольно, то есть без затраты работы извне, система может переходить из менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют две тенденции: стремление частиц объединиться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединяться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов – энтальпийного (![]() ) и энтропийного (Т·
) и энтропийного (Т·![]() ). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса DG (или изобарно–изотермического потенциала):
![]() .
.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности являются неравенство:
![]() (условие самопроизвольности).
(условие самопроизвольности).
Иными словами, самопроизвольно протекают реакции, если энергия Гиббса в исходном состоянии системы больше, чем в конечном.
Увеличение энергии Гиббса (![]() ) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если же ![]() , то система находится в состоянии химического равновесия.
, то система находится в состоянии химического равновесия.
В соответствии с уравнением ![]() самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, то есть когда
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, то есть когда ![]() и
и ![]() .
.
При других сочетаниях ![]() и
и ![]() возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
возможность процесса определяют либо энтальпийный, либо энтропийный фактор.
Рассмотрим две следующие реакции:
1) ![]()
![]() ;
;
2) ![]()
![]() .
.
Первая реакция экзотермическая, протекает с уменьшением объема. Возможность этой реакции (![]() ) определяется действием энтальпийного фактора, которое перекрывает противодействие энтропийного фактора:
) определяется действием энтальпийного фактора, которое перекрывает противодействие энтропийного фактора: ![]() .
.
Вторая реакция эндотермическая. Протекает с увеличением объема. Возможность этой реакции (![]() ), наоборот, определяется энтропийным фактором. При высокой температуре энтропийный фактор перекрывает энтальпийный фактор:
), наоборот, определяется энтропийным фактором. При высокой температуре энтропийный фактор перекрывает энтальпийный фактор: ![]() . Реакция протекает самопроизвольно.
. Реакция протекает самопроизвольно.
Согласно уравнению ![]() влияние температуры на
влияние температуры на ![]() определяется знаком и величиной
определяется знаком и величиной ![]() .
.
Для реакции с ![]() (2C + O2 Þ 2CO) повышение температуры приводит к увеличению отрицательного значения
(2C + O2 Þ 2CO) повышение температуры приводит к увеличению отрицательного значения ![]() . Для реакции с
. Для реакции с ![]() (2Hg + O2 Þ 2HgO) с повышением температуры отрицательное значение
(2Hg + O2 Þ 2HgO) с повышением температуры отрицательное значение ![]() уменьшается; в этом случае высокотемпературный режим препятствует протеканию процесса. При соответствующей температуре
уменьшается; в этом случае высокотемпературный режим препятствует протеканию процесса. При соответствующей температуре ![]() приобретает положительное значение, и реакция должна протекать в обратном направлении. Если же при протекании процесса энтропия системы не изменяется
приобретает положительное значение, и реакция должна протекать в обратном направлении. Если же при протекании процесса энтропия системы не изменяется ![]() , то значение
, то значение ![]() реакции от температуры практически не зависит.
реакции от температуры практически не зависит.
При высоких температурах самопроизвольно можут протекать реакции, сопровождающиеся увеличением энтропии, при низких температурах – только экзотермические реакции.
Процессы, протекающие с уменьшением энтальпии (![]() ) и увеличением энтропии (
) и увеличением энтропии (![]() ), практически необратимы. В этом случае
), практически необратимы. В этом случае ![]() всегда будет иметь отрицательное значение, какую бы температуру не применяли. Так, для реакции
всегда будет иметь отрицательное значение, какую бы температуру не применяли. Так, для реакции
2КClO3 = 2KCl+3O2
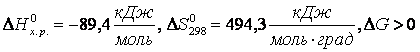 при любой температуре.
при любой температуре.
Под стандартной энергией Гиббса образования ![]() понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
понимают изменение энергии Гиббса при реакции образования 1 моля вещества в стандартных условиях из простых веществ, находящихся в стандартном состоянии.
Стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии системы, не зависит от пути процесса. Поэтому для реакции вида
![]()
изменение стандартной энергии Гиббса ![]() равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
![]() .
.
Для реакции NO + 1/2О2 = NO2
![]() 86,58 0 51,5
86,58 0 51,5 ![]() кДж/моль.
кДж/моль.
При пользовании значениями ![]() критерием принципиальной возможности процесса в нестандартных условиях следует принять условие
критерием принципиальной возможности процесса в нестандартных условиях следует принять условие ![]() , а критерием принципиальной невозможности осуществления процесса - неравенство
, а критерием принципиальной невозможности осуществления процесса - неравенство ![]() . Равенство
. Равенство ![]() означает, что система находится в равновесии.
означает, что система находится в равновесии.
Во многих случаях значениями ![]() можно пользоваться лишь для приближенной оценки направления протекания реакций.
можно пользоваться лишь для приближенной оценки направления протекания реакций.
| Состояние |
| |
| CF4 | -375,8 (вещество инертное, стабильное) | |
| NCl3(ж) | 70 (вещество взрывоопасное) | |
|
| -5,61 | Реакционная способность возрастает |
| C3H6 | 14,99 | |
| C3H4 | 46,47 |
Чем отрицательнее значение ![]() вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней
вещества, тем данное химическое соединение устойчивее. И наоборот, чем положительней ![]() , тем менее устойчиво данное вещество.
, тем менее устойчиво данное вещество.
![]() известны для немногих соединений, но вместе с тем с помощью
известны для немногих соединений, но вместе с тем с помощью ![]()
![]() и
и ![]() можно вычислить
можно вычислить ![]() для десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально.
для десятков тысяч реакций, в том числе предполагаемых и не изученных экспериментально.
В складских помещениях сосредоточены большие количества разнообразных по ассортименту и физико–химическим (в том числе и пожароопасным) свойствам веществ. При нарушении правил хранения возможно образование смесей, способных к экзотермическим реакциям. Такие смеси представляют значительную пожарную опасность. Одни смеси, образованные при контакте негорючего окислителя с горючим, самовозгораются (KMnO4+глицерин; CrO3+ацетон). Другие смеси воспламеняются или взрываются от удара, трения или нагревания (KClO3+сера). Третьи смеси, образованные из негорючих компонентов, при взаимодействии нагревается от теплоты реакции (CaO+вода) или взрываются (KClO3+H2SO4).
Пожарную опасность веществ и их смесей можно определить по энергии Гиббса ![]() , которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
, которая является мерой реакционной способности веществ. Как было показано ранее, реакции между веществами, сопровождающиеся большой потерей энергии Гиббса, протекают самопроизвольно и до конца, иногда приобретают взрывной характер. В этих реакциях энергия Гиббса отрицательна, то есть в исходном состоянии системы (реагирующих веществ) она больше, чем в конечном (продуктов реакции).
Ориентировочно за величину, определяющую направленность процесса, принимают значение 41,8 кДж/моль. Если для реакции расчетом получено ![]() , то реакция возможна не только в стандартных, но и в нестандартных условиях.
, то реакция возможна не только в стандартных, но и в нестандартных условиях.
Если ![]() , то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
, то процесс невозможен как в стандартных, так и в иных условиях. По изменению энергии Гиббса от -41,8 до 41,8 кДж/моль нельзя сделать заключения о возможности протекания процесса в стандартных условиях, но вещества относятся к пожароопасным, хотя эти свойства у них появляются в условиях, отличных от стандартных (например, во время пожара).
Если для веществ по расчету получено ![]() , то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При
, то вещества, участвующие в реакции, пожароопасны и несовместимы. К совместному хранению такие вещества не допускаются. При ![]() вещества совместимые и допускаются к совместному хранению.
вещества совместимые и допускаются к совместному хранению.
Возможность использования энергии Гиббса для оценки пожарной опасности вещества подтверждается следующими примерами.
Пример 1. Определить пожарную опасность разложения твердого окислителя KMnO4 при нагревании. Разложение вещества идет по схеме:
2KMnO4 Þ K2MnO4 + MnO2 + O2.
Решение. Из справочника термодинамических величин находим ![]() веществ, кДж/моль:
веществ, кДж/моль:
![]() KMnO4 – 729,6
KMnO4 – 729,6
K2MnO4 – 1169,2
MnO2 – 467
Находим ![]() :
:
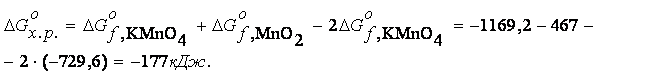 -88,5 кДж/моль < - 41,8 кДж/моль – процесс разложения KMnO4 идет самопроизвольно.
-88,5 кДж/моль < - 41,8 кДж/моль – процесс разложения KMnO4 идет самопроизвольно.
Практически разложение марганцовки при стандартных условиях не происходит. Несмотря на это, KMnO4 следует считать пожароопасным веществом, так как при 240 °С процесс становится самопроизвольным и активным, с выделением О2, что представляет пожарную опасность.
Пример 2. Установить пожарную опасность контакта негорючего CrO3 с горючей жидкостью ацетоном.
3C3H6O + 16CrO3 Þ 8Cr2O3 + 9CO2 + 9H2O
Решение: Находим из справочника ![]() , кДж/моль:
, кДж/моль:
CrO3 ï – 513,8 кДж/моль
Cr2O3 ï – 1059,7 кДж/моль
Ацетон ï – 155,5 кДж/моль
CO2 ï – 394,6 кДж/моль
H2O(г) ï – 237,4 кДж/моль
![]() = 8(-1059,7) + 9(-237,4) + 9 (-394,6) - 3(-155,5) - 16(-513,8) = -5478,3 кДж.
= 8(-1059,7) + 9(-237,4) + 9 (-394,6) - 3(-155,5) - 16(-513,8) = -5478,3 кДж.
Из расчета на один моль ацетона: -1826,1 кДж/моль < - 41,8 кДж/моль – возможен самопроизвольный процесс в стандартных условиях.
Эксперимент показывает, что контакт этих веществ приводит к самовозгоранию и взрыву. Следовательно, совместное хранение этих веществ с точки зрения пожарной безопасности недопустимо.
Список литературыГлинка Н.Л. Общая химия. – М.: Химия, 1978. – С. 183-201.
Карапетьянц М.Х. Введение в теорию химических процессов. – М.:
Высшая школа, 1981. – С. 7-75
Шиманович И.В., Павлович М.Л., Тикавый П.Ф., Малашко П.М. Общая химия в формулах, определениях, схемах. – Мн.: Унiверсiтэцкае, 1996. – С. 89-102.
Кудрявцев А.А. Составление химических уравнений. – М.: Высшая школа, 1991. – 264 С.
Воробьев В.К., Елисеев С.Ю., Врублевский А.В. Практические и самостоятельные работы по химии. – Мн.: УП «Донарит», 2005. – С. 30
Похожие работы
... которые являются основным строительным материалом для образования биологических систем. В связи с этим достаточно отметить, что из более чем ста химических элементов лишь шесть, названных органогенами, служат основой для построения живых систем. 3. Вулканическая деятельность на планете. Виды вулканизма Вулканы – геологические образования, возникающие под каналами и трещинами в земной коре, ...
... в ходе реакции мало, т.е. , тогда ; . При термомеханическом описании реакции опускают , , говорят только об изменении энтальпии : Закон Гесса: тепловой эффект химической реакции протекающий или при или при не зависит от числа промежуточных стадий, а определяется лишь конечным и начальным состоянием системы. Тепловой ...
... период многие страны приняли решение о полном или постепенном отказе от развития атомной энергетики. 1.3 Особенности альтернативной водородной энергетики Водородная энергетика включает следующие основные направления: Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды; ...
... подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы. 3.2 «Триумфальное шествие органического синтеза» Возникновение структурной теории позволило химикам впервые обрести ...
0 комментариев