Навигация
Результаты исследований и обсуждение
2.4 Результаты исследований и обсуждение
Валовый химический состав исследуемого диатомита
По данным рентгеноспектрального анализа диатомит Инзенского месторождения, послуживший материалом для наших исследований, имеет химический состав, приведённый в таблице 2.5.
Таблица 2.5
Химический состав диатомита Инзенского месторождения Ульяновской области
| Содержание, в % на сухую породу. | |||||||||
| Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO2 | K2O | CaO | TiO2 | Fe2O3 |
| 0,01 | 0,07 | 5,35 | 90,20 | 0,09 | 0,03 | 0,12 | 0,70 | 0,12 | 3,22 |
По сравнению с цифрами, приведёнными в литературе, эта партия характеризуется повышенным содержанием кремнезёма (90,2% против 88,15% по данным У. Г. Дистанова; см. таблицу 1.1). Содержание полуторных окислов – в пределах среднего.
Опираясь на данные о содержании глинистого материала в породе, приводимые У. Г. Дистановым и другими авторами [25, 27], можно считать эти цифры косвенным подтверждением высокого содержания опалового кремнезёма в породе.
На основе полученных данных было рассчитано, что в 100 г диатомита в среднем содержится 2,83 г Al и 1,127 г Fe.
Выход алюминия из диатомита в зависимости от значения рН раствора извлечения
А) В ходе серии экспериментов было установлено, что нативный диатомит становится источником алюминия только при рН раствора извлечения менее 5,72 (±0,04) (интервал значений рНисх 1 – 10), а с уменьшением значения рН выход алюминия в раствор возрастает.
В) Для диатомита, прокалённого при 850°С, появление Al3+ в растворе отмечалось при рН<4,8.
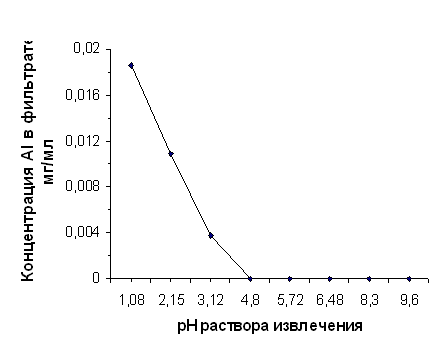
Данные, отражающие зависимость CAl3+ в фильтрате от рН раствора извлечения, приведены в таблицах 2.6 и 2.7 и отражены на графиках, представленных на рисунках 2.1 и 2.2.
Таблица 2.6
Зависимость выхода алюминия от значения рН раствора извлечения для нативного диатомита
| рН исх | 1,02 | 1,94 | 2,70 | 4,01 | 5,72 | 6,07 | 8,30 | 9,60 |
| CAl3+, мг/см3 | 0,0175 | 0,0129 | 0,0033 | 0,0011 | 0,0000 | 0,0000 | 0,0000 | 0,0000 |
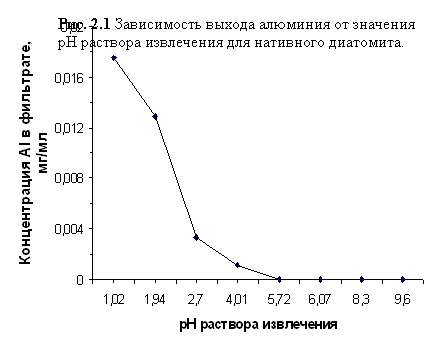 |
Таблица 2.7
Зависимость выхода алюминия от рН раствора извлечения для диатомита, прокалённого при 850°С
| рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 5,72 | 6,48 | 8,30 | 9,60 | |||
CAl3+, мг/см3 | 0,0186 | 0,0109 | 0,0038 | 0,0000 | 0,0000 | 0,0000 | 0,0000 | 0,0000 |
 |
В породе Al2O3 находится в связанном состоянии в составе кристаллической решётки глинистых минералов – гидрослюды и монтмориллонита.
Многочисленные исследования механизма взаимодействия слоистых алюмосиликатов с протонами показывают, что многие из них практически невозможно получить в моноионной Н+-форме, так как они самопроизвольно и немедленно становятся насыщенными Al [36, 98], то есть в них он занимает обменные позиции и способен переходить в раствор.
Д. С. Орлов, Т. А. Соколова и др. объясняют этот факт разрушением кристаллической решётки минералов в ходе реакций протонирования (см. рис. 1.8.). При действии на кристаллиты кислых водных растворов (в природе или лаборатории) катионы оснований Mex+ вытесняются и замещаются на ионы H+. В первую очередь протоны реагируют с гидроксильными группами октаэдрического слоя, находящимися на её боковых сколах. Но, имея достаточно малый радиус, они сравнительно легко мигрируют внутрь кристаллической решётки, а также могут взаимодействовать с ОН-группами, расположенными «на дне» гексагональных пустот тетраэдрической сетки, если глинистый минерал характеризуется подвижной решёткой. В гидрослюде калий с трудом вытесняется из своих обменных позиций, связь между пакетами достаточно прочная, поэтому при слабо- и среднекислом рН раствора взаимодействие с протонами ограничено поверхностными слоями кристаллической решётки.
В результате таких реакций ион Al3+, занимавший центральную позицию в алюмогидроксильном октаэдре, превращается в ион Al(OH)2+ или Al(OH)2+. Структура октаэдра нарушается, и ионы алюминия приобретают способность к обмену. Благодаря избытку ионов H+ и Cl‾ в растворах извлечения весь алюминий переходит в форму простого иона Al3+, и катионы K+ вытесняют его в раствор.
Лабораторные эксперименты и полевые исследования показали, что насыщение почвенного поглотительного комплекса обменным алюминием и развитие процесса подзолообразования связаны с разрушением алюмосиликатов даже при слабокислой реакции почвенного раствора [28, 140]. В результате истощения буферной ёмкости почв и снижения рН до величины менее 4,2 количество подвижного алюминия резко возрастает [4, 23], в том числе и за счёт вышеописанных процессов. Поскольку наши исследования показали значительный рост CAl3+ в фильтратах при 1<рНисх<4,01 (cм. Таблицу 2.6), то эти данные подтверждают предположение о том, что в сильнокислой почве алюмосиликатная составляющая диатомита может стать дополнительным источником обменного алюминия в почвенном растворе. При рН>5,72 не отмечалось его выщелачивания из породы, что также согласуется с литературными данными о поведении алюминия в почве.
При прокаливании диатомита происходит частичное разрушение алюмосиликатов и переход Al2O3 в неактивное состояние: он включается в состав силикатной плёнки на поверхности частиц, устойчивой к воздействию протонов [20, 45]. Поэтому выход алюминия из термоактивированного диатомита отмечался при меньшем, чем для нативного диатомита рН.
Выход железа из диатомита в зависимости от значения рН раствора извлечения
А) Выход железа из нативного диатомита также отмечался только при кислой реакции раствора извлечения (1<рНисх<5,72):
рНисх 3,32 – 5,72 – было зафиксировано появление ионов Fe3+ в фильтрате (при рН 4,50 их концентрация максимальна на данном интервале рН);
рНисх 3,32 – выхода железа из диатомита не отмечалось (CFe3+в фильтрате равна 0);
при рНисх <3,32 вновь начался выход железа из диатомита, с уменьшением значения рН он постоянно возрастал.
В) Порошок диатомита, прокалённого при 850°C, становится источником железа при меньших значениях рН раствора извлечения (<3,12). В более щелочной среде присутствие в фильтратах ионов Fe3+ не отмечалось.
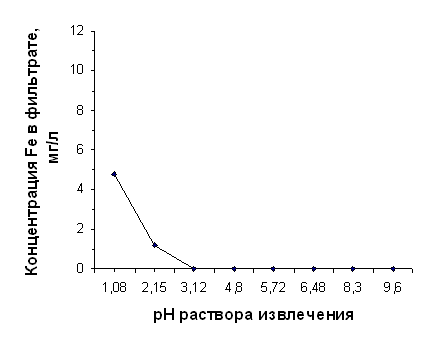
Данные, отражающие зависимость CFe3+ в фильтрате от рН раствора извлечения, приведены в таблицах 2. 8 и 2.9 и отражены на графиках, представленных на рисунках 2.3 и 2.4.
Таблица 2.8
Зависимость выхода железа от значения рН раствора извлечения для нативного диатомита
| рН исх | 1,02 | 1,37 | 1,94 | 2,70 | 3,32 | 4,01 | 4,50 | 6,07 | 8,30 | 9,60 |
| CFel3+, мг/л | 11,07 | 3,56 | 0,79 | 0,40 | 0,00 | 0,59 | 0,79 | 0,00 | 0,00 | 0,00 |
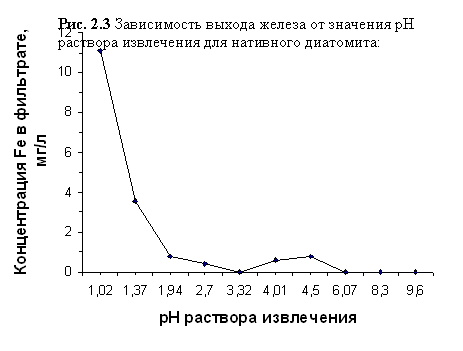 |
Таблица 2.9
Зависимость выхода железа от значения рН раствора извлечения для диатомита, прокалённого при 850°С
| рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 5,72 | 6,48 | 8,30 | 9,60 | |||
CFel3+, мг/л | 4,74 | 1,18 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 |
 |
В диатомите железо заключено в кристаллической решётке алюмосиликатов и частично присутствует в виде свободных окислов. Силикатное железо появляется в кислом растворе вследствие разрушения глинистых минералов по вышеописанному механизму. При замещении водородом обменных катионов протоны взаимодействуют с дефектными тетраэдрами, в которых Si4+ замещён на Fe3+, или октаэдрами c Fe3+ вместо Al3+. Связи Fe—O или Fe—OH протонируются, железо занимает обменные позиции и приобретает способность переходить в раствор. Но свободные окислы железа начинают растворяться при более высоком значении рНисх, так как разрушение ионных и ионно-ковалентных связей кристаллической решётки требует большего количества энергии.
Способность ионов Fe3+ гидролизоваться выше, чем у ионов Al3+, поэтому можно предположить, что при 3,32 <рН<5,72 на процесс выхода железа из нативного диатомита накладывался процесс образования Fe3+ гидроксокомплексов Fe(OH)2+, Fe(OH)2+, Fe(OH)°, который не полностью подавлялся присутствием ионов Сl‾ и Н+ в растворе извлечения. В таком виде железо не определяется сульфосалициловым методом. Этим можно объяснить «горб» на графике, представленном на рисунке 2.3.
Ульрихом [48, 709] было показано, что при рН<3,2 в почве начинается растворение минералов гидроокисей и окисей железа, сопровождающееся появлением ионов Fe3+ в почвенном растворе. По данным наших исследований, резкое повышение выщелачивания железа из диатомита отмечалось при рН<3,32 (от нулевого выхода при рН 3,32 до концентрации Fe3+ в фильтрате 11,07 мг/л при рН 1,02), что в общем соответствуют закономерностям перехода железа в подвижное состояние с понижением рН среды, подробно описанными Л. А. Воробьёвой [28, 315].
Оранжевый цвет термоактивированного диатомита объясняется переходом всего содержащегося в нём железа в форму оксида железа (III). Он отчасти включается в состав силикатной плёнки на поверхности частиц, поэтому в фильтратах при рНисх>3.12 не отмечается присутствие ионов Fe3+. Но в сильнокислой среде (рН<3) Fe2O3 хорошо растворим, и на концентрацию Fe3+ в растворе извлечения не влияют сопутствующие реакции образования гидроксокомплексов. Поэтому в данных условиях из диатомита, прокалённого при 850°С, также интенсивно выщелачивается железо.
Относительный выход алюминия и железа из диатомита.
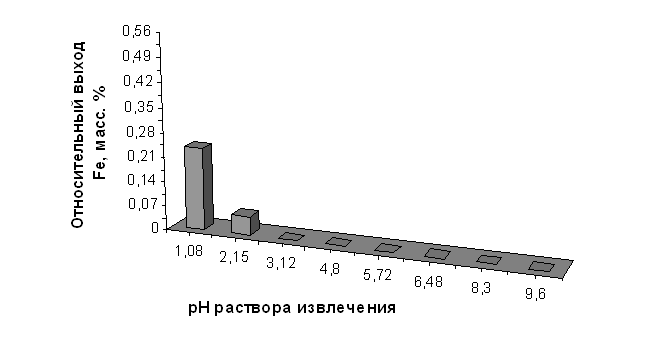
На основе данных о валовом химическом составе и выходе алюминия и железа из диатомита в зависимости от рН раствора извлечения, были рассчитаны показатели относительного выхода этих элементов (в пересчёте на 100 г породы и в массовых процентах) для нативного диатомита и диатомита, прокалённого при 850°С. Результаты приведены в таблицах 2.10, 2.11, 2.12 и 2.13 и на графиках, представленных на рисунках 2.5, 2.6, 2.7 и 2.8.
Таблица 2.10
Относительный выход алюминия из нативного диатомита в зависимости от значения рН раствора извлечения
| рН исх | 1,02 | 1,94 | 2,70 | 4,01 | 5,72 | 6,07 | 8,30 | 9,60 | |
| CAl3+, мг/см3 | 0,0175 | 0,0129 | 0,0033 | 0,0011 | 0,0000 | 0,0000 | 0,0000 | 0,0000 | |
| Относительный выход Al, | мг/100 г породы | 9,397 | 6,708 | 1,650 | 0,591 | 0,000 | 0,000 | 0,000 | 0,000 |
| масс. % | 0,332 | 0,237 | 0,058 | 0,021 | 0,000 | 0,000 | 0,000 | 0,000 |
 |
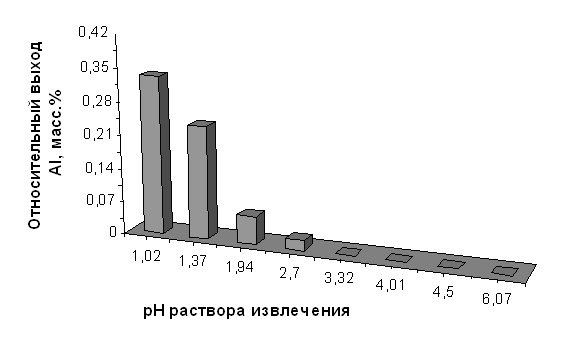 |
Таблица 2.11
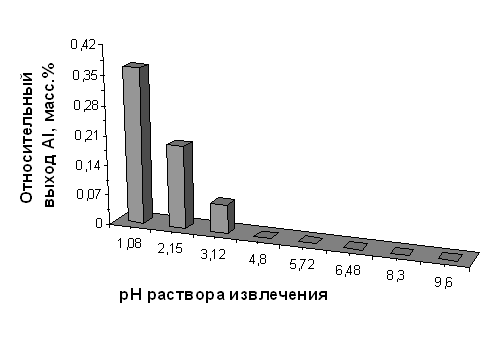
Относительный выход алюминия из диатомита, прокалённого при 850°С, в зависимости от значения рН раствора извлечения
| рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 5,72 | 6,48 | 8,30 | 9,60 | ||||
| CAl3+, мг/см3 | 0,0186 | 0,0109 | 0,0038 | 0,0000 | 0,0000 | 0,0000 | 0,0000 | 0,0000 | ||||
Относительный выход Al, | мг/100 г породы | 10,416 | 5,504 | 1,930 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | |||
| масс. % | 0,368 | 0,194 | 0,068 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 |
 |
Таблица 2. 12
Относительный выход железа из нативного диатомита в зависимости от значения рН раствора извлечения
| рН исх | 1,02 | 1,37 | 1,94 | 2,70 | 3,32 | 4,01 | 4,50 | 6,07 | 8,30 | 9,60 | ||||
| CFe3+, мг/см3 | 11,07 | 3,56 | 0,79 | 0,40 | 0,00 | 0,59 | 0,79 | 0,00 | 0,00 | 0,00 | ||||
Относительный выход Fe, | мг/100 г породы | 5,944 | 1,957 | 0,004 | 0,002 | 0,000 | 0,003 | 0,004 | 0,000 | 0,000 | 0,000 | |||
| масс. % | 0,527 | 0,174 | 0,036 | 0,018 | 0,000 | 0,028 | 0,036 | 0,000 | 0,000 | 0,000 |
 |
Таблица 2.13
Относительный выход железа из диатомита, прокалённого при 850°С, в зависимости от значения рН раствора извлечения
| рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 5,72 | 6,48 | 8,30 | 9,60 | |
| CFe3+, мг/см3 | 4,74 | 1,18 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | |
| Относительный выход Fe, | мг/100 г породы | 2,650 | 0,006 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 |
| масс. % | 0,235 | 0,053 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 | 0,000 |
 |
Буферное действие диатомита в системе твёрдая фаза – раствор
Проведённые эксперименты показали, что порошок диатомита влияет на реакцию раствора извлечения: он повышает значения рН кислых растворов, щелочных же, напротив, понижает. Буферное действие породы гораздо сильнее проявляется в кислой среде, причём нативный диатомит воздействует на величину рН раствора гораздо эффективнее диатомита, прокалённого при 850°С: для него максимальное значение │ΔрН│составило 4,34 при рНисх =2,7. Подвергнутый термообработке диатомит способен изменять рН раствора извлечения максимум на 1,95 единицы рН при рНисх=3,12.
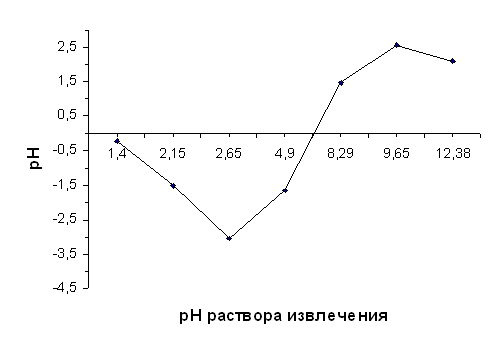
При исследовании влияния порошка нативного диатомита на концентрацию Al3+ в растворах AlCl3 (исходное значение СAl3+ 0,0086 мг/см3) с различными значениями рН были получены данные, особенно ярко демонстрирующие его буферное действие в интервале значений рН 1,4-12,38, особенно в щелочной среде.
Результаты исследований приведены в таблицах 2.14, 2.15 и 2.16 и отражены на графиках, приведённых на рисунках 2.9, 2.10 и 2.11.
Таблица 2.14
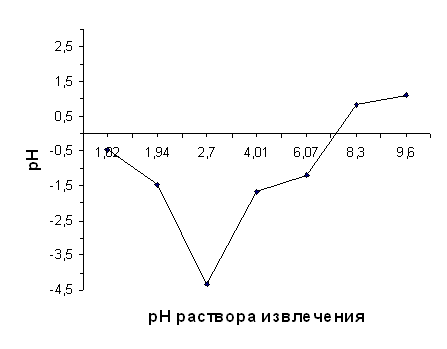
Влияние порошка нативного диатомита на величину рН раствора извлечения (1 М раствора KCl c установленным значением рН)
| рН исх | 1,02 | 1,94 | 2,70 | 4,01 | 6,07 | 8,30 | 9,60 | |||
ΔрН | -0,45 | -1,48 | -4,34 | -1,66 | -1,19 | 0,82 | 1,12 |
 |
Таблица 2.15
Влияние порошка нативного диатомита на величину рН раствора извлечения (раствора AlCl3 c установленным значением рН)
| рН исх | 1,40 | 2,15 | 2,65 | 4,90 | 8,29 | 9,65 | 12,38 |
| ΔрН | -0,23 | -1,52 | -3,03 | -1,63 | 1,48 | 2,58 | 2,10 |
 |
 |
Таблица 2.16
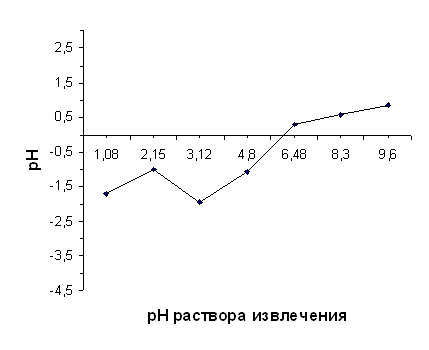
Влияние порошка диатомита, прокалённого при 850°С,
на величину рН раствора извлечения (1 М раствора KCl c установленным значением рН)
| рН исх | 1,08 | 2,15 | 3,12 | 4,80 | 6,48 | 8,30 | 9,60 | |||
ΔрН | -1,71 | -0,98 | -1,95 | -1,07 | 0,30 | 0,57 | 0,85 |
 |
Буферное действие диатомита в кислой среде связано:
с адсорбцией протонов на сколах частиц алюмосиликатов и последующим разрушением их кристаллической решётки;
с адсорбцией ионов H+ на гидроксилированной поверхности опалового кремнезёма за счёт сил ионного притяжения вплоть до рН~2, при котором число заряженных центров на поверхности кремнезёма равно нулю (точка нулевого заряда).
Кроме того, Кольтгофом и Стенжером было показано, что сильнокислой среде гидроксилированная поверхность кремнезёма активно адсорбирует ионы Fe3+ и Al3+ с образованием кислотных групп на его поверхности [2, 237]. Реакция сопровождается вытеснением протонов и снижением концентраций исследуемых ионов в растворах. Можно предположить, что именно этим объясняется уменьшение величины ΔрН при рНисх<2,7.
Гидроксилированная поверхность кремнезёма имеет точку нулевого заряда при рН~2 [3, 913]. При более высоких значениях рН она проявляет слабые кислотные свойства, а при рН >~6 степень ионизации возрастает, и водород Si―OH группы легче диссоциирует. Переходя в раствор, протоны уменьшают степень его кислотности. Кроме того, при рН>7 – 8 растворимость кремнезёма начинает заметно расти [3, 66]. Как показано Р. Айлером, реакции гидратации и деполимеризации происходят с участием гидроксил-ионов (см. рис. 1.3), но при рН<8 образовавшийся силикат-ион гидролизуется с образованием молекул растворимого кремнезёма Si(OH)4 и ионов ОН‾ [2, 91], поэтому при рН<9,6 буферное действие породы, проявлялось слабее, чем в кислой среде. При рН>10,7 кремнезём весь растворяется с образованием силикат-ионов, что приводит к понижению концентрации гидроксил-ионов в растворе извлечения.
При термической активации происходит частичная дегидратация силанольной поверхности аморфного кремнезёма и для её регидратации требуется многодневное выдерживание образцов в нейтральном водном растворе [3, 915]. Это значительно ослабляет буферное действие опаловой составляющей диатомита, прокалённого при 850°С. Частичное разрушение алюмосиликатов снижает адсорбцию протонов с их участием и изменяет значение показателей выхода железа и алюминия. В целом диатомит, прокалённый при 850°С, обладает менее выраженным буферным действием по сравнению с нативным.
Влияние порошка нативного диатомита на концентрацию Al3+ в растворе AlCl3 в зависимости от значения рН раствора извлечения
В присутствии порошка нативного диатомита происходило заметное снижение концентрации алюминия в растворе AlCl3 c исходной CAl3+ 0,0086 мг/см3 и установленными значениями рН:
рНисх 1,4-4,9 – отмечалось значительное уменьшение содержания алюминия в фильтрате по сравнению с раствором извлечения вплоть до CAl3+ =0 при рН 4,9;
рНисх 4,9-12,4 – было зафиксировано присутствие ионов Al3+ в исследуемых растворах, с максимальной концентрацией 0,0038 мг/см3 при рН 8,29;
рНисх 12,38 – CAl3+ в фильтрате равна нулю.
Повышение концентрации исследуемого иона в фильтрате по срав- нению с раствором извлечения отмечалось только при рН<~2-2,5.
Данные, отражающие влияние нативного диатомита на значение CAl3+ в фильтрате в зависимости от рН раствора извлечения, приведены в таблице 2.17 и отражены на графике, приведённом на рисунке 2.12.
Таблица 2.17
Влияние нативного диатомита на значение CAl3+ в фильтрате в зависимости от значения рН раствора извлечения:
| рН исх | 1,40 | 2,15 | 2,65 | 4,90 | 8,29 | 9,65 | 12,38 |
| CAl3+, мг/см3 | 0,0164 | 0,0062 | 0,0010 | 0,0000 | 0,0038 | 0,0017 | 0,0000 |
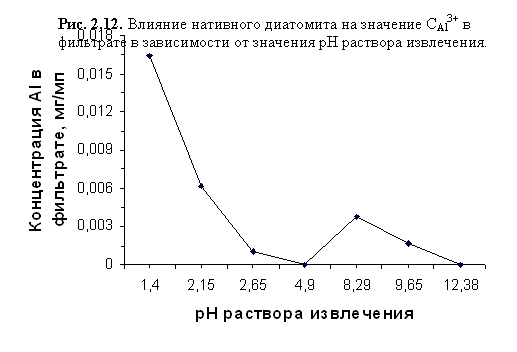 |
Резкое уменьшение концентрации исследуемого иона в фильтратах при рНисх<4,9 связано с тем, что его адсорбция на обменных позициях глинистых минералов и поверхности аморфного кремнезёма происходит быстрее, чем трансформация поверхностных слоёв кристаллической решётки алюмосиликатов, так как требует меньших затрат энергии. Адсорбировавшись на поверхности кристаллитов, ионы Al3+ затрудняют проникновение протонов внутрь, защищая решётку от разрушения. В кислой среде происходит наложение процессов поглощения Al3+ диатомитом и выщелачивания алюминия из его глинистой составляющей.
Ульрихом [48, 708] было показано, что при рН 4,2-5,0 вытеснение Al из кристаллических решёток минералов сопровождается образованием полимерных аквагидроксокомплексов алюминия, занимающих их обменные позиции. Можно предположить, что этим объясняется снижение поглощения диатомитом ионов Al3+ из раствора при рНисх 4,90-8,29. К тому же подщелачивание раствора извлечения способствует активизации гидролиза, а образующиеся в растворе катионы Al(OH)x3-x нельзя определить по выбранной нами методике. При более щелочной реакции среды весь алюминий раствора переходит в форму комплексных ионов переменной основности и активно поглощается порошком диатомита.
Выводы
В результате проведённых исследований можно сделать следующие выводы об особенностях поведения алюминия и железа инзенского диатомита в моделируемых условиях внешней среды:
Прокаливание диатомита при 850°С в течение 4 часов приводит к разрушению входящих в его состав слоистых алюмосиликатов и частично иммобилизует полуторные окислы.
В кислой среде порошок диатомита становится источником подвижных форм алюминия и железа, из прокалённого при 850°С диатомита выход исследуемых элементов в раствор происходит при более низком значении его рН.
Диатомит обладает буферным действием в широком диапазоне значений рН (1-12,4), при кислой реакции среды оно более выражено, чем при щелочной.
Нативный диатомит способен поглощать ионы Al3+ из раствора хлористого алюминия, при кислом рН падение концентрации ионов происходит только за счёт адсорбции на отрицательно заряженных поверхностях, в щелочной среде процесс осложняется гидролизом соли и поглощением аквагидроксокомплексов алюминия.
При рН растворах извлечения менее 5,72 нативный диатомит становится источником подвижного алюминия; в сильнокислой реакции среды (рН<4,0-4,5) его выход в раствор резко возрастает; из прокалённого при при 850°С диатомита выход алюминия происходит при более кислой реакции среды (рН<4,8).
Выщелачивание железа из породы имеет место при более низком значении рН (<3,32) не только за счёт глинистых
Список литературыАйлер Р. Колллоидная химия кремнезёма и силикатов: Пер. с англ. – – М.: Госстройиздат, 1959. – 288 с.
Айлер Р. Химия кремнезёма: Пер. с англ. В 2-х частях, ч.1 – – М.: Мир, 1982. – 416 c.
Айлер Р. Химия кремнезёма: Пер. с англ. В 2-х частях, ч.2 – – М.: Мир, 1982. – 706 c.
Антонова Н. Б. Международный проект «Химическая бомба замедленного действия» // Проблемы окружающей среды и природных ресурсов. Вып. 2. – М.: ВИНИТИ, 1995. – С. 20 – 32.
Боброва Е. К., Бобров А. А. Минеральные новообразования диоксида кремния в растениях и почве // Минералогия и жизнь: биоминеральные взаимодействия. – Сыктывкар: Ин-т геологии Коми, 1996. – С. 50.
Быков В. Т. структура и адсорбционные свойства природных сорбентов // Природные сорбенты / Отв. ред. В. Т. Быков. – М.: Наука, 1967. – 187 с.
Вернадский В. В. Биогеохимическая роль алюминия и кремния в почвах // Труды по биогеохимии и геохимии почв. – М.: Наука, 1992. – 437 с.
Власов В. В., Дистанов У. Г. О составе кремнезёма кремнистых пород палеогена Среднего Поволжья // Доклады АН СССР. Т. 128. – №6. – – 1959. – С. 114 – 116.
Воронков М. Г. и др. Кремний и жизнь: биохимия, фармакология и токсикология соединений кремния. / М. Г. Воронков, Г. И. Зелчан, Э. Я. Лукевиц. – Рига: Зинанте, 1978. – 587 с.
Воронков М. Г., Кузнецов И. Г. Земная кремниевая жизнь // Химия и жизнь. – 1984. – №12. – С. 95 – 99.
Воронков М. Г., Кузнецов И. Г. Кремний в живой природе. – Новосибирск: Наука, 1984. – 157 с.
Геология и полезные ископаемые мезо-кайнозойских отложений Ульяновской области / Под ред. А. П. Дедкова. – Казань, 1964. -334 с.
Грег С., Синг К. Адсорбция, удельная поверхность, пористость: Пер. с англ. – М.: Мир, 1984. – 310 с.
Дистанов У. Г. Геолого-промышленные типы месторождений осадочных кремнистых пород СССР. Критерии их прогноза и поисков // Происхож- дение и практическое использование кремнистых пород: Сб. ст. АН СССР / Отв. редакторы В. Н. Холодов, В. И. Седнецкий. – – М.: Наука, 1987. – С. 157 – 167.
Добровольский В. В. Основы биогеохимии: Учеб. пособие для геогр., биол., с-х. спец. вузов. – М.: Высшая школа, 1998. – 413 с.
Ермолаев А. А. Кремний в сельском хозяйстве. – М.: Линф, 1992. – 256 с.
Жузе А. П. Кремнистые осадки в современных озёрах. // Геохимия кремнезёма: Сб. ст. АН СССР / Отв. ред. Н. М. Страхов. – – М.: Наука, 1966. – С. 301 – 314.
Иванов И. А. Диатомовая земля Ульяновской области // Вестник Среднего Поволжья. – 1925. – № 8 – 9. – С. 137 – 144.
Использование соединений кремния в сельском хозяйстве / В. М. Дьяков, В. В. Матыченков, В. А. Чернышев, Я. М. Аммосова // Актуальные вопросы химической науки и технологии и охраны окружающей среды. Вып. 7. – М.: НИИТЭХИМ, 1990. – 32 с.
Каглер М., Воборский Я. Фильтрование пива. – – М.: Агропромиздат, 1986. – 279 с.
Каледа Г. А. Основные черты эволюции кремнистого осадконакопления // Геохимия кремнезёма: Сб. ст. АН СССР / Отв. ред. Н. М. Страхов. – – М.: Наука, 1966. – С. 369 – 385.
Кельцев Н. В. Основы адсорбционной техники. М.: Химия, 1984. – 512 с.
Кнорре Д. Г., Крылова Л. Ф., Музыкантов В. С. Физическая химия: Учебник для биол. ф-тов университетов и пед. вузов. – 2-е изд., испр. и доп. – М.: Высшая школа, 1990. – 416 с.
Ковда В. А. Биогеохимия почвенного покрова / Отв. ред. О. В. Зонн. – – М.: Наука, 1985. – 263 с.
Кремнистые породы СССР / Отв. ред. У. Г. Дистанов. – Казань: Татарское книжное издательство, 1976. – 412 с.
Лопаткин А. А. Теоретические основы физической адсорбции. М.: Изд-во МГУ, 1983. – 344 с.
Надольский О. К. Диатомиты, трепелы и опоки Ульяновской области // Краеведческие записки Ульяновского краеведческого музея. Вып 2. – – 1958. – С. 319 – 329.
Орлов Д. С. Химия почв. – М.: Изд-во МГУ, 1992. – 400 с.
Оспанова Н. К. Нескелетное и скелетное биоминералообразование в истории Земли // Минералогия и жизнь: биоминеральные взаимодействия.. – Сыктывкар: Ин-т геологии Коми, 1996. – С. 58.
Петров В. П. Практическое значение кремнистых горных пород // Проис- хождение и практическое использование кремнистых пород: Сб. ст. АН СССР / Отв. редакторы В. Н. Холодов, В. И. Седнецкий. – – М.: Наука, 1987. –168 – 172 с.
Почвоведение / И. С. Кауричев , Н. П. Палос, И. Н. Розов и др.; Под ред. И. С. Кауричева. – 4-е изд., перер. и доп. – – М.: Агропромиздат, 1989. – 716 с.
Практикум по агрохимии / Б. А. Ягодин, И. П. Дерюгин, Ю. П. Жуков и др.; Под ред. Б. А. Ягодина. – М.: Агропромиздат, 1977. – 512 с.
Рохов Ю. Д. Мир кремния: Пер. с англ. – М.: Химия, 1990. – 147с.
Руководство по химическому и технологическому анализу воды. – – М.: Стройиздат, 1973. – 273 с.
Симонов Г. А. Органо-минеральные комплексы почв – проблемы диагностики // Минералогия и жизнь: биоминеральные взаимодействия. – Сыктывкар: Ин-т геологии Коми, 1996. – С. 62 – 63.
Соколова Т. А. Химические основы мелиорации кислых почв. – – М.: Изд-во МГУ, 1993. – 180 с.
Соколова Т. А., Дронова Т. Я. Изменение почв под влиянием кислотных выпадений. – М.: Изд-во МГУ, 1993. – 64 с.
Тарасевич Ю. И. Высокодисперсные минеральные адсорбенты // Журнал Всесоюзного химического общества. – 1989. – №2. – С. 61 – 69.
Химические основы буферности почв / Т. А. Соколова, Г. В. Мотузова, Т. Д. Обуховская. – М.: Изд-во МГУ, 1991. – 108 с.
Хмельницкий Р. А. Физическая и коллоидная химия: Учебник для с.-х. cпец. вузов. – М.: Высш. шк., 1988. – 400 с.
Холодов В. Н. Эволюция кремненакопления в истории Земли // Происхождение и практическое использование кремнистых пород: Сб. ст. АН СССР / Отв. редакторы В. Н. Холодов, В. И. Седнецкий. – – М.: Наука, 1987. – С. 31 – 49.
Шуменко С. И. Роль биогенного фактора в кремненакоплении // Происхождение и практическое использование кремнистых пород: Сб. ст. АН СССР / Отв. редакторы В. Н. Холодов, В. И. Седнецкий. – – М.: Наука, 1987. – С. 61 – 72.
Diatoms // http://silicasecchidisk.conncoll.edu/
Diatoms industrial use: diatomaceous earth as an insecticide // http://hjs.geol.uib.no/diatoms/
Hench L., West J. The sol – gel process // Chem. Rev. – 1990. – V. 90. – – P. 33 – 72.
Kemp A., Pearce R., Koizumi I. The role of mat-forming diatoms in the formation of Mediterranean sapropels // Nature. – 1999. – V. 398. – – P. 57 – 60.
Tracy A. Willareal, Cynthia Pilskan, Mark Brzezinski. Upward transport of oceanic nitrate by migrating diatom mats // Nature. – 1999. – V. 397. – – P. 423 – 424.
Ulrich B. Natural and anthropogenic components of soil acidification // Leit. Pflanzenern. Bodenkunde. – 1986. – V. 149. – P. 707 – 717.
Приложение
Каталог разведанных месторождений диатомита Ульяновской области.
| № | Наименование месторождения (района) | Местоположение месторождения | Геологический индекс | Запасы по категориям, тыс. м3 | Мощность продуктивного слоя, м | Мощность вскрыши, м | Краткая качественная характеристика | Области применения | Кем разведано | |
| 1 | Барышское (Барышский) | Против северного конца г. Барыш, на правом берегу р. Сыр-Барыш, в 0,5 км от ж.-д. Станции. | Pg1 sz1 | А – 1028, В – 825 (Протокол ТКЗ № 22 от 6. VI -61 г.) | От 7 до 25 (средняя 16,3) | От 1,1 до 10,8 (средняя 4,65) | Q от 0,816 до 1,176 (сред. по 5 aн. 0,933); H20 – 3,33 – 6,72 (4,95); SiO2 – 77,64 – 89,24 (80,90); Al203 – 5.57 – 8,16 (6,92); Fe2Оз – 2,06 – 6,53 (3,94); СаО – 0,06 – 1,3 (0,56); MgO – 0,48 – 1,16 (0,90); SO3 – 0,0 – 1,37 (0,26); п.п.п. – 3,65 – 6,62 (4,87). | Для производства легковесного строительного кирпича марки „75” кл. „А" (ГОСТ 6316-55). Разрабатывается Барышским кирпичным заводом | Л. А. Джиошвили, Куйбышевгеолстромтрест. 1955; Л. В. Мирошникова, КГРЭ, 1960 | |
| 2 | Вырыпаев-ское (“Гель-шерт”) (Инзен-ский) | В 0,8 км востоко-северо-восточнее с. Малые Озимки, в 2,5 км северо-восточнее ж.-д. ст. Вырыпаевка | Pg1 sz1 | А2 – 1190, В – 1900, C1 – 4380 | Средняя 19,7 | От 0,6 до 11,8 (средняя 4,4) | Q от 0,68 до 1,14 (сред. 0.84); Н2О – 2.57 – 5,84 (4,64); SiO2, – 78,34 – 84,88 (22,0); Al2O3 – 5.05 – 6:60 (5,9); Fe2O3 – 2,77 – 3,78 (3,13); ТiO2 – О.З6 – 0.54 (0,42); СаО – 0,3 – 1,3 (0,81); MgO – 0,69 – 1,17 (0,93); SO3 – 1,01 – 1,17 (0,28); п.п.п. – 3,14 – 8,14 (5,17); SiO2 раств. – 9,48 – 18,12 (12,35) | Для производства легковесного строительного кирпича, теплоизоляционных изделий. Не разрабатывается | К. Я. Бабич, Средне-Волжский ин-т прикладной минералогии, 1932; А. А. Дьяченко, КГРЭ. 1959 | |
| 3 | Вязовское (Инзенский) | В 2,5 км юго-восточнее с. Вязовка, в 4 – 5 км севернее ж.-д. разъезда Должниково, в 2,5 км от линии ж.д. | Pg1 sz1 | В – 4300 (Протокол ТКЗ от 13.V. -32 г.) | 14 | 2,72 | Q в порошке 0,447 – 0,560;SiO2 – 80,39 – 82,96; А12O3 – 6,02 – 6,68; Fe2O3 – 2,63 – 3,47;CaO – 0,84 – 0,98; MgO – 0,85 – 1,18; SO3 – 0,27 – 0,33; п.п.п. – 5,15 – 6,51; SiO2 раств. – 7 – 10 | Для производства легковесного строительного кирпича, теплоизоляционных изделий. Не разрабатывается | К. Я. Бабич, Средне-Волжский ин-т прикладной минералогии, 1932 | |
| 4 | Забалуйское (Инзенский) | В 3,5 – 4 км юго-западнее с. Забалуйка, в 2,5 км южнее ж.-д. ст. Свет Инзенского р-на. | Pg1 sz1 | А – 3337, В – 1990, C1 – 4532 (Протокол ТКЗ № 63 от 27. XI – 61 г.) | 8 – 32 (21) | 0,1 – 13 (2,49) | Q 0,817 – 0,627 (0,726); Н2О – 4,76 – 6,76 (6,04); SiO2 – 77,2 – 85,42 (82,9); СаО – 0 – 1,94 (0,68); MgO – 0,29 1,18 (0,62); SO3 – 0,04 – 1,22 (0,05); Fe2O3 – 2,08 – 5,35 (3,12); А12Оз – 4,30 – 8,90 (6,07); ТiO2 – 0,3 – 0,79 (0,5); К2О – 0 – 2,01 (1,23); Na2O – 0 – 0,55 (0,3); SiO2 раств. – 12,11. | Для производства легковесного кирпича марки 100 кл. Б и В, теплоизоляционных изделий марки „700”, фильтровальных порошков. Разрабатывается кирпичным заводом „Свет" | В. Д. Батурина, Куйбышевгеолстромтрест, 1954; Л. В. Ми-рошникова, Средне-Волжское геол. упр., 1961 | |
| 5 | Инзенское (Инзенский) | Первый участок в 2,5 км к югу от ст. Инза (примыкает к заводу № 1) | Pg1 sz1 | Участок разведки 1939 г. А – 5054, В – 583 (Протокол ВКЗ № 1430 от 13. IX-39 г.). Участок разведки 1942 г. А – 228, В – 1060, С – 896 (Протокол ВКЗ № 2970 от2б. Х1-43г.) | 34 – 60 | 1,5 – 2 | Светлая разность: Q в куске 0,648 – 0,705 (0,684), в порошке 0,224 – 0,333; SiO2 – 74,77 – 88,15; А12O3 – 3,10 – 9,35;Fe2O3 – 2.37 – 5,16; ТiO2 – 0,24 – 0.49; CaO – 0,47 – 0,85; MgO – 0,61 – 1,71; K2O – 1,56; п.п.п. – 2.73 – 5,88; SiO2 раств. – 5,94 – 7,71 | Для , производства теплоизоляционных изделий марки ,,500° – „600", вулканитовых плит, асбозурита. Разрабатывается Ин – зенским диатомовым комбинатом | В. И. Скозобов, ВИМС, 1939; А. Кржечковский, Ленгеолнерудтрест, 1943 | |
| Второй участок в 1,5 км к юго-западу от ст.Инза (примыкает к заводу № 2) | Pg1 sz1 | А – 1705 | 30,13 | 3,5 | Пятнистая разность: Q в порошке 0,264 – 0,334; SiO2 – 78,61 – 82.8; А12O3 – 5,41 – 6,01; Fe2O3 – 1,38 – 2,94; TiO2 – 0:31 – 0,36; CaO – 0.42 – 1,12; MgO – 0,81 – 1,43; K2O – 1.46; п.п.п. – 4,25 – 10,16. | |||||
| Серая разность: Q в порошке 0,279 – 0,357; SiO2 – 72,32 – 82,65; Al2О3 – 4.79 – 6,27; Fe2O3 – 2,23 – 3.44; TiO2 – 0,24 – 0,35; CaO – 0.4 – 6.46; MgO – 0,88 – 1,24; – K2O – 1,86; п.п.п. – 5,7 – 10,05. |
Продолжение
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 6 | Кивачское (Кузоватовский) | В 0,5 км к западу от ж.-д. Разъезда Кивач, в 4 км от ж.-д. ст. Без -водовка, в верхней части водораздельной возвышенности | Pg1 sz1 | A – 3700 | Средняя – 9, макс.-14,6 | Средняя – 1,0 макс.-1,7 | Q в порошке от 0,44 до 0,496 (0,447); Н2О – 9 – 19,9; SiO2 – 83,2 – 86,6 (84,05); А12O3, – 4,3 – 6,1 (5,2); Fe2O3 – 3,8 – 4,1 (3,95); CaO – 1,7 – 2,2 (1,92); MgO – 0,2 – 0,7 (0,44); SO3– 0,1 – 0,9 (0,38); п.п.п.– 0,25 – 4,7 (3,04) | Для производства изоляционных изделий, легковесного строительного кирпича. Не разрабатывается | К. Я. Бабач, Средне-Волжский ин-т прикладной минералогии, 1932 |
| 7 | Сенгилеевское (Сенгилеевский) | Первый участок, Гранное Ухо" – в 3 км к западу от Сенгилеевско-го цемзавода, в 2,5 км (по прямой) от берега Волги | Pg1 sz1 | А – 108, С – 215 | 26 – 35,7 | От 0 до 9 | Q в куске 0,61 – 0,78, в порошке 0,43 – 0.536 Н2О – ,68 – 6,92 (4,66); SiO2 – 77, 86 – 86,57 (82,46); А12O3 – 4,22 – 9,60 (6,25); Fe2O3 – 1,12 – 5,01 (3,23); CaO – 0,15 – 0,88 (0,53); MgO – 0,53 – 1,52 (0,92); SO3 – 0,17 – 0,91 (0,37); K2O – 1,03 – 1,62 (1,30); п.п.п. – 4,16 – 6,85 (5,50); SiO2 pacтв. – 5,02 – 8,48 (6,88) | Для производства теплоизоляционных изделий марки „500” – „600”, вулканита с объем. весом не более 400 кг/м3 и др. Не разрабатывается | Г. В. Лазаренков, Горнотехтрест, 1936, В. И. Скозобов. ВИМС, 1940; Н. А. Красильников, трест „Мосгеолнеруд", 1955 |
Продолжение
| Второй участок „Лысуха" – в 1 км западнее участка „Гранное Ухо” | Pg1 sz1 | А – 1232, В – 879, С – 1754,2 | 26 – 35,7 | От 0 до 9 | Q в куске 0,691 – 0,878, в порошке 0,493 – 0,546; SiO2 – 80,92 – 86.4; А12O3, – 5,30 – 7,95; Fe2O3– 1,0 – 3,38; CaO – 055 – 0,73; MgO – 0,68 – 1,17; п.п.п.– 3,36 – 5,18 | |||||
| 8 | Шарловское (Вешкаймский) | В 0,5 км юго-западнее ж.-д ст. Шарлово, на левом берегу р. Шарловка | Pg1 sz1 | А2 – 12210, В – 2546 (протокол ВКЗ от 10.IV – 42 г.) | Средняя 20 | Средняя-2 | Q от 0,93 до 1,26 (1,07); SiO2 – 73,58 – 83,6 (77,61); А12O3 – 3,14 – 14,21 (8,03); Fe2O3 – 0,79 – 5 74 (3,27); CaO – 024 – 1,90 (0,51); MgO – 4,36 – 2,04 (1,09); п.п.п. – 3,74 – 8,97 (7,03) | Для производства легковесного строительного кирпича марки “50” и “75”. теплоизоляционных изделий Разрабатывается Шарловским киопичным заводом | П. Ф. Вечканов. Ю. В. Трест стройматериалов, 1940 | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| 9 | Решеткинское (Барышский) | В 0,5 км к юго-востоку от с. Чувашская Решетка, у линии ж. д. | Pg1 sz1 | А – 2000 В – 3697 C1 –8761 С3 –9767 | 21,4 – 31,4 (25,5) | 1 – 7,7 (3,4) | Q в куске – 0,8 – 1,17 (1,0), в порошке 0,6 – 0,81; Н2О – 2,11 – 3,68 (3,09); SiO2 – 78,74 – 79,92 (79,33); А12O3 6,32 – 7,69 (7,62); Fe2O3 – 3,0 – 4,93 (3,98); TiO2– 0,42 – 0,58 (0,52); CaO – 0,2 – 0,9 (0,58); MgO – 0,99 – 1,39 (1,18); SO3 – 0,14 – 0,32 (0,11); п.п.п. – 4,44 – 6,35 (5,32); SiO2 актив. – 8,02 – 11,05 (9,69) | Для производства легковесного строительного кирпича марки „100” кл. «B» и пустотелого кирпича марки “75” кл. «А». Не разрабатывается | А. А. Дьяченко, КГРЭ, 1959 |
Похожие работы
... химическое, макроструктурное модифицирование и одновременное обогащение бентопорошка, позволяют повысить сорбционные свойства и качество готовой продукции. 3.4 Разработка полимерных композиционных материалов на основе органоглин на основе бентонита месторождения «Герпегеж» Объектами исследований в данной части работы являются нанокомпозиты, полученные на основе органомодифицированных ...
... установленный предельно допустимый сброс (ПДС) - Снефтепрод =10-100 мг/л при ПДСнефтепрод =0,5-1,2 мг/л. Для комплексной утилизации СОЖ предлагается использовать гидрофобизированные порошки (ГФП) на основе природных сорбентов Ульяновской области (диатомита, опоки). Установлена возможность и эффективность их применения, как для разрушения отработанной эмульсии, так и для очистки водной и масляной ...
... уровень шума - 72 ДбА. Проектом предусмотрены следующие меры по снижению шума: установка звукоизоляционных кожухов на оборудование, применение малошумных передач, балансировка вращающихся механизмов, применение посадок деталей с натягом. 4) Вибрация. Источники вибрации на участке: пресс, автомат-садчик, транспортер. Виды вибрации: технологическая, транспортно-технологическая. Вибрация по ...
... хлопьев начинается физический процесс седиментации - оседание под действием сил тяжести. Способность дрожжей к хлопьеобразованию (флокуляции) имеет большое значение для технологии сбраживания пивного сусла, так как способствует ускорению осветления пива и облегчает съем дрожжей из бродильного аппарата после брожения с последующим повторным использованием их в качестве семенных дрожжей. Низкая ...



0 комментариев