Навигация
4. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ.
На электродах как под действием тока, так и в его отсутствие, протекают электрохимические реакции, приводящие к установлению определенного скачка потенциала на границе электрод — раствор (так называемого электродного потенциала— ф). При отсутствии внешнего тока на границе электрод — раствор устанавливается равновесие между окисленной и восстановленной формами вещества:
[Ox]+nе<->[Red],
где [0х] и [Red]—концентрации окисленной и соответственно восстановленной формы вещества;
ne – количество электронов, участвующих в электрохимической реакции.
электрохимической реакции.
Если металл электрода способен окисляться и посылать катионы в раствор, то на электроде быстро устанавливается равновесие.
Потенциал электрода будет отрицательным, если катионов металла перейдет в раствор больше, чем за это же время их восстановится. Если же процесс восстановления превалирует над процессом окисления, то потенциал будет положительным. Потенциал активных металлов, погруженных в растворы, содержащие катионы тех же металлов, отрицателен. Металлы, стоящие в ряду активности правее водорода, имеют положительное значение потенциала. Последовательность расположения металлов в ряду активности как раз и определяется величиной их металлов в ряду активности как раз и определяется величиной их электродных потенциалов. Чем легче окисляется металл, тем отрицательнее его электродный потенциал, тем большую электродвижущую силу (э.д.с.) будет иметь гальванический элемент, составленный из электрода данного металла и второго электрода с известным значением потенциала (электрода сравнения). Поэтому ряд активности металлов правильнее называть рядом напряжений.
Если вещество электрода инертно (не растворяется в электролите), а в растворе содержатся вещества, способные окисляться--восстанавливаться, то они могут отнимать у электрода или отдавать ему электроны. Инертный электрод в этом случае зарядится или отрицательно (если растворенное вещество легче отдает электроны, чем принимает), или положительно (если оно отнимает электроны от электрода легче, чем отдает). При этом на границе инертный электрод— раствор устанавливается равновесие.
Скачек потенциала, возникающий на границе инертный электрод – раствор, называют окислительно-восстановительным или редокс-потенциалом. Примерами таких электродов могут служить: платина, погруженная в раствор солей ионов двух- и трехвалентного железа или раствор, содержащий ионы хлора и свободный хлор, нержавеющая сталь в растворе, содержащем кислород.
Если одна из форм окислителя – восстановителя находиться в газообразном состоянии, то электроды называют газовыми: водородный, кислородный, хлорный.
Во всех случаях электродный потенциал будет тем отрицательнее, чем легче вещества окисляются, и тем положительнее, чем легче они восстанавливаются. Таким образом, электродный потенциал служит мерой окислительно-восстановительной способности веществ.
В связи с тем, что потенциал электрода зависит еще от температуры и от концентрации окислителя-восстановителя в растворе, было введено понятие о стандартных электродных потенциалах (о потенциалах, измеренных при равных условиях). Это позволяет сравнивать окислительно-восстановительную способность различных веществ. Стандартные потенциалы измерены при температуре 250 С в растворах, содержащих 1 г-ион (в случае неэлектролитов по одному молю) и 1000 г. воды окисленной и восстановленной форм веществ, принимающих участие в электродной реакции. Если одна из форм вещества является газом, то раствор насыщают им под давлением 1 атм.
Так, например, стандартный редокс-потенциал электрохимической реакции Fe3+ -e < > Fe2+ равен потенциалу платиновой пластинки при 250 С в растворе, содержащем по одному г-иону ионов Fe3+ и Fe2+ в 1000 г. воды. Стандартный потенциал медного электрода равен потенциалу медной пластинки в растворе ионов Cu2+ на 1000 г. воды.
Зависимость потенциала электродной реакции
Ox + pA + ne « Red + mB
От температуры и концентрации, участвующих в ней веществ выражается формулой Нернста:
ф =ф0 + (R*T/n*F)* ln([0х]*[A]p/[Red]*[B]m)
где ф0 - стандартный электродный потенциал, в;
R – универсальная газовая постоянная Менделеева – Клапейрона, равная
8,314 Дж;
T – абсолютная температура, К;
F – число Фарадея, к;
n – число электронов, участвующих в электродной реакции;
ln – натуральный логарифм (ln х = 2,303 lg x);
[0х] и [Red] — начальные концентрации окислительной и
соответственно восстановительной формы вещества, для
которых рассчитывается окислительно-восстановительный
потенциал;
[A] и [B] – начальные концентрации других веществ, участвующих
в электродной реакции (обычно вода, ионы Н+ или ОН-);
m и p – стехиометрические коэффициенты в уравнении электродной
реакции.
По уравнению электродной реакции легко рассчитать окислительный потенциал системы.
Пример 1.
Рассчитать окислительный потенциал электродной реакции
PbO2 + 4H+ +SO42- +2e « PbSO4 2H2O
Если концентрация ионов водорода в растворе серной кислоты равна
Похожие работы
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... а в анодное—ионы SO42- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном—кислота. Схема электролиза раствора сульфата калия: 2K2SO4 Катод ← 4K+ 2SO42- → Анод 4K+ 2SO42- 4Н2О + 4е- =4ОН- + 4Н 2Н2О=4Н+ + 2О + 4e- KОН ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
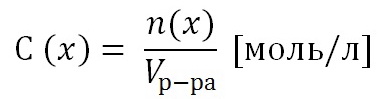


0 комментариев