Навигация
Фазовые равновесия в системе MgS-Y2S3
Диплом
Министерство общего и профессионального
образования Российской Федерации
Тюменский Государственный Университет
Химический Факультет
Кафедра неорганической химии
Дипломная работа
студентки 5 курса химического факультета
Ермачковой Елены Владимировны
Тема работы:
Фазовые равновесия в системе MgS – Y2S3
Научный руководитель:
ассистент Бурханова Т. М.
Тюмень 1999
Министерство общего и профессионального образования Российской Федерации
Тюменский Государственный Университет
Химический факультет
Кафедра неорганической химии
Дипломная работа
Тема работы:
Фазовые равновесия в системе MgS – Y2S3
Подпись декана ________________Паничева Л. П.
Подпись зав. кафедрой_____________ Кертман С. В.
Подпись руководителя_____________ Бурханова Т. М.
Подпись рецензента_______________
Подпись студента_________________ Ермачкова Е.В.
Bведение 5
Глава 1. Литературный обзор. 6
1.1. Фазовые равновесия в системе MgS-Y2S3. 6
1.1.1.Фазовое равновесие в системе Mg-S. 6
1.1.2.Фазовое равновесие в системе Y-S. 7
1.1.3.Кристаллохимическая характеристика фаз в системе Mg-S, Y‑S. 9
1.1.4.Фазовые равновесия в системе MgS –Ln2S3. 12
1.1.5. Взаимосвязь структуры и типа химической связи в сульфидах магния-лантанида с их свойствами. 16
1.2. Синтез простых и бинарных сульфидов. 18
1.2.1.Метод прямого синтеза. 18
1.2.2.Метод косвенного синтеза. 19
1.2.3.Выводы по литературному обзору. 21
Глава 2. Методическая часть. 22
2.1. Методы физико-химического анализа 22
2.1.1. Рентгенофазовый анализ. 22
2.1.2.Микроструктурный анализ. 23
2.1.3.Дюрометрический анализ. 25
2.1.4.Визуально - политермический анализ. 26
Глава 3. Экспериментальная часть. 29
3.1. Синтез веществ. 29
3.1.1. Синтез Y2S3 в потоке сульфидирующих агентов. 29
3.1.3. Синтез трехкомпонентных образцов в системе MgS – Y2S3. 32
3.1.4. Микроструктурный анализ образцов системы MgS – Y2S3. 38
3.1.4. Рентгенофазовый анализ образцов системы MgS - Y2S3 . 38
Глава 4. Фазовые равновесия в системе M S - Y2S3. Обсуждение результатов. 45
Выводы. 51
Литература. 52
Введение
Соединения с участием РЗЭ остаются по прежнему обширным резервом для создания новых материалов. Возможно создание материалов с уникальными, заранее заданными свойствами.
Взаимодействие в системах MgS – Ln2S3 изучалось Флао, Патри, Доманжем. По характеру взаимодействия все системы можно разделить на три группы. В системах для La – Gd тройные соединения не образуются. Для Tb – Er, Y в литературе указано на образование тройных соединений типа MgLn2S4, кристаллизующихся в ромбической сингонии. Для Tm – Sc фаза MgLn2S4 имеет структуру типа шпинели. Однако условия существования фаз не определены, неясен характер их плавления, протяженность областей твердых растворов не связана с температурой.
Для реализации на практике потенциальных возможностей новых материалов необходимо определить условия их существования и методы синтеза. Это позволяет сделать физико-химический анализ путем построения Т –Х – проекции диаграммы состояния, являющейся основанием для синтеза материалов.
Цель настоящей работы состоит в изучении фазовых равновесий в системе MgS – Y2S3 при использовании методов физико-химического анализа.
Глава 1. Литературный обзор. 1.1. Фазовые равновесия в системе MgS-Y2S3. 1.1.1. Фазовое равновесие в системе Mg-S.
Моносульфид MgS имеет кубическую кристаллическую структуру типа NaCl. Структура MgS образуется сочетанием довольно объемных анионов серы и значительно меньших по размерам катионов металлов. Можно предполагать, что анионы серы как более крупные по размерам имеют тенденцию к регулярному расположению в элементарных ячейках довольно тесно один возле другого; они образуют при этом пустоты, в которых располагаются катионы. Каждый ион магния окружен шестью ионами серы, расположенными в вершинах правильных октаэдров. Все пустоты, в которых периодически располагаются катионы (согласно их размерам и заряду), в структуре MgS заняты и возможность образования твердого раствора по разрезу MgS-Ln2S3 маловероятна.[1]. В системе Mg-S (рис.1) образуется единственная фаза MgS. Температура плавления составляет 2270К, при которой MgS разлагается.[2]
![]()
![]()
![]()
![]()
![]()
![]()
![]()
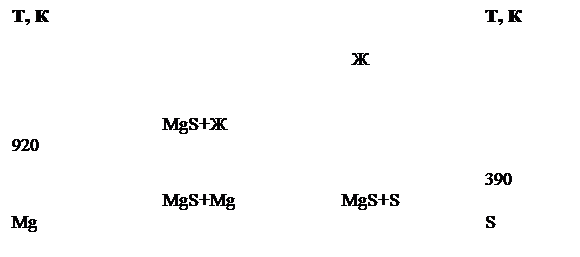 |
Рис. 1 Ориентировочная диаграмма состояния системы MgS.
Свойства MgS
MgS получают:
1. Mg+S=MgS (реакция происходит в фарфоровой трубке при 8000С).
2. 2Mg + S + H2S = 2MgS + H2
3. MgO + CS2 = 2MgS + CO2 (температура 700-9000С).
0 комментариев