Навигация
Содержание.
стр.
| 1. Химические реакции. 2. Окислительно-восстановительные реакции. 3. Реакции в растворах электролитов. 4. Представление о кислотах и основаниях. 5. Гидролиз солей. Список литературы. | 2 3 4 5 7 9 |
1. Химические реакции
Химические свойства веществ выявляются в химических реакциях. Химическая реакция заключается в разрыве одних и образовании других связей. Химическая реакция изображается в общем виде уравнением
aA + bB = cC + dD,
где вещества A и B, вступившие в реакцию, называют реагентами (или исходными веществами), а новые вещества C и D, образующиеся в результате протекания реакции, - продуктами (или конечными веществами). Целочисленные параметры a, b, c и d в уравнении реакции называют стехиометрическими коэффициентами.
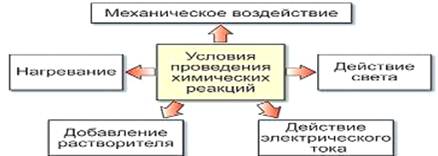
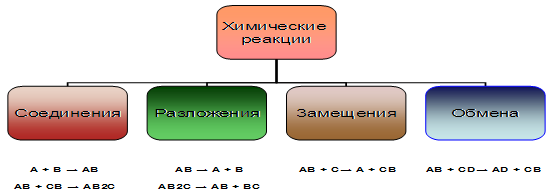
Химические реакции классифицируются различными способами:
1) По типу взаимодействия:
реакции разложения 2HgO = 2Hg + O2
реакции соединения 2Na + Cl2 = 2NaCl
реакции замещения CuO + H2 = H2O + Cu
реакции двойного обмена CaO + 2HCl = CaCl2 + H2O
Указанные типы нередко совмещаются в более сложных реакциях. Например:
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O.
Эта реакция – одновременно и реакция двойного обмена, и реакция разложения, так как промежуточно образующаяся угольная кислота H2CO3 неустойчива и разлагается на CO2 и H2O.
2) По тепловому эффекту:
экзотермические реакции, протекающие с экзо-эффектом – выделением энергии в форме теплоты (+Q):
C + O2 = CO2 + Q,
эндотермические реакции, протекающие с эндо-эффектом – поглощением энергии в форме теплоты (-Q):
N2 + O2 = 2NO – Q.
3) По направлению протекания процесса реакции подразделяются на необратимые, которые протекают только в прямом направлении и завершаются полным превращением реагентов в продукты:
AgNO3 + NaCl = AgCl¯ + NaNO3,
и обратимые реакции, которые протекают одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (т.е. реакции не идут до конца слева направо):
2SO2 + O2 « 2SO3.
Необратимость химической реакции подчёркивается в уравнении знаком равенства (=) между формулами реагентов и формулами продуктов, а обратимость реакции – специальным знаком – противоположно направленными стрелками («).
4) По изменению степеней окисления реакции подразделяются на:
протекающие без изменения степеней окисления всех элементов, входящих в исходные вещества, например
NaOH + HCl = NaCl + H2O,
и окислительно-восстановительные реакции, протекающие с изменением степеней окисления всех или некоторых (или даже хотя бы одного!) элементов, например:
2Cu0 + O0 = 2Cu2+O2-,
Cu2+O2- + H0 = Cu0 + H1+O2-,
Cl0 + 2Na1+O2-H1+ = Na1+Cl1- + Na1+Cl1+O2- + H1+O2-.
2. Окислительно-восстановительные реакции
Окислительно-восстановительные реакции – это химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ.
Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдаёт свои электроны, то он приобретает положительный заряд, например:
Zn0 – 2e = Zn2+.
Если отрицательно заряженный ион (заряд –1), например Cl-, отдаёт 1 электрон, то он становится нейтральным атомом:
Cl- - 1e = Cl0.
Если положительно заряженный ион или атом отдаёт электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:
Fe2+ - 1e = Fe3+.
Восстановление – это процесс присоединения электронов атомом, молекулой или ионом. Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:
S0 + 2e = S2-.
Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например:
Mn7+ + 5e = Mn2+,
или он может перейти в нейтральный атом:
H+ + 1e = H0,
Al3+ + 3e = Al0.
Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, а восстановитель - окисляется.
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
3. Реакции в растворах электролитов
Электролиты – это вещества, растворы которых обладают ионной проводимостью.
Поскольку электролиты в растворах образуют ионы, то для отражения сущности реакций часто используют так называемые ионные уравнения реакций. Написанием ионных уравнений подчёркивается тот факт, что, согласно теории диссоциации, в растворах происходят реакции не между молекулами, а между ионами.
С точки зрения теории диссоциации при реакциях между ионами в растворах электролитов возможны два исхода:
Похожие работы
... HСlO3 Хлораты Хлористая НClO2 Хлориты Хлорноватистая HClO Гипохлориты Хромовая H2CrO4 Хроматы Циановодородная (синильная кислота) слота) HCN Цианиды Основные типы химических реакций Среди разнообразных химических реакций можно выделить два типа, существенно отличающихся друг от друга. К первому типу реакций относятся те, в ходе которых степень окисления ...
... , т. е. к увеличению скорости реакции. Количественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики — законом действующих масс. Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Для мономолекулярной реакции скорость реакции ...
... – реакции, идущие без изменения степени окисления: S+4O4-2 + H2O → H2+ S+4O4-2 CH3NH2 + HCl → (CH3NH3)Cl Как видим, существует различные способы классификации химических реакций, из которых более подробно мы рассмотрим следующие. По признаку изменения числа исходных и конечных веществ. Здесь можно найти 4 типа химических реакций (рис.6): реакции соединения, реакции разложения, ...
... это целый класс реакций окисления органических веществ с участием катализатора, обладающего окислительно-восстановительными свойствами. Этот процесс протекает циклично т. е. состоит из многократных повторений. Колебательные химические реакции были открыты и научно обоснованы в 1951 г. советским учёным Борисом Петровичем Белоусовым. Б.П. Белоусов изучал окисление лимонной кислоты при её реакции с ...
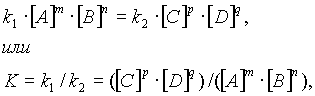
0 комментариев