Навигация
Серная кислота и экология биосферы
Муниципальное общеобразовательное учреждение
гимназия №26
Серная кислота
и экология биосферы
Реферат
Выполнила ученица 8-2 класса
Л.Глазунова
Челябинск 2004
Оглавление
Стр.
1. Производство серной кислоты....................................................................... 3
2. Свойства серной кислоты............................................................................... 4
3. Применение серной кислоты.......................................................................... 6
4. Смог – что это такое?..................................................................................... 7
5. Диоксид серы.................................................................................................. 7
6. Круговорот серы в биосфере......................................................................... 8
7. Очистка газов от SO2...................................................................................... 10
8. Контроль атмосферы в г. Челябинске............................................................ 10
9. Литература...................................................................................................... 12
1.Производство серной кислоты
Весь процесс можно разбить на три последовательных стадии: получение диоксида серы, окисление его до триоксида и поглощение триоксида серы.
Получение диоксида серы
Наиболее распространенным сырьем для получения SO2 является пирит FeS2, который подвергают обжигу:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Обжиг проводят в специальной печи. В результате обжига пирита получается обжиговый газ, который, кроме диоксида серы, содержит кислород, азот, пары воды и другие примеси. Некоторые из этих примесей вредны для последующих процессов производства кислоты, поэтому обжиговый газ подвергают тщательной очистке от твердых частиц и влаги. Осушение газа проводится концентрированной серной кислотой. Иногда в качестве сырья для получения серной кислоты используют диоксид серы, содержащийся в отходящих газах других производств или полученный сжиганием серы.
Получение триоксида серы
Вторая стадия производства серной кислоты – окисление диоксида серы кислородом воздуха до триоксида. Окисление проводят при температуре 400 – 600 градусов по Цельсию в присутствии катализаторов.
Поглощение триоксида серы
Полученный оксид серы (VI) поступает в поглотительную башню, стенки которой орошаются концентрированной серной кислотой (массовая доля H2SO4 98%). Поглощение триоксида серы водой неэффективно: образуется «туман» из мелких капелек серной кислоты, который долго конденсируется.
Конечный продукт производства – раствор SO3 в серной кислоте, называемый олеумом. Он может быть разбавлен водой до серной кислоты нужной концентрации.
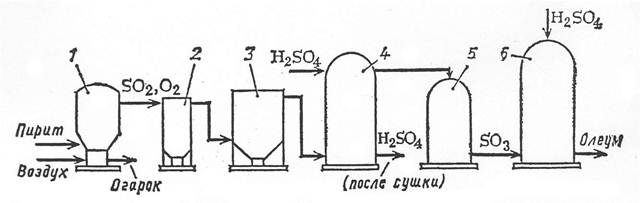
Рис. 1 Схема производства серной кислоты
1-печь для обжига; 2,3-пылеулавливатели; 4-осушительная башня; 5-контактный аппарат; 6-поглотительная башня.
2.Свойства серной кислоты
Серная кислота представляет собой бесцветную вязкую жидкость, плотность 1,83 г/мл (200С). Температура плавления серной кислоты составляет 10,30С, температура кипения 296,20С.
Химические свойства серной кислоты во многом зависит от ее концентрации. В лабораториях и промышленности применяют разбавленную и концентрированную серную кислоту, хотя это деление условно (четкую границу между ними провести нельзя).
Взаимодействие с металлами
Разбавленная серная кислота взаимодействует с некоторыми металлами, например с железом, цинком, магнием, с выделением водорода:
Fe + H2SО4 = FeSO4 + H2
Некоторые малоактивные металлы, такие как медь, серебро, золото, с разбавленной серной кислотой не реагируют.
Концентрированная серная кислота является сильным окислителем. Она окисляет многие металлы. Продуктами восстановления кислоты обычно является оксид серы (IV), сероводород и сера (H2S и S образуется в реакциях кислоты с активными металлами - магнием, кальцием, натрием, калием и др.). Примеры реакций:
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O
Mg + 2H2SO4 = Mg SO4 + SO2+ 2H2O или
4Mg + 5H2SO4 = 4MgSO4 + H2S + 4H2O
Серная кислота высокой концентрации (практически безводная) не взаимодействует с железом в результате пассивации металла. Явление пассивации связанно с образованием на поверхности металла прочной сплошной пленки, состоящей из оксидов или других любых соединений, которая препятствует контакту металла с кислотой. Благодаря пассивации можно перевозить и хранить концентрированную серную кислоту в стальной таре. Концентрированная серная кислота пассивирует также алюминий, никель, хром, титан.
Взаимодействие с неметаллами
Концентрированная серная кислота может окислять неметаллы, например:
S + 2H2SO4 = 3SO2 + 2H2O
Окислительные свойства концентрированной серной кислоты могут также проявлятся с некоторыми сложными веществами – восстановителями, например:
2KBr + 2H2SO4 = Br2 + SO2 + K2SO4 + 2H2O
Взаимодействие с основными оксидами и основаниями
Серная кислота проявляет все типичные свойства кислот. Так, она реагирует с основными и амфотерными оксидами и гидроксидами с образованием солей. Как двусоставная кислота H2SO4 образует два типа солей: средние соли – сульфаты и кислые соли – гидросульфаты. Примеры реакций:
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
сульфат алюминия
2KOH + H2SO4 = K2SO4 + 2H2O
сульфат калия
KOH + H2SO4 = KHSO4 + H2O
гидросульфат калия
Гидросульфаты образуются, когда кислота берется в избытке. Многие соли серной кислоты выделяются из растворов виде кристаллогидратов, например
Al2 (SO4)3×18H2O
Na2SO4 × 10H2O.
Взаимодействие с солями
С некоторыми солями кислота вступает в реакции обмена, например:
CaCO3 + H2SO4 = CaSO4 + CO2 + H2O
BaCl2+ H2SO4 = ВаSO4¯ + 2HCl
Последняя реакция является качественной на серную кислоту и ее соли: об их присутствии в растворе судят по образованию белого осадка BaSO4, который практически не растворяется в концентрированной азотной кислоте.
Взаимодействие с водой
При растворение в воде серная кислота активно взаимодействует с ней образуя гидраты:
nH2O + H2SO4 = H2SO4 ×nH2O
Благодаря способности связывать воду серная кислота является хорошим осушителем.
Похожие работы
... раствор после выделения соли полностью возвращается на сульфатизацию, вследствие чего существенно снижается расход серной кислоты (до 3,5—4,5 т на 1 т диоксида титана). Принципиальная схема переработки сфенового концентрата Глава 2. ИЗВЛЕЧЕНИЕ СЕРНОЙ КИСЛОТЫ ИЗ ОТХОДОВ ПРОЦЕССА ПРОИЗВОДСТВА ДИОКСИДА ТИТАНА Процесс, разработанный К. X. Дёрром предназначен для выделения серной кислоты из ...
... городе размещены предприятия нескольких отраслей промышленности, то создается очень высокий уровень загрязнения воздуха, однако проблема снижения выбросов многих специфических веществ до сих пор остается нерешенной. 4. Загрязнение природной воды- основы жизненных процессов биосферы. Вода - самое распространенное неорганическое соединение на нашей планете, основа всех жизненных процессов, ...
... поверхности направлении ощущается увеличение скорости ветра и горизонтальное движение воздуха вызывает турбулентность. Таким путем компоненты воздуха достигают Земли, и наиболее активные кислотные вещества легко взаимодействуют с поверхностью. Влияние кислотных осадков на биосферу. Кислотные осадки оказывают вредное воздействие не только на отдельные предмет или живые существа, но и на их ...
... поведении в природе, в сознании фиксируется отрицательное отношение к флоре и фауне. Это ни в какой мере не учитывает особенности детей дошкольного и младшего школьного возраста: эмоциональной восприимчивости, подражательности, непосредственности поведения. Многие выпускники начальной школы были беспомощны, когда требовалось оказание помощи, проявление заботы, внимания к объекту. Даже если дети ...




0 комментариев