Навигация
Производство синтетического аммиака при среднем давлении. Расчёт колонны синтеза
Санкт-Петербургский государственный инженерно-экономический университет
Факультет экономики и менеджмента в химической промышленности
Кафедра технологии химического
Производства
Курсовой проект
На тему:
"Производство синтетического аммиака при среднем давлении. Расчёт колонны синтеза"
Выполнил:
Студент III курса 691 группы
Боруховский Максим Михайлович
Проверил:
К.т.н., доцент Никитин Е.Е.
Санкт-Петербург
2002 г.
ВведениеНароднохозяйственное значение аммиака и его основные потребители.
Применение соединений азота в качестве удобрений определяет их первостепенное значение в жизни человечества.
В настоящее время в России потенциалом для производства синтетического аммиака обладают 18 предприятий с суммарными мощностями более 13 млн т химиката в год. Производителями аммиака являются предприятия химического комплекса, исключение здесь составляет "Новолипецкий металлургический комбинат", осуществляющий выпуск в весьма небольших количествах. При этом среди основных его продуцентов преобладают компании, использующие данный химикат во внутризаводском потреблении для производства азотных удобрений.
За три квартала 2001 г. в России было произведено 7831,7 тыс. т аммиака, что на 55,2 тыс. т или на 0,7% ниже уровня соответствующего периода 2000 г. Основным фактором сокращения производства стало снижение количества торговых операций с данным продуктом при сохранении объемов его внутризаводского потребления для выпуска азотных удобрений.
Производство синтетического аммиака в России, тыс. т
| Предприятие | Объем производства аммиака за 9 месяцев 2000 г. | Объем производства аммиака за 9 месяцев 2001 г. |
| Всего | 7886,9 | 7831,7 |
| в том числе: | ||
| АО "Тольяттиазот", г. Тольятти | 1391,7 | 1242,8 |
| Холдинговая компания "Акрон", г. Новгород | 1059,0 | 1050,0 |
| АК "Азот", г. Новомосковск | 854,2 | 847,4 |
| АО "Невинномысский Азот", г. Невинномысск | 722,6 | 747,9 |
| АО "Минудобрения", г. Россошь | 557,4 | 651,0 |
| АО "Азот", г. Череповец | 616,9 | 645,3 |
| АО "Кирово-Чепецкий химкомбинат", г. Кирово-Чепецк | 628,9 | 596,8 |
| АО "Азот", г. Кемерово | 484,1 | 497,2 |
| АО "Азот", г. Березники | 535,9 | 485 |
| АО "Куйбышевазот", г. Тольятти | 402,3 | 412,8 |
| Прочие | 633,8 | 655,5 |
Лидером в производстве синтетического аммиака в России является АО "Тольяттиазот", на долю которого приходится 15,9% от общероссийского выпуска данного продукта. Однако предприятие в 3 квартале столкнулось с определенными трудностями в сырьевом обеспечении, производство аммиака работает на минимальную мощность и это не замедлило сказаться на доле компании в общем объеме производства. Так в сравнении с показателем первого полугодия 2001 г. доля компании сократилась на 0,3 пункта. Среди других производителей крупными участниками рынка аммиака являются Холдинговая компания "Акрон", новомосковское АО "Азот" и АО "Невинномысский Азот", удельный вес которых по итогам трех кварталов составил, соответственно 13,4%, 10,8% и 9,6%
Краткая историческая справка о развитии производства синтетического аммиака
Первые попытки синтеза аммиака относятся к концу XV1IL в. В течение XIX в. было проведено много исследований в этом направлении. Пытались осуществлять эту реакцию как гомогенную газовую реакцию, применять для синтеза водород “in statu nascendi”, найти катализаторы. Все эти работы не привели к положительным результатам и, более того, не дали каких-либо указаний для дальнейших исследований. Лишь исследование обратной реакции — диссоциации аммиака показало, что при 500—780° и атмосферном давлении аммиак “е разлагается полностью. С точки зрения учения о химическом равновесии отсюда вытекала принципиальная возможность синтеза аммиака. Для увеличения выхода аммиака необходимо было применить повышенное давление, что и было сделано в 1901 г. Ле-Шателье. Опыты кончились неудачей — произошел взрыв реакционного аппарата.
В течение последующего десятилетия было количественно определено равновесие реакции (Габер, Нернст). Исследования проводились
при относительно невысоких давлениях— ниже 100 ат. Позднейшие измерения равновесия при давлениях до 1000 ат показали, что константа равновесия КР, которая для идеальных газов является функцией только температуры, существенно зависит и от давления. В табл. 25 приведены значения констант равновесия реакции синтеза аммиака при
различных температурах и давлениях, вычисленные по экспериментальным данным. Из таблицы видно, что, например, при 450° повышение давления от 10 до 1000 ат приводит к увеличению значения Кр более чем в три раза.
В дореволюционной России единственным источником технического связанного азота был коксохимический аммиак, производство которого было далеко недостаточным для покрытия потребностей в нём. Эти потребности, возросшие во время первой мировой войны, удовлетворялись за счёт импорта чилийской селитры. Для молодой России создание азотной промышленности было жизненно необходимой задачей, и поэтому уже в августе 1918 года была создана Комиссия по связанному азоту. Были проведены лабораторные исследования по изучению действия различных катализаторов на смесь азота и водорода. На урановом катализаторе были получены следы аммиака, а в феврале 1919 года на смешанном катализаторе вольфрам - молибден - окись алюминия под давлением 7,5 МПа и при температуре 605-470оС была достигнута концентрация NH3 в газовой смеси 6,55%. Эти опыты проводились в тот период, когда сведения о производстве синтетического аммиака в Германии ещё не были опубликованы. Однако из-за отсутствия газа и перебоев с электрической энергией эксперименты были прекращены.
В середине 1925 года было принято решение о строительстве первой установки синтетического аммиака на Чернореченском химическом заводе. Был создан Комитет по связанному азоту. В этом же году по поручению Комитета группа специалистов выехала за границу для ознакомлением с производством и закупки оборудования.
В течении 1926-1927 годов был построен и введён в эксплуатацию цех по производству синтетического аммиака на Чернореченском химическом заводе, 9 февраля 1928 года наша страна впервые получила синтетический аммиак.
Синтез аммиака осуществлялся под давлением 76 МПа и при температуре 450оС на железном катализаторе. Первая очередь установки синтеза аммиака состояла из трёх реакторов с внутренним диаметром 400 мм, производительность каждого агрегата составляла 8 т/сут жидкого аммиака, общая мощность установки - около 7,5 тыс. т/год.
После первого года работы цеха было принято решение о замене ранее используемого катализатора на новый - антрацид. В результате производительность увеличилось на 10-15%, это около 9 т/сут. После установки, в 1931 году, четырёх дополнительных реакторов с внутренним диаметром 450 мм производительность увеличилась до 17-19 т/сут.
Главными объектами строительства предприятий азотной промышленности в первой пятилетке стали Березниковский и Горловский азотно-туковые заводы, а так же Бобриковский химический комбинат. После введение заводов в эксплуатацию производство синтетического аммиака увеличилось в 10 раз.
В конце 30-х годов азотная промышленность заняла ведущее место в химической индустрии СССР. В 1932 году на СССР приходилось 2,25% мировой мощности производства синтетического аммиака и наша страна занимала 12-е место в мире. Накануне второй мировой войны страна уже занимала третье место.
Сельское хозяйство страны в 1945 году получило всего 624 тыс. т. минеральных удобрений против 3159 тыс. т. в 1945 году, и только в 1948 году выработка азотной продукции достигла довоенного уровня.
В 1951 году была введена в действие группа цехов на Кироваканском химическом заводе и др.
Перед азотной промышленностью встала проблема технического перевооружения. В новых проектах предусматривалось использование высокоэффективных аппаратов. Начали проектировать газогенераторы производительностью 35-50 вместо 16 м3/ч, а колонны синтеза аммиака - 180-200 вместо 50-60 т/сут. Создание укрупнённых агрегатов с автоматическим и дистанционным управлением позволили повысить производительность в несколько раз.
В 1956 году был пущен первый в нашей стране цех синтетического аммиака на базе конверсии метана коксового газа на Руставском азотно-туковом заводе, а в 1959 году на Сталиноградском химическом комбинате был осуществлён полный перевод аммиачного производства на природный газ.
Развитие производства синтетического аммиака в период 1960-1970 годов базировалось на дальнейшем совершенствовании технологических процессов и укрупнение агрегатов синтеза аммиака.
По объёму производства синтетического аммиака азотная промышленность СССР вышла на второе место. В период с 1965 по 1980 года объём производства увеличился почти в пять раз.
Производство синтетического аммиака в 1965-1980 гг, в тыс. т.
| Страна | 1965 год | 1970 год | 1975 год | 1980 год |
| США | 7806 | 11883 | 14692 | 17258 |
| СССР | 3813 | 7638 | 11998 | 16732 |
| Япония | 2162 | 3220 | 3636 | 2572 |
| ФРГ | 2023 | 2220 | 2416 | 2493 |
| Франция | 1562 | 1970 | 2367 | 2543 |
| Италия | 1252 | 1548 | 1765 | 1704 |
| Болгария | 388 | 788 | 935 | 1009 |
| Прочие | 1543 | 3496 | 5701 | 7016 |
Физико-химические основы процесса производства синтетического аммиака
Равновесие реакции синтеза аммиака
Известно несколько соединений азота с водородом: аммиак NH3, гидразин NaH4, азотистоводopодная кислота HN3. Непосредственно из элементов могут быть получены аммиак и гидразин.
Однако в условиях промышленного синтеза аммиака гидразин не образуется — синтез аммиака является простой реакцией, протекающей без образования побочных продуктов.
Гидразин образуется при участии тех же катализаторов, но при более низких температурах и больших скоростях тока азотоводородной смеси.
Связывание атмосферного азота в виде аммиака происходит по уравнению:
N2 + 3H2 = 2NH3+2Q
где Q — тепловой эффект реакции NH3
Доказано, что равновесный выход аммиака зависит от давления и температуры для азотоводородной смеси стехиометрического состава, не содержащей примесей. Так как реакция идет с требуемой для производственных целей скоростью при температуре не ниже 400—500°, то требуется давление порядка сотен атмосфер для значительного смещения равновесия в сторону образования аммиака. При отсутствии непосредственных экспериментальных данных о равновесии при высоких давлениях можно вычислить константу равновесия по методу, предложенному в 1935 г. Р. Ньютоном. Пользуясь данными о сжимаемости для 22 газов, он вычислил для них коэффициенты активности. Оказалось, что для всех газов, кроме водорода, гелия и неона, полученные значения удовлетворительно совпадают со средними значениями коэффициентов активности при одних и тех же приведенных температурах и давлениях.
Тепловой эффект реакции синтеза аммиака также зависит от температуры и давления.
Скорость реакции синтеза аммиака
Синтез аммиака из газообразных азота и водорода протекает с измеримой скоростью только при участии твердых катализаторов; это — гетерогенно-газовая каталитическая реакция.
Катализаторы.
Для реакции синтеза аммиака катализаторами являются железо, платина, осмий, марганец, вольфрам, уран, родий и другие металлы, атомы которых характеризуются незаполненным вторым снаружи электронным слоем. Особенно высокая активность обнаружена при лабораторных исследованиях у осмия и урана. Однако условия использования катализатора в лаборатории и на заводе, перерабатывающем в сутки сотни тысяч и миллионы кубических метров газа, различны. Понадобились большие усилия, чтобы найти катализаторы, удовлетворяющие производственным требованиям.
Промышленный катализатор должен быть активным при относительно низких температурах в связи с рассмотренной выше зависимостью состояния равновесия реакции от температуры. Активность катализатора должна поддерживаться на постоянном и достаточно высоком уровне в течение длительного времени. Присутствие в газе некоторых ядов, полное удаление которых является сложным и дорогим процессом, не должно оказывать существенного влияния на активность катализатора. Наконец, катализатор должен быть дешев. Этим требованиям не удовлетворяют, например, осмий, платина, уран, железо; первые два металла — активные и устойчивые катализаторы, но дороги; уран — активный катализатор, но легко отравляется водяными парами; восстановленное металлическое железо — активный и дешевый, но неустойчивый катализатор.
В поисках катализатора, наиболее отвечающего промышленным требованиям, были испытаны тысячи разнообразных материалов — почти все металлы, как сами по себе, так и в сочетании по два и по три в разнообразных пропорциях. Еще ранее было замечено, что катализаторы, состоящие из нескольких веществ, часто более активны, чем отдельные составляющие их вещества. Опыт показал, что эта закономерность проявляется и при синтезе аммиака на железных катализаторах: катализаторы для синтеза аммиака, полученные восстановлением железа из. руд различных месторождений, при почти одинаковом химическом составе отличаются по активности иногда в три-четыре раза. Эти наблюдения легли в основу дальнейших поисков. Оказалось, что катализатором, удовлетворяющим перечисленным выше требованиям, является металлическое железо с добавкой незначительных количеств окислов алюминия и калия. Такой катализатор более активен, чем чистое железо, и сохраняет свою активность в течение многих месяцев в условиях работы на промышленном газе.
Для каждого катализатора характерен определенный оптимальный температурный режим. Катализаторы, приготовленные из железа или железной руды, дают возможность вести процесс при температурах: не ниже 450° и не выше 600°. Значительно отличаются от них в этом отношении железные активированные катализаторы, полученные разложением комплексных цианистых солей, например железистосинеродистого калий-алюминия. Эти катализаторы активны уже при 400° и ниже.
Повышение активности катализатора — эффективный способ увеличения производительности аппарата. Благодаря усовершенствованию' методов получения катализаторов удалось значительно повысить производительность колонн синтеза.
При очень высоких давлениях равновесие настолько значительно смещается в сторону образования аммиака, что представляется возможным повысить температуру до 800—900°, при которой (под давлением 500 ат) реакция протекает в отсутствие специально вводимых в аппарат катализаторов. При этих условиях, повидимому, достаточно каталитического действия стенок реакционного аппарата, — в лабораторном аппарате в отсутствие катализаторов реакция протекала с большой скоростью и была достигнута высокая степень превращения исходной смеси.
Стадии реакции синтеза аммиака.
Любая реакция между газообразными веществами, протекающая на поверхности катализатора, может быть расчленена на пять последовательных стадий:
1) перенос газообразных реагирующих веществ к поверхности катализатора,
2) адсорбция
3) реакция на поверхности
4) десорбция продукта реакции с поверхности
5) перенос продукта реакции от поверхности в объем газовой фазы.
Адсорбция при гетерогенно-газовых каталитических реакциях характеризуется, в большинстве случаев, относительно высокой энергией активации и сопровождается выделением значительного количества тепла (от 10 до 100 ккал на 1 г-мол адсорбированного газа). Такая адсорбция называется активированной.
Скорость одной из перечисленных стадий может быть значительно меньше скоростей остальных стадий, и тогда эта стадия определяет скорость суммарного процесса. Какая из стадий будет медленной, зависит от свойств системы и значений внешних параметров. Иногда скорость каталитического процесса определяют стадии переноса газообразных веществ к поверхности и продуктов реакции от поверхности. Например, если газовая смесь проходит через слой катализатора с небольшой линейной скоростью, то перенос веществ к поверхности катализатора совершается медленно и может ограничивать скорость суммарного процесса — реакция характеризуется малым значением энергии активации и незначительным увеличением скорости реакции с повышением температуры. Значительно чаще скорость реакции ограничивается скоростью Адсорбции, десорбции или реакции на поверхности.
Стадии каталитического синтеза аммиака следующие. Азот и водород диффундируют из объема газовой фазы к поверхности катализатора, где протекает активированная адсорбция обоих газов. Далее адсорбированный азот вступает во взаимодействие с адсорбированным или газообразным водородом, причем последовательно образуются имид NH, амид NH2 и аммиак NH3. Последний десорбируется с поверхности и поступает в объем газовой фазы.
Обширные работы в области изучения скорости синтеза и разложения аммиака дают большой материал для теоретической химии, несмотря на то, что значительная часть их посвящена изысканиям эффективных катализаторов для промышленного синтеза и определению оптимальных условий для их применения.
Измерения скорости синтеза аммиака на железном, молибденовом и вольфрамовом катализаторах и скорости разложения аммиака на железном и медном катализаторах показали, что скорость синтеза на различных катализаторах подчиняется уравнению, указывающему на общность механизма реакции на разных катализаторах. Таким образом, кинетические измерения суммарных процессов подтверждают, что адсорбция азота и десорбция его являются ограничивающими стадиями синтеза и разложения аммиака.
Исследования скорости синтеза аммиака под повышенным давлением в изотермических условиях проводились с чистой азотоводородной смесью стехиометрического состава при давлении 300 ат, температурах 425—525°С интервалом в 25°С и при различных объемных скоростях с железным катализатором (активированным окисью алюминия и окись калия), полученным методом кислородной плавки.
При одной и той же температуре и при разных объемных скоростях значения констант скорости реакции близки между собой..
Оптимальные условия синтеза аммиака
Содержание аммиака в газе падает с увеличением объемной скорости, т. е. с уменьшением времени контактирования.
С повышением давления увеличивается равновесный выход аммиака и возрастает скорость реакции. Скорость реакции растет также с уменьшением размеров зерен катализатора.
Зная зависимость степени превращения исходной смеси от объемной скорости, температуры, давления и размеров зерен катализатора, можно определить условия, необходимые для достижения высокой производительности катализатора.
При данной объемной скорости производительность катализатора прямо пропорциональна содержанию аммиака, т. е. достигает максимума при оптимальном температурном режиме и увеличивается с повышением давления.
С увеличением объемной скорости производительность катализатора растет, потому что, как было показано выше, содержание аммиака уменьшается медленнее, чем возрастает объемная скорость.
Производительностью катализатора (G) называется вес продукта, полученного в течение одного часа с 1 м3 катализатора. Производительность катализатора выражается в кг/м3 час.
Для повышения производительности катализатора нужно увеличивать объемную скорость, что приводит к понижению содержания аммиака в газе после контакта. Это возможно только при условии, что неиспользованная азотоводородная смесь вновь направляется в колонну синтеза.
При выборе объемной скорости учитывают не только необходимость наилучшего использования катализатора, но и влияние изменения объемной скорости на производительность остальных аппаратов (входящих в агрегат синтеза аммиака), а также на расход энергии на транспорт газа и на нагревание и охлаждение газовых смесей.
Расход энергии на транспорт газа через реакционную аппаратуру пропорционален объемной скорости, а не производительности катализатора. Следовательно, с увеличением объемной скорости расход энергии по этой статье на 1 т аммиака увеличивается.
Выделение аммиака из газовой смеси производится обыкновенно его конденсацией. Так как с увеличением объемной скорости уменьшается парциальное давление аммиака, то для того, чтобы сконденсировать аммиак, газ должен быть охлажден до более низкой температуры.
Количество тепла, выделяющееся при реакции в единицу времени на единицу объема катализатора, пропорционально производительности катализатора. Поэтому с увеличением объемной скорости количество тепла, приходящееся на 1 м3 газа, уменьшается.
При заданной температуре газа на выходе из аппарата количество уносимого газами тепла возрастает прямо пропорционально объемной скорости.
Выбор объемной скорости в каждом отдельном случае может быть сделан только на основании разностороннего анализа процесса. Повышение производительности путем увеличения объемной скорости ограничивается, в первую очередь, требованием вести процесс без затраты тепла извне.
Первое время при производстве синтетического аммиака работали с небольшими объемными скоростями (5000—10000), теперь перешли к скоростям 30 000—60 000 нм3/м3 час.
Таким образом, для достижения более высокой производительности необходимо проводить процесс при высоких давлениях и оптимальном для данного катализатора температурном режиме, при больших объемных скоростях и на возможно более чистом газе.
Краткое описание технологической схемы производства аммиака
Из предыдущего ясно, что для достижения высокой производительности аппарата процесс синтеза аммиака следует вести, не стремясь к получению равновесных выходов. Напротив, надо пропускать газ с такой объемной скоростью, при которой выходящая из аппарата газовая смесь далека от состояния равновесия и содержание аммиака в ней невелико. Поэтому необходимо, выделив аммиак из газа, вновь направить азотоводородную смесь на синтез, что может быть осуществлено двумя приёмами. Можно соединить последовательно ряд агрегатов для синтеза аммиака, пропуская газ через все агрегаты (схема с открытой цепью). Каждый агрегат состоит из колонны синтеза, холодильника (в котором газ охлаждается и конденсируется аммиак) и газоотделителя для разделения газа и жидкого аммиака. Можно проводить процесс в одном агрегате, направляя азотоводородную смесь после выделения аммиака и добавки к ней соответствующего количества свежей смеси обратно в колонну синтеза. Такой циклический процесс благодаря своим преимуществам, прежде всего компактности и простоте регулирования, применяется в настоящее время почти на всех установках.
Первой стадией процесса является сжатие азотоводородной смеси до давления, под которым осуществляется процесс синтеза аммиака. В настоящее время в производстве синтетического аммиака применяются давления от 100 до 1000 ат. Расход энергии на сжатие смеси незначительно возрастает с повышением давления, так как работа сжатия приблизительно пропорциональна логарифму отношения давлений.
Сжатый газ после компрессора проходит через фильтр, где очищается от масла.
Второй стадией процесса в ряде способов синтеза аммиака является дополнительная очистка азотоводородной смеси от ядов: окиси углерода, кислорода и водяных паров. Напомним, что смесь, полученная описанными выше способами, содержит эти примеси в количествах, измеряемых тысячными или сотыми долями процента. Дополнительная очистка производится каталитическим способом.
Она осуществляется различными методами, например путем гидрирования:
СО + ЗН3 = СН4 + Н2О
О2+2Н2 = 2Н2О
Эти реакции идут при повышенном давлении и температуре 300—350° в присутствии специального катализатора. При последующем охлаждении газа большая часть водяных паров, образовавшихся в так называемой колонне предкатализа, конденсируется и удаляется.
Хотя метан не является ядом для катализатора синтеза аммиака, но повышение его содержания в газе понижает парциальное давление реагирующих веществ и, следовательно, производительность. Поэтому каталитический способ очистки применяется лишь для удаления незначительных количеств окиси углерода и кислорода. Содержание окиси углерода и водорода в газовой смеси, поступающей в колонну предкатализа, очень мало. Поэтому процесс не может протекать автотермично и необходим постоянный подвод тепла для поддержания в аппарате требуемой температуры. Процесс можно провести автотермично, если выбрать такие условия для предкатализа, при которых частично реагирует и азотоводородная смесь. Сжатая и очищенная азотоводородная смесь направляется далее вместе с циркуляционным газом в колонны синтеза аммиака.
Следующей операцией является выделение из газа аммиака путем конденсации. Температура, до которой нужно охладить газ, чтобы сконденсировать аммиак, зависит от давления.
Количество аммиака, остающегося в газе при данной температуре конденсации, обратно пропорционально общему давлению, что позволяет, применяя для синтеза аммиака давление 750—1000 ат, достигать удаления 80—90% аммиака из газа охлаждением его в водяных холодильниках. При меньших давлениях газ приходится охлаждать дополнительно в аммиачных холодильниках до температуры от 0° до —55° (в зависимости от давления). В аммиачном холодильнике используется производимый на установке жидкий аммиак, который после испарения направляется в газообразном виде в перерабатывающие цехи.
Освобожденная в той или иной степени от аммиака азотоводородная смесь после добавления к ней свежего газа возвращается в колонну синтеза. Для циркуляции газов применяются в большинстве случаев циркуляционные насосы, компенсирующие падение давления в системе (перепад давления измеряется 10—20 ат). В системах высокого давления иногда взамен циркуляционных насосов применяются инжекторы. Свежий газ подводится к инжектору под давлением, превышающим давление циркулирующего газа я а 10 — 15 ат.
Регулирование состава газовой смеси
Азотоводородная смесь содержит не участвующие в реакции примеси (аргон и др.). Их содержание в свежей смеси зависит от метода ее получения. Если эти примеси тем или иным путем не выводятся из цикла, то при циркуляции газовой смеси через систему синтеза аммиака инертные примеси накапливаются, режим нарушается и производительность колонны падает. Например, по лабораторным данным при объемной скорости 30 000 час"1, давлении 300 ат, температуре 500° и при чистой азотоводородной смеси содержание аммиака в газе после катализатора равнялось 18,6%. При тех же условиях, но при содержании в смеси 10% метана содержание аммиака снизилось до 14,8%. Примерно так же влияет и примесь аргона.
Инертные примеси частично растворяются в аммиаке; однако этого в большинстве случаев недостаточно и необходимо также выпускать часть циркулирующей смеси из цикла. При установившемся процессе количество инертных примесей, которое выводится из цикла, равняется количеству инертных газов, поступающему в цикл со свежим газом. Количество азотоводородной смеси, которое должно быть выведено из цикла при производстве 1 т аммиака (без учета растворения инертных газов в жидком аммиаке), составляет:
Для удаления инертных газов иногда прибегают также к промыванию газа растворителями.
Смена катализатора
Катализатор в результате реакции не изменяется химически, но практически он “стареет” в процессе работы, активность его понижается и в конце концов приходится его заменять. В большинстве технических процессов на весовую единицу катализатора за срок его службы получаются тысячи весовых единиц продукта.
Явление “старения” может быть объяснено действием ядов и изменением поверхности катализатора. Так, например, восстановленное металлическое железо является активным катализатором для реакции синтеза аммиака. Однако по прошествии незначительного срока работы при 400 — 500° его активность быстро падает. Это явление можно поставить в связь с изменениями, наблюдаемыми рентгенографическими методами и показывающими, что в процессе работы произошли оплавление поверхности и рост крупных кристаллов.
“Старение” катализатора неизбежно, но длительность службы его е большой степени зависит от режима эксплуатации. Так, для катализатора с развитой поверхностью очень вреден нагрев его выше определенной температуры, приводящий обыкновенно к значительному понижению активности.
При хорошей очистке азотоводородной смеси и при соблюдении технологического режима смена катализатора производится в зависимости от системы синтеза через один-два года.
Материальный баланс
Исходные данные для расчёта представлены в таблице.
| Параметр | Значение |
| Производительность | 250 т в сутки |
| Объемная скорость смеси в колонне | 25 000 нм3/м3*час |
| Давление в синтез колонне | 300 атм |
| Температура синтеза | 500 С0 |
| Обьем катализатора в колонне | 4,8 м3 |
| Содержания аммиака в газе на выходе из колоны синтеза | 16 % |
| Содержания газов метана и аргона в свежем газе | 0,2% |
| Содержания газов метана и аргона в циркуляционном газе при выходе с клоны синтеза | 2,5% |
| Температура первичной конденсации | 28 С0 |
| Температура вторичной конденсации | 0 С0 |
1.Производительность агрегата в час
250000/24=10416 кг/час
Дальнейший расчет производим на часовую производительность
2.Полезная производительность 1м3 катализатора в час
10416/4,8=21,7 кг/час на 1м3 катализатора
3.При объемной скорости на входе 25000 нм3 /ч на 1 м3 катализатора объемная скорость на выходе составит около 22000 нм3 /ч на 1 м3 катализатора . При 500 С0 и 300 ат содержание аммиака в газе в лабораторных условиях 22 %
4.Содержание аммиака в газе ,поступающем в колонну синтеза , определяется условиями вторичной конденсации 0 С0 и давлении 280 ат концентрация аммиака определяется по формуле Ларсона и Блека:
lg4 CNH3=4,1856+5,987879/(P)1/2-1099.544/T=
=4,1856+5,987879/(2802-1099.544/273,15=0.5
4 CNH3=3.16%
5. Эффективное давление в колонне находим по уравнению
Pэф = 300 * (1 – 0,025) * (1 – 0,0316) = 283 ат
6. При 300 ат. и 5000С равновесная концентрация аммиака 26,44%, а при 283 ат она равна 25%.
7. Поправочный коэффициент на снижение эффективного давления. – 25/26,44 = 0,946
8. Концентрация аммиака на выходе из колонны с учётом поправочного коэффициента
CNH3=0,946 * 22 = 20,8%
9. Производительность 1 м3 катализатора. На каждый кубический метр катализатора поступает W нм3/ч газовой смеси.
Формула для определения количества образовавшегося в колонне аммиака имеет вид –
(6 СNH3-4СNH3-)*0.7710/100+1.03*6 СNH3кг NH3 на 1 нм3 поступающей газовой смеси.
Отсюда рпи поступлении 4 W нм3/ч газовой смеси производительность катализатора (в расчете на 1 м3) составит
(20,8—3,16)*25000*0,7710/100+1,03*20,8=2808 кг/ч
10.Для получения 10416 кг аммиака в колонну должно поступать газовой смеси
4v =10416(100+1,03*20,8)/(20,8-3,16)*0,7710=92736,3 нм3
11.Состав поступающей газовой смеси..По условию ,в газовой смеси,поступающей в колонну синтеза ,содержится 2,5 % аргона и метана.
Допустим ,что
4 САr= 1.05 и 4 CCH4=1,45
Концентрация аммиака 3,16% .Тогда сумма водорода и азота будет
100-(1,05+1,45+3,16)=94,3%
Допускаем,что на входе в колонну соотношения водорода и азота соответствует стехиометрическому, а с учетом нескольких больших потерь водорода по сравнению с азотом -3,007:1.Таким образом; концентрация азота
4СN2= 94.3/3.007+1=23.7
Водорода
4СH2= 94,3-23,7=70,6
В поступающем газе содержится :
Аммиака 4 vNH3=4v*4 vNH3=92736,3*0,0316=2930,5 нм3,или 2256,5кг
Водорода 4 vH2=92736,3*0,706 =65472 нм3,или 5827 кг
Азота 4 vN2=92736,3*0,237=21978,4 нм3,или27473 кг
Аргона 4 vАr 92736,3*0,0105=973 нм3или 1733 кг
Метана 4 vСH4=92736,3*0,0145=1344,6 нм3,или 964 кг
Общая масса газов -38254 кг
12.Состав газовой смеси после колонны синтеза. По условию ,в колонне синтеза образуется 10416 кг ,или 13527 нм3,тогда по реакции
x y 10416
N2 +3 H2 – 2NH3
28 32 2*17
X=28*10416/2*17=8577.9(кг)- количества азота или 6862 нм3 азота
У=10416*3*2/2*17=1839,1 (кг)- количества водорода или 20653 нм3водорода
В газовой смеси на выходе из колонны содержится
Аммиака------------2256,5+10416=12672,5 кг или 2930,5+13527=16457,5 нм3
Водорода------------5827-1838,1=3988,9 кг или 65472-20653=44919 нм3
Азота-----------------27473-8577,9=18895,1 кг или 21978,4-6862=15116,4 нм3
Аргона -------------- 1733 кг или 973 нм3
Метана-------------- 964 кг или 1344,6 нм3
Общий объем газовой смеси—78710,5 нм3
13.Количество аммиака ,конденсирующегося в водяном холодильнике, и количество растворенных в нем газов .В газовой смеси , при температуре 28 и давлении с учетом потерь 290 атм ,должно содержатся 7,66 NH3
Объем газов ,кроме NH3, 78710,5-16457,5=62253 нм3
Объем газообразного NY3 62253*7,66/100-7,66=476858/92,34=5164,15 нм3
Конденсируется 16457,5-5164,15=11293,35 нм3,или 8696 кг NH3
Общий объем несконденсировавшихся газов : 62253+5164,15=67417,15 нм3
Парциальные давления газов( в ат)
H2----------290*44819/67417,15=192,8
N2-----------290*15116,4/67417,15=65
Ar-----------290*973/67417,15=4,19
СH4---------290*1344,6/67417,15=5,79
При 280 С и найденных парциальных давления в 1000 кг жидкого NH3 растворяется 19,57 нм3 водорода, 6,35 нм3 азота ,0,65 нм3 аргона 1,72 нм3 метана.
Тогда в 8696 кг NH3, растворяется ;
Водорода ------8696*19,57/1000=170 нм3
Аргона-----8696*0,65/1000=5,65 нм3
Азота----------8696*6,35/1000=55,2 нм3
Метана------8696*1,72/100=15 нм3
Остается в газообразном виде ;
H2----------44819-170=44649 нм3
N2-----------15116,4-55,2=15061,2 нм3
Ar-----------973-5,65=967,36 нм3
СH4---------1344,6-15=1329,6 нм3
Общий объем газов -62007,15 нм3
Объем NH3 ,присутствующий в газообразном виде 62007,15*7,66/100-7,66=5144 нм3 или 3961 кг
Конденсируется 16457,5-5144=11313,5 нм3 или 7603,5 NH3
Общий объем газов : 62007,15 +5144=67151,15 нм3
Парциальные давления газов (в ат):
H2----------290*44649/67151.15=192.9
N2-----------290*15061,2/67151,15=65
Ar-----------290*967,35/67151,15=4,17
СH4---------290*1329,6/67151,15=5,74
Таким образом, после водяного холодильника паро-жидкостная смесь имеет следующий состав
| Компонент | жидкость | газ | |||
| кг | нм | кг | нм | % по объему | |
| Аммиак | 7635 | 11313,5 | 3961 | 5144 | 7,66 |
| Водород | 15,13 | 170 | 3974 | 44649 | 66,5 |
| Азот | 69 | 55,2 | 18826,5 | 150261,2 | 22,4 |
| Аргон | 9 | 5,05 | 1722 | 967,35 | 1,4 |
| Метан | 11 | 15 | 953 | 1329,6 | 2,04 |
| Всего | 8815,13 | 11558,75 | 29439,5 | 67151,6 | 100 |
14 Количество газов,растворенных в жидком аммиаке ,вторичной конденсации .Принимаем ,что из 10416 -7635=1705 кг NH3,которые ещё должны быть выделены ,92,5%
выводятся из системы в испаритель жидком виде .При этом допущении в виде ждкости выводится 1705*0,925=1577 кг NH3
Ориентировочно можно принять ,что в таком количестве NH3 растворится 17 нм3 H2, 6 нм3 N2, 1 нм3 Ar, 3 нм3 СH4
15.Количество продувочных газов . Для получения 10416 кг NH3 нужно 20653 нм3 H2 и 6862 нм3 N2.Всего надо 27515 нм3 смеси H2 и N2. или
27515*100/74,29+24,75=27781 нм3 свежей водородной смеси
Обозначим резервный объем через х .Тогда общий объем свей смеси
27 781+ x, где
H2----------20650+x*0.7429 нм3
N2-----------6965+x*0.2475 нм3
Ar-----------104+x*0.0038 нм3
СH4--------162+x*0.0058 нм3
Всего 27781+х
Из этого количества расходуется на синтез аммиака и удаляется с растворенными газами.
20653+170+17=20840 нм3 водорода
6862+55,2+6=6932,2 нм3азота
5,65+1=6,65 нм3аргона
15+3=18 нм3 метана
При продувке должно быть удалено :
20650+x*0.7429 нм3-20840= x*0.7429-190 нм3 водорода
6965+x*0.2475 нм3-6923,2= x*0.2475-58,2 нм3 азота
104+x*0.0038 нм3-6,65= x*0.0038 +97,35 нм3аргона
162+x*0.0098 нм3-18= x*0.0058+144 нм3 метана
Обозначим общий объем продувочных газов через у .Тогда количество удаляющихся газов:
Аммиака---у*0,0766 нм3
H2----------у*0,665 нм3
N2-----------у*0,224 нм3
Ar-----------у*0,014 нм3
СH4--------у*0,0204 нм3
Приравниваем количество продувочных газов ,выраженных через х и у .
Получим
для H2---------- x*0.7429-190= у*0,665 нм3
для N2----------- x*0.2475-58,2 нм3= у*0,224 нм3
для Ar----------- x*0.0038 +97,35= у*0,014 нм3
для СH4-------- x*0.0058+144 нм3= у*0,0204 нм3
x*0.7429-190= у*0,665 x*0.2475-58,2 нм3= у*0,224
x*0.0038 +97,35= у*0,014x*0.0058+144 нм3= у*0,0204
у=9275 нм3 у1=9563 нм3
х=8558 нм3 х1=8890 нм3
Определим среднее значение х=8724 нм3
У=9419 нм3
В объеме 9419 нм3 содержится
NH3—0,0766*9419=721 нм3 или 555,5 кг
H2—0,665*9419=6263 нм3 или 557,4 кг
N2---0,224*9419=21709 нм3 или 2637 кг
Ar—0,014*9419=131 нм3или 234 кг
СH4—0,0204*9419=192 нм3 или 137,7 кг
16.Количество циркулирующего газа :
NH3—5144-721=4423 нм3 или 3961-555,5=3405,5 кг
H2—44649-6263=38386 нм3 или 3974-557,4=3416,6 кг
N2---15061,2-2109=1295,2 нм3 или 18826,5-5637=16189,5 кг
Ar—967,35-131=833,35 нм3 или 1722-234=1488 кг
СH4—1329,6-192=137,6 нм3 или 953-137,7=815,3 кг
17.Количество свежей азотно-водородной смеси, подающийся на синтез.
Общий объем 27781+8874=36505 нм3
В ней содержится
H2—0,7429*36505=27120 нм3 или 2413 кг
N2---0,2475*36505=9035 нм3 или 11293 кг
Ar—0,038*36505=138,71 нм3 или 246,9 кг
СH4—0,0058*36505=211,72 нм3 или 151,8 кг
8000 нм3 -1 кг H2О
36505 нм3-х кг H2О х=36505*1/8000=4,56 или 6,08 нм3 паров воды
18.Количество водородной смеси после смещения циркулирующего и свежего газов;
NH3—4423 нм3 или 3405 кг
H2—38386+27420=65506 нм3 или 3416,6+2413=5829,6 кг
N2—12952,2+9035=21987,2 нм3 или 16189,5+11293 кг=27482,5
Ar—836,35+138,71=975,06 нм3 или 246,9+1488=1734,9 кг
СH4—1137,6+211,72=1349,32 нм3 или 151,8+815,3=967,1 кг
Общий объем газов – 94241 нм3
Похожие работы
... с циркуляционным газом, который поджимается до рабочего давления в компрессоре 2. Газовая смесь проходит через адсорбер. Высшие спирты Рис. 1. Технологическая схема производства метанола при низком давлении: 1 — турбокомпрессор, 2 — циркуляционный компрессор, 3, 7 —холодильники, 4 — сепаратор, 5 — адсорбер, 6 — реактор адиабатического действия, б — ...
... процесса, более высокий выход спирта. Недостатками прямой гидратации является частая замена катализатора и использование более дорогих концентрированных этиленовых фракций. Процесс синтеза этилового спирта прямой гидратацией этилена технически более прогрессивен, чем сернокислотной гидратацией, поэтому он получил значительно большее распространение в промышленности. Характерной особенностью ...
... 10 – 12 тонн картофеля или 8 тонн древесных опилок. Трудовые затраты в человеко-часах при производстве этанола из разных источников составляют: из картофеля 280, из зерна 160, из этилена 10. Для получения синтетического этанола сырьём служит этилен, который подвергают сернокислотной гидратации или гидратации на твёрдых фосфорно-кислотных катализаторах (прямая гидратация): С2Н4 + Н2SO4 → ...
... отходы 1270,22 6,3511 2095,863 1,945 5. Потери 659,973 3,299865 1088,955 1 Итого 65997,3 329,9865 108895,5 100 4. Разработка контроля и автоматики технологического процесса производства поливинилхлорида Применение методов и средств автоматизации позволяет повысить производительность труда, уменьшить брак и потери. Конечной целью автоматизации является создание полностью ...
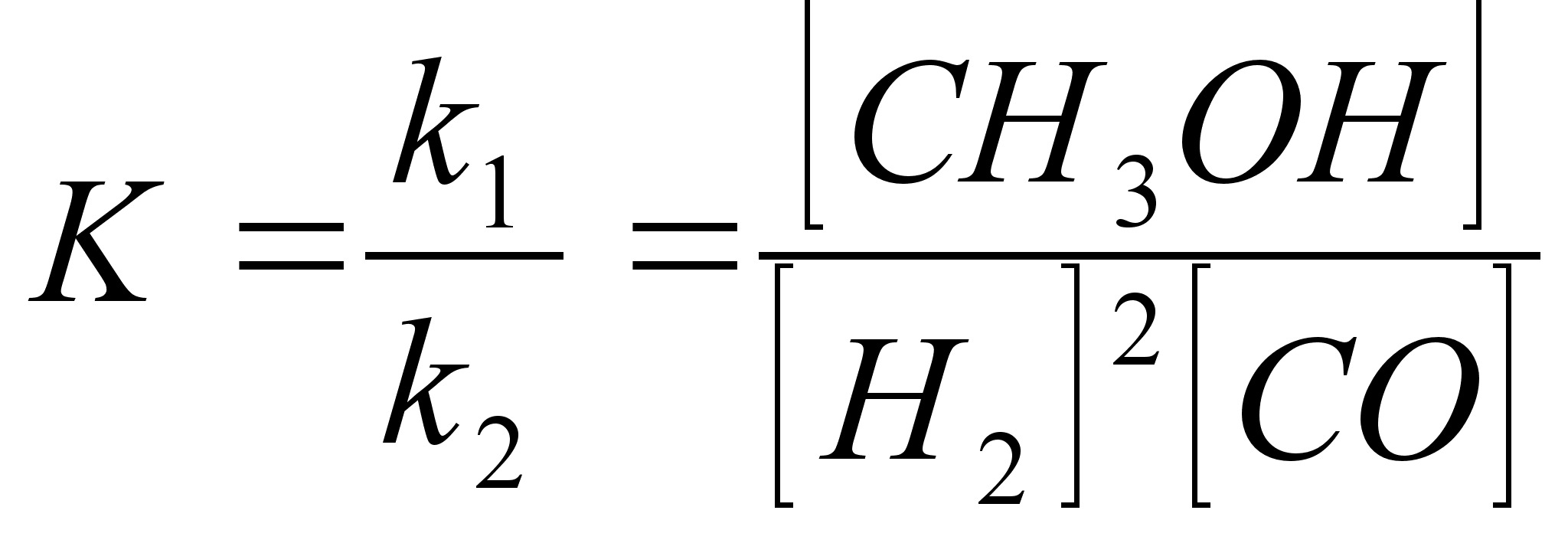



0 комментариев