 бщая характеристика Физические свойства. H
бщая характеристика Физические свойства. HH F-Фторная -F-фторная В –Не пробуют
HBr-Бромная -Br-бромная З – Нет.Н2S-Cероводородная =S-сероводороднаяРастворимость в H2O – растворимая (Н2SiO3-нерасворимая)
НNO3-Азотная -NO3-азотная
НSO3-Cернистая =SO3-сернистая
Н2SO4-Cерная =SO4-серная H2SiO3-Кремниевая =SiO3-кремниевая Н3РО4-Фосфорная PO4-фосфорная Н2СО3-Угольная -CO3-угольная (Количество атомов водорода в кислоте определяется валентностью Кис.Ост.НХ) (Кислотный остаток сохраняется постоянной хим. реакции). Кислоты НХКОКлассификация (О) Химические свойства
К ислородсодержащие Бескислородные 1.Изменяют цвет индикаторов
ислородсодержащие Бескислородные 1.Изменяют цвет индикаторов
HNO3;H2SO3;H2SO4;H2SiO3;H2CO3;H3PO4. HCl;HI;HF;HBr;H2S. ф\ф(безцветный) ф\ф(не изменяется)
![]() Кислоты (Н) Н м\о (оранжевый) м\о (красный)
Кислоты (Н) Н м\о (оранжевый) м\о (красный)
Одноосновные трехосновные лакмус (синий) лакмус (красный)
HCl;HI;HF;HBr;HNO3. двухосновные H3PO4 2.Реагирует с металлами (до Н)
H2S;H2SO3;H2SO4; НХКО+Ме=МеКО+Н2
H2SiO3;H2CO3. 2НСl+Zn=ZnCl2+H2
Получение. 3.HXKO+MeO=MeKO+H2O
неМеО+Н2О=НХКО Н2+неМЕ=НХКО НХКО+соль=НХКО+соль H2SO4+CuO=CuSO4+H2O
Н2+I2=2HIсильные кислоты бесцветная чёрный синяя бесцветная
(H2SO4;HCl;HNO3;H3PO4) 4.с Ме(ОН)Х
H2SO4+BaCl2=BaSO4+2HCl НХКО+Ме(ОН)Х=МеХКО+Н2О
НИЙТРОЛИЗАЦИЯ
К
 лассификация. Физические
свойства.
лассификация. Физические
свойства. ![]()
![]()
![]()
![]()
![]()
![]() Оксиды Оксиды
Оксиды Оксиды
О![]()
![]()
![]()
![]() сновные Амфотерный Кислотные
неМеО CO;
NO;
N2O H2O BaO SO3
сновные Амфотерный Кислотные
неМеО CO;
NO;
N2O H2O BaO SO3
Na2O Al2O3В – Нет, не пробуют
CaO B2O З – Нет, специфический, не пробуют.
BaO ZnO Растворимость в H2O - различна
![]()
![]() Fe(OH)3. СО2+СаО=СаСО3
Fe(OH)3. СО2+СаО=СаСО3
Al(OH)3tAl2O3+3H2O
![]()
К
 лассификация. Физические свойства.
лассификация. Физические свойства. ![]()
![]()
![]() Основания Твёрдые вещества
Основания Твёрдые вещества
LiOH; NaOH; KOH; Сu(OH)2; Al(OH)3; В –Не пробуют
Ca(OH)2; Ba(OH)2; Mg(OH)2 Zn(OH)2; Fe(OH)2; З – Нет.Щёлочи Fe(OH)3.Растворимость в H2O – различна
Г![]() идроксид Ме(вал)
идроксид Ме(вал)
1.Ме(актив)+H2O=Me(OH)X+H2 1.Основания изменяют цвет индикаторов
2Щелочь лакмус (синий)синий
СаО+Н2О=Са(ОН)2 2.Ме(ОН)х+кислотысоль+Н2О
3.Соль+щёлочь=Ме(ОН)+соль Ca(OH)2+2HCl=2H2O+CaCl2
СuSO4+KOH=K2SO4+Cu(OH)2 3.Ме(ОН)х+соль1(Ме-неакт)=Ме(ОН)х+соль2
Голубого цвета 2КОН+СuSO4=Cu(OH)2+K2SO4 4.Me(OH)X+неМе=соль+Н2О 5.Нерастворимые основания разлагаются Ме(ОН)ХtCМеО+Н2ОCu(OH)2tCCuO+H2O
2Al(OH)3t CAl2O3+3H2O
О
 бщая характеристика: Физические свойства:
бщая характеристика: Физические свойства: ![]()
![]()
![]() НН2О 1) Земная кора (1%) Г Ц - безцветный
НН2О 1) Земная кора (1%) Г Ц - безцветный
Х.Э. Н2SO4 2) Живые организмы (6,5%) А В - (нет)
Ar (H)=1 3) Вселенная (92%) З З - (нет)
4) H2O
1)Легче воздуха
1761г. Открыт в Англии Генри Кавендиш 2) Малорастворим в Н2О 3) Горюч Н2 Простое вещество водород Mr (H)=22Н2О=2Н2+О2 F2+H2=2HF (фтороводород)
Гидрид – соединение водорода с металлами
![]() II Реагирует со сложными веществами
II Реагирует со сложными веществами
![]() H2+CuO Cu +H2O
H2+CuO Cu +H2O
Восстановитель
Восстановитель-реакция восстановления-реакция замешения.
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
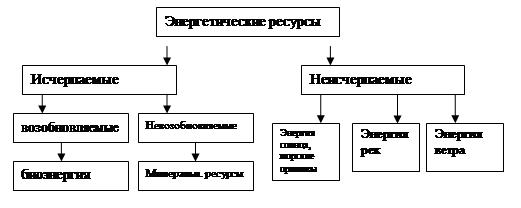
... период многие страны приняли решение о полном или постепенном отказе от развития атомной энергетики. 1.3 Особенности альтернативной водородной энергетики Водородная энергетика включает следующие основные направления: Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды; ...
... подкрепляет своим одобрением неправильный или не вполне точный ответ ученика. 1.2 Совершенствование школьного химического эксперимента при проблемном обучении 1.2.1 Принципы разработки методической системы и содержания опытов по химии в системе проблемного обучения Характерной особенностью развивающего обучения является широкое использование проблемного подхода, который включает создание ...
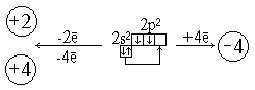

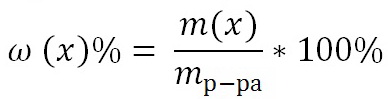
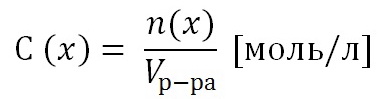
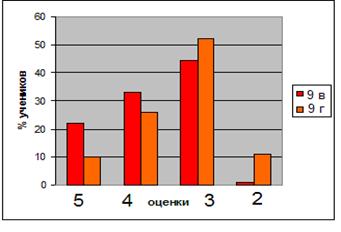
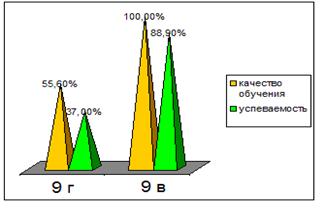

0 комментариев