Навигация
Уравнение состояния. 2. Уравнение Менделеева—Клапейрона. 3. Процессы в газах. 4. Изопроцессы. 5. Графики изопроцессов
1. Уравнение состояния. 2. Уравнение Менделеева—Клапейрона. 3. Процессы в газах. 4. Изопроцессы. 5. Графики изопроцессов.
Состояние данной массы полностью определено, если известны давление, температура и объем газа. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа единичное состояние газа описывается уравнением Менделеева— Клапейрона: pV = mRT/M, где р — давление, V —
объем, т — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 Дж/моль • К).
Уравнение Менделеева—Клапейрона показывает, что возможно одновременно изменение пяти параметров, характеризующих состояние идеального
газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра из пяти. Особую роль в физике и технике играют три процесса: изотермический, изохорический и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
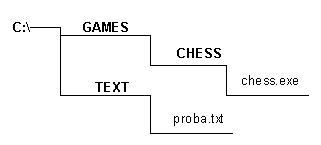
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля-Мариотта. pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля. V = const. p/T = const.
И
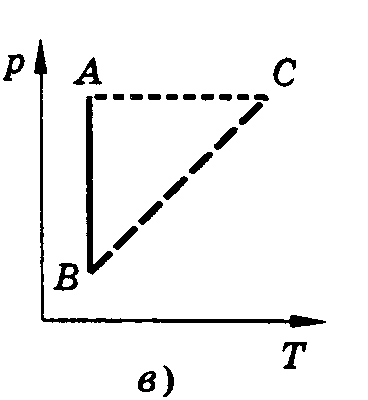
 зобарным
называют процесс,
протекающий
при постоянном
давлении. Уравнение
этого процесса
имеет вид
V/T ==
const при р =
const и называется
законом Гей-Люссака.
Все процессы
можно изобразить
графически
(рис. 11).
зобарным
называют процесс,
протекающий
при постоянном
давлении. Уравнение
этого процесса
имеет вид
V/T ==
const при р =
const и называется
законом Гей-Люссака.
Все процессы
можно изобразить
графически
(рис. 11).
рис.11
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
Билет №9
Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха. Измерение влажности воздуха
План ответа
1. Основные понятия. 2. Водяной пар в атмосфере. 3. Абсолютная и относительная влажность. 4. Точка росы. 5. Приборы для измерения влажности.
Испарение — парообразование, происходящее при любой температуре со свободной поверхности жидкости. Неравномерное распределение кинетической энергии теплового движения молекул приводит к тому, что при любой температуре кинетическая энергия некоторых молекул жидкости или твердого тела может превышать потенциальную энергию их связи с другими молекулами. Большей кинетической энергией обладают молекулы, имеющие большую скорость, а температура тела зависит от скорости
движения его молекул, следовательно, испарение сопровождается охлаждением жидкости. Скорость испарения зависит: от площади открытой поверхности, температуры, концентрации молекул вблизи жидкости. Конденсация — процесс перехода вещества из газообразного состояния в жидкое.
Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала испарения концентрация вещества в газообразном состоянии достигнет такого значения, при котором число молекул, возвращающихся в жидкость, становится равным числу молекул, покидающих жидкость за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называют насыщенным паром. (Паром называют совокупность молекул, покинувших жидкость в процессе испарения.) Пар, находящийся при давлении ниже насыщенного, называют ненасыщенным.
Вследствие постоянного испарения воды с поверхностей водоемов, почвы и растительного покрова, а также дыхания человека и животных в атмосфере всегда содержится водяной пар. Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара. Давление водяного пара будет максимальным при насыщении воздуха паром. Насыщенный пар в отличие от ненасыщенного не подчиняется законам идеального газа. Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Эта зависимость не может быть выражена простой формулой, поэтому на основе экспериментального изучения зависимости давления насыщенного пара от температуры составлены таблицы, по которым можно определить его давление при различных температурах.
Давление водяного пара, находящегося в воздухе при данной температуре, называют абсолютной влажностью, или упругостью водяного пара. Поскольку давление пара пропорционально концентрации молекул, можно определить абсолютную влажность как плотность водяного пара, находящегося в воздухе при данной температуре, выраженную в килограммах на метр кубический (р).
Большинство явлений, наблюдаемых в природе, например быстрота испарения, высыхание различных веществ, увядание растений, зависит не от количества водяного пара в воздухе, а от того, насколько это количество близко к насыщению, т. е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром.
П![]() ри
низкой температуре
и высокой влажности
повышается
теплопередача
и человек
подвергается
переохлаждению.
При высоких
температурах
и влажности
теплопередача,
наоборот, резко
сокращается,
что ведет к
перегреванию
организма.
Наиболее
благоприятной
для человека
в средних
климатических
широтах является
относительная
влажность
40—60%. Относительной
влажностью
называют отношение
плотности
водяного пара
(или давления),
находящегося
в воздухе при
данной температуре,
к плотности
(или давлению)
водяного пара
при той же
температуре,
выраженное
в процентах,
т. е. = р/р0 • 100%, или
(р = р/р0 • 100%.
ри
низкой температуре
и высокой влажности
повышается
теплопередача
и человек
подвергается
переохлаждению.
При высоких
температурах
и влажности
теплопередача,
наоборот, резко
сокращается,
что ведет к
перегреванию
организма.
Наиболее
благоприятной
для человека
в средних
климатических
широтах является
относительная
влажность
40—60%. Относительной
влажностью
называют отношение
плотности
водяного пара
(или давления),
находящегося
в воздухе при
данной температуре,
к плотности
(или давлению)
водяного пара
при той же
температуре,
выраженное
в процентах,
т. е. = р/р0 • 100%, или
(р = р/р0 • 100%.
Относительная влажность колеблется в широких пределах. Причем суточный ход относительной влажности обратен суточному ходу температуры. Днем, с возрастанием температуры, и следовательно, с ростом давления насыщения относительная влажность убывает, а ночью возрастает. Одно и то же количество водяного пара может либо насыщать, либо не насыщать воздух. Понижая температуру воздуха, можно довести находящийся в нем пар до насыщения. Точкой росы называют температуру, при которой пар, находящийся в воздухе, становится насыщенным. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара. Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами.
Похожие работы
... в широкую практику разработки программ объектно-ориентированного программирования, впитавшего в себя идеи структурного и модульного программирования, структурное программирование стало фактом истории информатики. Билет № 9 Текстовый редактор, назначение и основные функции. Для работы с текстами на компьютере используются программные средства, называемые текстовыми редакторами или текстовыми ...
... признаков в популяции Задачи генетики: 1. В области с/х - выведение новых сортов растений и новых пород животных, а также усовершенствование существующих 2. Медицинская генетика - разработка методов диагностики неследственных заболеваний, разработка их профилактики 3. Генная инженерия 43. Особенности наследования при моногибридном скрещивании, установленные Г.Менделем. ...
... мышц и скоростью их сокращения, между спортивным достижением в одном и другом виде спорта и так далее. Теперь можно составить содержание элективного курса «Основы теории вероятностей и математической статистики» для классов оборонно-спортивного профиля. 1. Комбинаторика. Основные формулы комбинаторики: о перемножении шансов, о выборе с учетом порядка, перестановки с повторениями, размещения с ...
... могут быть данные различных типов (целые или вещественные числа, строки, логические значения). Соответственно переменные бывают различных типов: целочисленные (А%=5), вещественные (А=3.14), строковые (А$="информатика'1), логические (A=True). Массивы являются набором однотипных переменных, объединенных одним именем. Массивы бывают одномерные, которые можно представить как одномерные ...

0 комментариев