Навигация
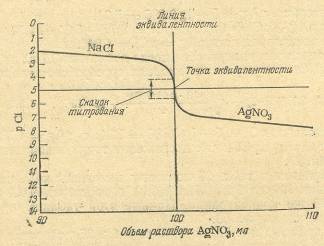
Тиоцианатометрическое титрование
3. Тиоцианатометрическое титрование.
Тиоцианатометрическое титрование основано на осаждении ионов Ag+ (или Hgl+ ) тиоцианатами:
Ag+ + SCN- = AgSCN|
Для определения необходим раствор NH4SCN (или KSCN). Определяют Ag+ или Hgi+ прямым титрованием раствором тиоцианата.
Тиоцианатометрическое определение галогенов выполняют по так называемому методу Фольгарда. Суть его можно выразить схемами:
CI- + Ag+ (избыток) -* AgCI + Ag+ (остаток), Ag+ (остаток) + SCN~-> AgSCN
Иначе говоря, к жидкости, содержащей С1~, приливают избыток титрованного раствора нитрата серебра. Затем остаток AgNO3 обратно оттитровывают раствором тиоцианата и вычисляют результат.
Индикатор метода Фольгарда — насыщенный раствор NH4Fe(SO4)2- 12H2O. Пока в титруемой жидкости имеются ионы Ag+, прибавляемые анионы SCN~ связываются с выделением осадка AgSCN, но не взаимодействуют с ионами Fe3+. Однако после точки эквивалентности малейший избыток NH4SCN (или KSCN) вызывает образование кроваво-красных ионов [Fe(SCN)]2+ и [Fe(SCN)2]+. Благодаря этому удается определить эквивалентную точку.
Тиоцианатометрические определения применяют чаще, чем аргентометрические. Присутствие кислот не мешает титрованию по методу Фольгарда и даже способствует получению более точных результатов, так как кислая среда подавляет гидролиз соли Fe**. Метод позволяет определять ион С1~ не только в щелочах, но и в кислотах. Определению не мешает присутствие Ва2+, РЬ2+, Bi3+ и некоторых других ионов. Однако если в анализируемом растворе имеются окислители или соли ртути, то применение метода Фольгарда становится невозможным: окислители разрушают ион SCN-, а катион ртути осаждает его.
Щелочной исследуемый раствор нейтрализуют перед титрованием азотной кислотой, иначе ионы Fe3+, входящие в состав индикатора, дадут осадок гидроксида железа (III).
4. Применение осадительного титрования
а) Приготовление стандартизированного раствора нитрата серебра
Первичными стандартами для стандартизации раствора нитрата серебра служат хлориды натрия или калия. Готовят стандартный раствор хлорида натрия и приблизительно 0,02 н. раствор нитрата серебра, стандартизируют второй раствор по первому.
Приготовление стандартного раствора хлорида натрия. Раствор хлорида натрия (или хлорида калия) приготовляют из химически чистой соли. Эквивалентная масса хлорида натрия равна его молярной массе (58,45 г/моль). Теоретически для приготовления 0,1 л 0,02 н. раствора требуется 58,45-0,02-0,1 = 0,1169 г NaCl.
Возьмите на аналитических весах навеску приблизительно 0,12 г хлорида натрия, перенесите ее в мерную колбу вместимостью 100 мл, растворите, доведите объем водой до метки, хорошо перемешайте. Вычислите титр и нормальную концентрацию исходного раствора хлорида натрия.
Приготовление 100 мл приблизительно 0,02 н. раствора нитрата серебра. Нитрат серебра является дефицитным реактивом, и обычно растворы его имеют концентрацию не выше 0,05 н. Для данной работы вполне пригоден 0,02 н. раствор.
При аргентометрическом титровании эквивалентная масса AgN03 равна молярной массе, т. е. 169,9 г/моль. Поэтому 0,1 л 0,02 н. раствора должны содержать 169,9-0,02-0,1 = 0,3398 г AgNO3. Однако брать точно такую навеску не имеет смысла, так как продажный нитрат серебра всегда содержит примеси. Отвесьте на технохимических весах приблизительно 0,34 — 0,35 г нитрата серебра; цште навеску в мерную колбу вместимостью 100 мл, раствора в небольшом количестве воды и доведите объем водой хранить раствор в колбе, обернув ее черной бумагой и перелить в склянку темного стекла.. Стандартизация раствора нитрата сера по хлориду натрия.. Тщательно вымытую бюретку промойте раствором нитрата серебра и подготовьте eg к титрованию. Пипетку ополосните раствором хлорида натрия и перенесите 10,00 мл раствора в коническую колбу. Прилейте 2 капли насыщенного раствора хромата калия и осторожно, по каплям, титруйте раствором нитрата серебра при перемешивании. Добейтесь, чтобы переход желтой окраски смеси в красноватую произошел от одной избыточной капли нитрата серебра. Повторив титрование 2 — 3 раза возьмите среднее из сходящихся отсчетов и вычислите нормальную концентрацию раствора нитрата серебра
Допустим, что на титрование 10,00 мл 0,02097 н. раствора хлорида натрия пошло в среднем 10,26 мл раствора нитрата серебра. Тогда
A^AgNOj. 10,26 = 0,02097. 10,00, ATAgNOs = 0, 02097- 10, 00/10, 26 = 0,02043.
Если предполагается определять содержание С1~ в образце, то вычисляют, кроме того, титр раствора нитрата серебра по хлору: Т ,- = 35, 46-0 ,02043/ 1000 = 0,0007244 г/мл,
'l
это означает, что 1 мл раствора нитрата серебра соответствует 0,0007244 г оттитрованного хлора.
б) Приготовление стандартизированного раствор тиоцианата аммония.
Раствор NH4SCN или KSCN с точно известным титром нельзя приготовить растворением навески, так как эти соли очень гигроскопичны. Поэтому готовят раствор с приблизительной нормальной .концентрацией и устанавливают ее по стандартизированному раствору нитрата серебра. Индикатором служит насыщенный раствор NH4Fe(SO4)2- 12Н2О. Чтобы предупредить гидролиз соли Fe, к самому индикатору и к анализируемому раствору прибавляют перед титрованием 6 н. азотную кислоту.
Приготовление 100 мл приблизительно 0,05 н. раствора тиоцианата аммония. Эквивалентная масса NH4SCN равна его молярной массе, т. е. 76,12 г/моль. Поэтому 0,1 л 0,05 н. раствора должны содержать 76,12.0,05-0,1=0,3806 г NH4SCN.
Возьмите на аналитических весах навеску около 0,3—0,4 г, перенесите в колбу вместимостью 100 мл, растворите, доведите объем раствора водой до метки и перемешайте.
Стандартизация раствора тиоцианата аммония по нитрату серебра. Подготовьте бюретку для титрования раствором NH4SCN. Ополосните пипетку раствором нитрата серебра и отмерьте 10,00мл его в коническую колбу. Добавьте 1 мл раствора NH4Fe(SO4)2 (индикатор) и 3 мл. 6 н. азотной кислоты. Медленно, при непрерывном взбалтывании, приливайте из бюретки раствор NH4SCN. Титрование прекратите после появления коричнево-розовой окраски [Fe(SCN)]2+, не исчезающей при энергичном встряхивании.
Повторите титрование 2—3 раза, из сходящихся отсчетов возьмите среднее и вычислите нормальную концентрацию NH4SCN.
Допустим, что на титрование 10,00 мл 0,02043 н. раствора нитрата серебра пошло в среднем 4,10 мл раствора NH4SCN.
в) Определение содерания хлора в образце по Фольгарду
Галогены по Фольгарду определяют обратным титрованием остатка нитрата серебра раствором NH4SCN. Однако точное титрование возможно здесь лишь при условии, что будут приняты меры, предотвращающие (или замедляющие) реакцию между хлоридом серебра и избытком тиоцианата железа:
3AgCI + Fe (SCN)3 = SAgSCNJ + FeCl3
при которой появляющаяся сначала окраска постепенно исчезает. Лучше всего отфильтровать осадок AgCl перед титрованием избытка нитрата серебра раствором NH4SCN. Но иногда вместо этого к раствору добавляют какую-нибудь органическую жидкость, не смешивают с водой и как бы изолирующую осадокАрС1от избытка нитрата.
Метод определения. Возьмем пробирку раствором анализируемого вещества, содержащего хлорид натрия.Навеску вещества растворяют в мерной колбе вместимостью 100 мл и доведете объем раствора водой до метки (концентрация хлорида в растворе должна быть не более 0,05 н.).
Перенесите пипеткой 10,00 мл анализируемого раствора в коническую колбу, добавьте 3 мл 6 н. азотной кислоты и прилейте из бюретки заведомый избыток раствора AgNO3, например 18,00 мл. Затем осадок хлорида серебра отфильтруйте. Оттитруйте остаток нитрата серебра раствором NH4SCN, как описано в предыдущем параграфе. Повторив определение 2—3 раза, возьмите среднее. Если осадок хлорида серебра отфильтровали, то его следует промыть и присоединить промывные воды к фильтрату.
Допустим, что навеска образца составила 0,2254 г. К 10,00 мл анализируемого раствора добавили 18,00 мл 0,02043 н. раствора .нитрата серебра. На титрование избытка его пошло 5,78 мл •0,04982 н. раствора NH4SCN.
Прежде всего вычислим, какой объем 0,02043 н. раствора нитрата серебра соответствует затраченным на титрование 5,78 мл 0,04982 н. раствора NH4SCN:
следовательно, на осаждение иона С1~ пошло 18,00 — 14,09 = 3,91 мл 0,2043 н. раствора нитрата серебра. Отсюда легко найти нормальную концентрацию раствора хлорида натрия
.
Поскольку эквивалентная масса хлора равна 35,46 г/моль,* общая масса хлора в навеске составляет:
772=0,007988-35,46-0,1 =0,02832 г.
Содержание хлора в массовых долях (%) составляет
0,2254 г С1— 100%
х= 0,02832-100/0,2254 = 12,56%.:
0,02832 > С1 — х%
По методу Фольгарда определяют также содержание ионов Вг~ и I-. При этом отфильтровывать осадки бромида или иодида серебра не требуется. Но нужно учитывать, что ион Fe3+ окисляет иодиды до свободного иода. Поэтому индикатор добавляют после осаждения всех ионов I- нитратом серебра.
г)Определение содержания трихлорацетата натрия| в техническом препарате (по хлору)
Технический трихлорацетат натрия (ТХА)—гербицид для тожения сорняков злаков. Он представляет собой кристаллическое вещество белого или светло-коричневого цвета, хорошо растворимое в воде.По Фольгарду сначала определяют массовую долю хлоридо органических соединений, а затем после разрушения хлора. По разности находят массовую долю (%) хлора трихлор-ацетата натрия.
.
Определение массовой доли ( % ) хлора неорганических соединений. Точную навеску препарата 2—2,5 г поместите в мерную колбу вместимостью 250 мл, растворите, доведите раствор водой до метки, перемешайте. Перенесите пипеткой в коническую колбу 10 мл раствора и прилейте 5—10 мл концентрированной азотной кислоты.
262
Прибавьте из бюретки 5 или 10 мл 0,05 н. раствора нитрата серебра и избыток его оттитруйте 0,05 н. раствором NH4SCN в присутствии NH4Fe(SO4)2 (индикатор).
Массовую долю (%) хлора (х) неорганических соединений вычислите по формуле
( V — l/i) 0,001773-250х100
х = --------------------------------------------------
т 10
где V — объем точно 0,05 н. раствора AgNO3, взятый для анализа; Vi — объем точно 0,05 н. раствора NH4SCN, пошедший на титрование избытка AgNO3; т — навеска трихлорацетата натрия; 0,001773 — масса хлора, отвечающая 1 мл 0,05 н. раствора AgNO. Определение массовой доли (% ) общего хлора. В коническую колбу возьмите 10 мл приготовленного ранее раствора, прилейте 10 мл раствора с массовой долей NaOH 30% и 50 мл воды. Соедините колбу с обратным шариковым холодильником и кипятите содержимое ее в течение 2 ч. Дайте жидкости остыть, промойте холодильник водой, собирая промывные воды в ту же колбу. Прибавьте к раствору 20 мл разбавленной (1:1) азотной кислоты и прилейте из бюретки 30 мл 0,05 н. раствора нитрата серебра. Избыток нитрата серебра оттитруйте 0,05 н. раствором NH4SCN в присутствии NH4Fe(SO4)2. Массовую долю (%) общего хлора (xi) вычислите по приведенной выше формуле. Массовую долю (%) трихлорацетата натрия в препарате (х^) найдите по формуле
х2 = ( х1 — х) (185,5/106,5),
где 185,5 — молярная масса трихлорацетата натрия; 106,5 — масса хлора, содержащегося в молярной массе трихлорацетата натрия.
.
Похожие работы
... и псевдогалогенами. Конечная точка титрования может быть установлена различными способами, вошедшими в литературу под именами их авторов (см. табл.1.11.1). ТКТ в седиметрии рассчитывают не для выбора индикатора, а для выявления возможности седиметрического титрования и оптимизации его условий (концентрации растворов). Критерием является наличие и величина скачка титрования на графике ТКТ. При ...
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...
... ) = q(NaOH) и c учетом аликвотной части кислоты по методике (см. 2.2.1): mн(Н2С2О4 · 2H2O) N(NaOH) · V(NaOH) ----------------------------- = -------------------------- 10 Mэ(Н2С2О4 2H2O) 1000 Рассчитанную навеску взвешивают на аналитических демпферных весах. В мерную колбу со щавелевой кислотой порциями добавляют, обмывая воронку, 30-35 мл дистиллированной воды. Содержимое в колбе ...
... эквивалентности раствор обесцвечивается. Избыток [Hg2]2+-ионов реагирует с Fe(SCN)3 по уравнению: 3 [Hg2]2+ + 2 Fe(SCN)3 → 3Hg2(SCN)2 + 2Fe3+ 2.3 Инструментальные методы определения хлорид-ионов 2.3.1 Нефелометрическое определение хлоридов При прохождении пучка света через дисперсные системы наблюдается рассеяние или поглощение света твердыми частицами. Это явление положено в ...





0 комментариев