Навигация
Фаза стромопороза, в которой морфологическая целостность форменных элементов еще сохраняется, хотя клетки уже свободно пропускают электрический ток;
1 фаза стромопороза, в которой морфологическая целостность форменных элементов еще сохраняется, хотя клетки уже свободно пропускают электрический ток;
2 фаза строматолиза, когда происходит полный распад стромы эритроцитов.
Специалистами было показано, что при химическом гемолизе сферуляции и разбуханию эритроцитов предшествует этап проникновения гемолитика в клетку[21,71,76]. Возможны два варианта этого процесса: мембрана может быть проницаема и непроницаема для гемолитика. В первом случае гемолитик свободно проникает внутрь клетки, нарушает упорядочение протоплазматических структур и переводит большую часть молекул в растворенное состояние. Распадается также упорядоченная упаковка гемоглобина. Переход в раствор молекул гемоглобина повышает осмотическую активность внутриклеточного содержимого, мелкие освобожденные молекулы и ионы выходят наружу. Крупные липоидные и белковые молекулы остаются в клетке, так как оболочка для них непроницаема. В результате этих процессов осмотическое давление внутри клетки увеличивается. Далее гемолиз развивается по осмотическому пути.
Если же оболочка клетки непроницаема для действующего агента, к процессу гемолиза добавляется еще один этап. Проникновение гемолитика в клетку предшествует повреждение оболочки. В результате этого мембрана эритроцитов утрачивает непроницаемость для молекул лизина, после чего процесс развивается по ранее описанному пути [21, 77].
1.3 Реакции красной крови на воздействие химических факторовИзвестно, что любые воздействия на организм находят свое отражение в изменениях системы крови, которая включает в себя как кроветворные органы, так и периферическую кровь. Реакция на воздействие различных агентов может колебаться в различных пределах от резко выраженного токсического до стимулирующего эффекта, а исследуемые характеристики могут как существенно отклоняться от нормы, так и не выходить за ее пределы.
Независимо от химической природы первым патогенным звеном воздействия химических факторов является мембраноповреждающий эффект, сопровождающийся нарушением функции каскада митохондриальных и микросомальных ферментов – оксигеназ, гидролаз, участвующих в детоксикации и элиминации патогенного начала [30, 90]. Многие агенты воздействуют на белки мембран, способствуя их окислению, денатурации и, как следствие, образование пор в ней. Например, этанол способствует денатурации белков мембраны, гемин вызывает как быстрый, так и медленный гемолиз, окисляя мембранные белки [3, 59]. Ртуть и ее органические соединения вызывают повреждение мембраны за счет блокады сульфогидрильных групп белковых молекул, входящих в состав биомембран [22].Подавляющее большинство гемолитических агентов вызывает повреждение мембраны, нарушая расположение молекул липидов в ней. Так олеиновокислый Na и желчные кислоты повреждают оболочку эритроцита, растворяя в ней лецитин, при этом повреждаются более глубокие части мембраны [59]. Активные формы O2, H2O2, органические перекиси взаимодействуют с липидами мембран, образуют перекиси липидов, что приводит к структурным нарушениям и изменению проницаемости [2]. Ретиноиды индуцируют переход эритроцитарных липидов из бислойной фазы в гексагональную. Следовательно, стойкость эритроцитов нарушается [52]. При карбомилировании мембран эритроцитов цианат связывается с фосфотидилхолином и фосфотидилсерином, таким образом размер пор и их количество возрастает. Адреналин вызывает процесс перекисного окисления липидов [14]. Структурные и функциональные изменения мембраны эритроцитов были обнаружены при действии толуола и выражались в ослаблении связей между липидными и белковыми компонентами [37].
И.И.Гительзон и И.А.Терсков [21] показали, что катионы Mg2+ и в меньшей степени Ca2+ увеличивают стоикость эритроцитов, а Na+ и K+ практически не изменяют ее. Из анионов SO42- очень резко увеличивают сстойкость эритроцитов, а PO43- снижают ее. Исследованиями А.К.Гулевского [26] показано, что при предварительном низкотемпературном воздействии наблюдается следующий эффект: Na+, Ca2+, Mg2+ сорбируясь на мембране, меняют ее проницаемость для воды и ионов, а также механические свойства. Ионы K+ и Ca2+ снижают устойчивость мембраны.
Антигемолитическим действиям обладают 2-гидроксиламониевые соли арил-, тио- и арилсульфонилуксусной кислот [59]. Л.Гринбер и А.М. Аллахвердиев обнаружили повышение резистентности эритроцитов после добавления формиата Na и обработки промахином.
Лекарственные препараты также были исследованы на гемолитическое действие. Н.М.Митрохин с сотрудниками [4] исследовали вещества, применяемые в медицинской практики. Они установили, что более 70% исследованных препаратов вызывают деформацию эритроцитов. Катионы вызывают преимущественно стоматолиз клеток. Таким механизмом действия обладают димедрол, аминазин, промедола гидрохлорид и некоторые другие препараты. Анионы вызывают эхиноцитоз эритроцитов. Такое влияние характерно для всех барбитуратов, карцеина, мединала.
В последние годы специалисты уделяют большое внимание разработке средств, модулирующих иммунные реакции организма. Стало очевидным, что положительное действие разных лекарственных веществ можно объяснить их способностью повышать общую сопротивляемость организма или его неспецифический иммунитет, а также влиять на специфические иммунные реакции [65].Отражением неспецифической резистентности является система крови. Последняя играет роль эффектора и участвует благодаря особой реактивности в реализации адаптационно-трофических влияний для сохранения постоянства внутренней среды организма [21, 23-25, 51, 74, 86].
Повышение общей сопротивляемости организма отмечено под влиянием ряда стимулирующих препаратов. К веществам, проявляющим данную способность, относят производные пиримидиновых оснований [41, 49] В литературе имеются сведения о том, что соединения данного класса способствуют синтезу нуклеиновых кислот, белков, увеличивают активность иммунной системы.
Производные пиримидинов являются антиоксидантами. Механизм их антиоксидантного эффекта связан с подавлением перекисного окисления жирных кислот, а также с нарушением образования супероксидных радикалов. Данные препараты обладают защитным эффектом на цитоплазматическом и субклеточном уровне по отношению к свободным радикалам, продуцируемые активированными клетками (макрофагами, нейтрофилами). Лечебными препаратами этой группы являются пентаксил, метилурацил, оротовая кислота, сафинор и др. [77, 90].
Рядом исследователей была изучена также способность азолов стимулировать иммунологические процессы и повышать общую сопротивляемость организма. В практике нашли применение в этой связи дибазол, левамизол и др. [7, 41, 49]. Однако отмечается дозозависимость эффекта, так как при повышении доз возможно не иммунно-стимулирующее а иммунно-депрессивное действие [16].
Наряду с положительным влиянием азольных соединений нельзя не обратить вынимание на наличие побочных эффектов от их применения. Среди последних выделяют гематологические – анемия и биохимические – гипонатриемия и гиперлипидиемия [17].
Таким образом, при воздействии различных химических веществ на живой организм возникает выраженная ответная реакция со стороны красной крови, причем, характер и сила их влияний весьма многообразны.
2. Экспериментальная часть 2.1. Материалы и методика исследованияВлияние производных пиримидиновых оснований на устойчивость эритроцитов к дезинтегрирующему фактору изучали методом кислотных эритрограмм.
Исследовали свойства соединений, имеющие следующее химическое строение:

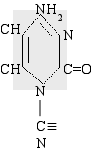
цианоцитозин
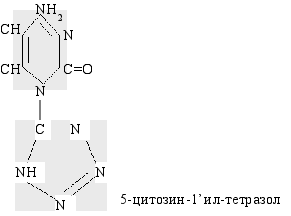
цитозин
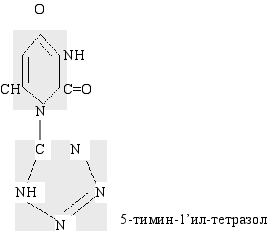
![]()
![]()
CH3-C
Наблюдения проводили in vivo. Было поставлено две серии экспериментов, в которых использовали 36 нелинейных крыс весом 200-250г. В каждой серии были сформированы две опытные и одна контрольная группа.
В первой серии опытов крысам одной опытной группы пятикратно внутрибрюшинно с интервалом в 48 часов вводили по 1 мл раствора цитозина в разовой дозе 1 мг/100 г массы животного, другой группы раствор цианоцитозина в той же дозе таким образом, что суммарная доза вводимого вещества в обеих группах составила 5 мг на 100 г массы животного. Во второй серии опытов в аналогичных условиях особями одной опытной группы инъецировали цитозинтетразол, другой – тиминтетразол.Крысам обеих контрольных групп вводили физиологический раствор в равном объеме.
Кровь для анализа брали в утренние часы перед кормлением животных из кончика хвоста до начала введения растворов исследуемых веществ – исходные значения, через 2,5 и 24 часа после каждого введения, а затем на 3, 5, 7 и 14 сутки после окончания инъекций. Для проведения исследования 20 мкл крови смешивали с 20 мл физиологического раствора, получая таким образом взвесь эритроцитов в разведении 1:1000.
Все исследования проводились при комнатной температуре.
Измерения оптической плотности взвеси эритроцитов производили на фотоэлектроколориметре КФК-2 УХЛ 42 при красном светофильтре. В кювету рабочей ширины 10 мм вливали 2 мл взвеси эритроцитов из отдельной пробы и добавляли к ней в качестве гемолитика 2 мл 0,004 н HCl. После этого кювету помещали в кюветодержатель прибора. С момента введения во взвесь эритроцитов гемолитика величина светопропускания исследуемого раствора начинала изменятся в связи с разрушением клеток крови. Каждые 30 секунд отмечали показания прибора по шкале экстинкции (Ео). Измерение вели до получения двух совпадающих показаний, т.е. до завершения гемолиза (Еn). В результате получали ряд убывающих экстинкций, каждая из которых соответствовала степени гемолиза к моменту отсчета. По значениям оптической плотности вычисляли процент разрушенных эритроцитов за каждые 30 секунд, принимая разность Ео-Еn за 100%.
Уровень значимости различий определяли по таблице стандартных значений критерия Стьюдента.
2.2. Результаты исследования
2.2.1. Влияние цитозина на резистентность эритроцитов
Результаты проведенных исследований показали, что цитозин при многократных введениях животным не оказал существенного влияния на исходные качественные характеристики эритроцитов. Об этом позволяют судить данные таблиц 1 и 2 (Приложение), в которых представлены усредненные показатели оптической плотности взвесей разрушающихся в ходе гемолиза эритроцитов особей опытной и контрольной группы. Как видно из таблиц, в отдельные сроки в течение длительного периода наблюдений имели место колебания функционального состояния эритроцитов по сравнению с исходным уровнем у животных обеих групп. Обращает на себя внимание идентичный характер и незначительные пределы сдвигов показателей у контрольных и подопытных особей.
О физико-химическом состоянии эритроцитов, подвергшихся воздействию гемолитика, до и на фоне введения животным цитозина позволяют судить кислотные эритрограммы (рис. 2.1, 2.2).
Первоначальное распределение по степеням стойкости к гемолитику эритроцитов интактных крыс отражает исходная эритрограмма. Согласно графику, процесс разрушения эритроцитов начинается через 1,5 минуты после добавления к их взвеси гемолитика, наибольшей интенсивности достигает к 3,5 минутам и заканчивается через 7,5 минут.
Как известно, состав эритроцитарной популяции неоднороден. В соответствии с хронологическим возрастом эритроцитов положение начальной части кривой определяется содержанием в периферической крови старых малостойких клеточных форм, средней части – основной массы среднеустойчивых клеток, и ее конечной части – наличием устойчивых молодых форменных элементов [20, 38].
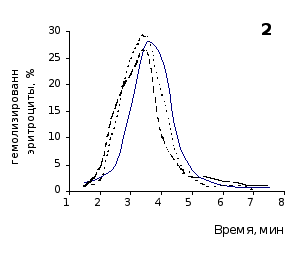
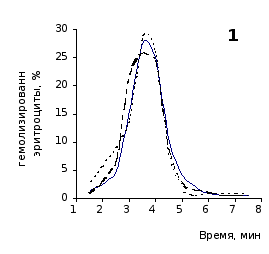
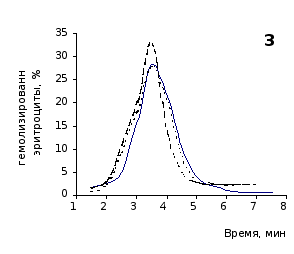


Рис. 2.1. Кислотные эритрограммы крови крыс на фоне пятикратного введения цитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
и![]() сходная
гистограмма
сходная
гистограмма
ч![]() ерез
2,5 часа
ерез
2,5 часа
ч![]() ерез
24 часа
ерез
24 часа

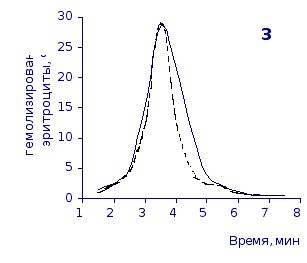
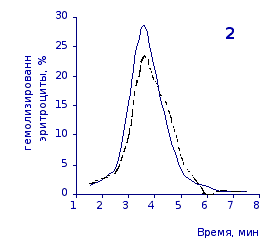
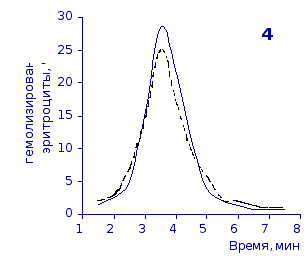
Рис. 2.2 Кислотные эритрограммы крови крыс в отставленные сроки наблюдения после пятикратного введения цитозина
1-4 – на 3, 5, 7 и 14 сутки соответственно
и![]() сходная
гистограмма
сходная
гистограмма
о![]() пытная
кривая
пытная
кривая
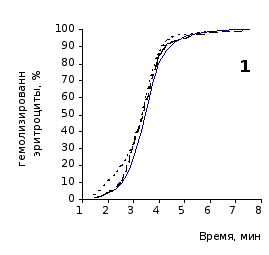

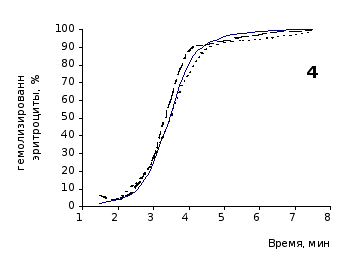
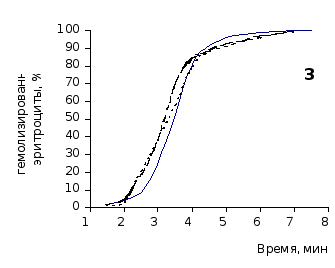
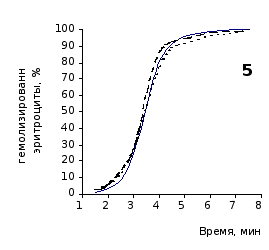
Рис. 2.3 Кинетика гемолиза крови крыс на фоне пятикратного введения цитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
и![]() сходная
гистограмма
сходная
гистограмма
ч![]() ерез
2,5 часа
ерез
2,5 часа
ч![]() ерез
24 часа
ерез
24 часа
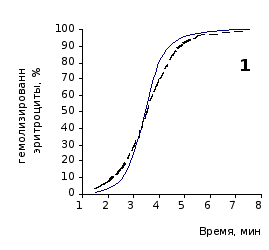
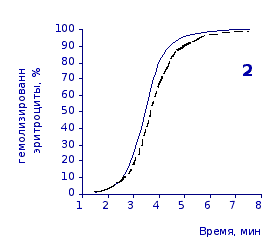
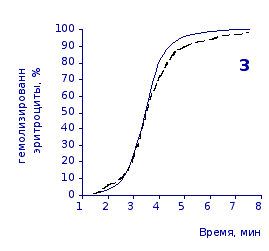
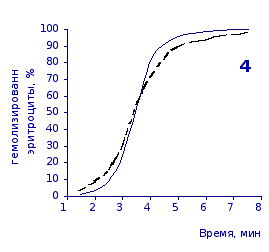
Рис. 2.4. Кинетика гемолиза эритроцитов крыс на фоне пятикратного введения цитозина в разовой дозе 1 мг/100 г массы
1-4 – на 3, 5, 7 и 14 сутки соответственно
и![]() сходная
гистограмма
сходная
гистограмма
п![]() осле
окончания
введений веществ
осле
окончания
введений веществ
Анализ эритрограмм на фоне пятикратного введения животным цитозина не выявил заметного перераспределения эритроцитов по степени их устойчивости к дезинтегрирующему агенту. Во все сроки наблюдения интенсивность их разрушения под действием соляной кислоты и общая продолжительность лизиса мало различались с их исходными показателями и почти полностью совпадали с таковыми у контрольной группы.
Отсутствие выраженного эффекта действия цитозина на резистентность эритроцитов отражают также кривые кинетики гемолиза, которые характеризуют динамику разрушения клеток крови под влиянием гемолитика (рис.2.3, 2.4). Кривая процесса гемолиза у интактных крыс характеризуется S-образной формой. Она медленно нарастает в своей начальной части, затем круто поднимается вверх в интервале от 2,5 до 5,5 минут, после чего переходит в плато и заканчивается на 7,5 минуте.
Как видно из приведенных графических материалов, на фоне пятикратного введения растворов пиримидина и в течении двух недель после прекращения инъекций форма кривой практически не отличается от исходных характеристик.
2.2.2. Влияние цианоцитозина на резистентность эритроцитов
В серии опытов с многократным введением животным цианоцитозина выявлена способность последнего определенным образом изменять базовые свойства эритроцитов. Усредненные данные по динамике показателей оптической плотности взвесей разрушающихся эритроцитов у животных этой группы представлены в таблице 3 (Приложение). Сравнительный анализ исследований крови опытных и контрольных особей показали, что циановое производное пиримидинового основания оказало заметное влияние на функциональное состояние эритроцитов. При относительно слабых колебаниях устойчивости к гемолитику форменных элементов крови контрольных крыс, которым длительное время инъекцировали физиологичес-
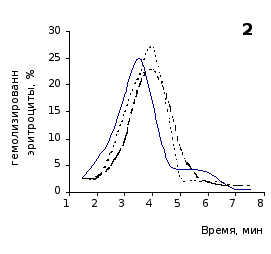

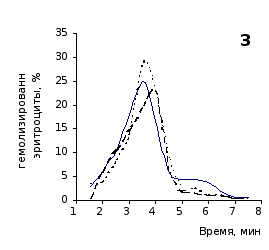
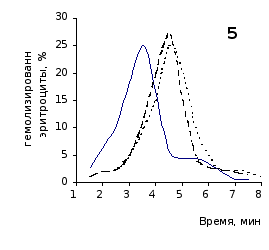
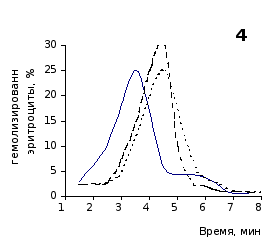
Рис. 2.5. Кислотные эритрограммы крови крыс на фоне пятикратного введения цианоцитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
и![]() сходная
гистограмма
сходная
гистограмма
ч![]() ерез
2,5 часа
ерез
2,5 часа
ч![]() ерез
24 часа
ерез
24 часа

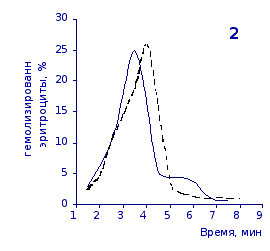
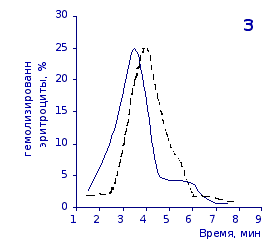

Рис.2.6. Кислотные эритрограммы крови крыс в отставленные сроки наблюдения после пятикратного введения цианоцитозина
1-4 – на 3, 5, 7 и 14 сутки
и![]() сходная
кривая
сходная
кривая
о![]() пытная
кривая
пытная
кривая
кий раствор, отмечены достаточно выраженное и закономерное усиление резистентности эритроцитов, обусловленное влияние цианоцитозина. Динамику качественных изменений клеток крови под влиянием исследуемого вещества позволяют проследить кислотные эритрограммы на рис.2.5, 2.6.
Как видно из эритрограмм, смена их положений относительно первоначального указывает на тенденцию к усилению устойчивости эритроцитов к гемолитику. Это находит отражение в сдвиге эритрограмм в сторону больших временных значений. Уже на фоне первых трех инъекций растворов цианоцитозина вершина кривой смещается с 3,5 до 4,0-х минут, а при последующих введениях до 5,0 минут (p
0 комментариев