Навигация
Расчет количества электроэнергии на выплавку 1т чугуна
5.1 Расчет количества электроэнергии на выплавку 1т чугуна
Расчет проводится по формуле:
![]()
где I – среднее значение силы тока при плавки шихты, А;
U – среднее значение напряжения при плавки шихты, В;
cosj - коэффициент мощности равный 0,5;
W - расход электроэнергии, кВт∙час/Т.
5.2 Расчет степени извлечения железа в чугун (aFe)
Расчет проводится по формуле
aFe = 
где Gк, Gизв, Gагл – соответственно масса кокса, известняка и агломерата, кг;
Gчуг – масса образованного чугуна, кг;
Fe2O3 к, Fe2O3 изв, Fe2O3 агл – содержание Fe2O3 соответственно в коксе, известняке и агломерате;
FeOагл – содержание FeO в агломерате.
ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
«Расчет материального баланса выщелачивания обожженного цинкового концентрата»
Цинк содержится в концентрате преимущественно в виде сульфида. Можно восстановить цинк из его сульфида каким-либо восстановителем, но реакции восстановления практически начинаются при температурах выше 12000С, когда значительная часть сульфидного концентрата расплавится. Цинк значительно лучше восстанавливается из его оксида, поэтому сульфид цинка предварительно переводят в оксид, т.е. сначала концентрат обжигают, при этом протекает реакция:
2ZnS + 3O2 = 2ZnO + 2SO2 + Q
В обжиговых газах содержится 6-8% диоксида серы. Такие газы используются для производства серной кислоты.
На дистилляционных заводах обжиг цинкового концентрата обычно не доводят до конца, оставляя в полуобоженном порошковидном концентрате около 10% сульфидной серы. Для удаления оставшейся серы и спекания концентрата применяют агломерирующий обжиг, газы от которого также иногда используют для производства серной кислоты.
Для извлечения цинка из концентратов применяют два способа: пирометаллургический (дистилляционный) и гидрометаллургический (электролитический).
Исторически первым способом был пирометаллургический.
Технология способа и аппаратурное оформление процесса связаны с особенностями восстановления цинка из оксида. Восстановление оксида цинка до металла углеродом и СО происходит при температуре 1000–1100°С, а температура кипения получаемого при этом цинка – 906°С.
Реакции восстановления
ZnO + C = Znг + CO
ZnO + CO = Znг + CO2
сопровождаются выделением газообразного цинка, его возгонкой (дистилляцией). Компоненты пустой породы остаются при этом в твердом виде. Конденсацией паров можно получить жидкий металлический цинк.
Пример 1. Обожженный цинковый концентрат, содержащий 70% ZnO и 30% породы, подвергают дистилляции в ретортах с двукратным избытком каменного угля, содержащего 90% С и 10% золы. Требуется определить: 1) состав шихты и количество концентрата и каменного угля, необходимое для получения 200 кг цинка, при условии, что с углеродом реагирует только ZnO, который восстанавливается на 93%; 2) количество (м3) полученной в результате восстановления окиси углерода и 3) выход и состав остатка от дистилляции (раймовка).
![]()
![]() Решение. Восстановление окиси цинка выражается уравнением
Решение. Восстановление окиси цинка выражается уравнением
ZnO + С = Zn + СО,
81,4 12 65,4 28
из которого видно, что 65,4 вес. ч. цинка получаются при взаимодействии 81,4 вес. ч. ZnO с 12 вес. ч. углерода. Следовательно,
200 кг цинка будут получены при взаимодействии
81,4 ∙ 200 / 65,4 = 249,0 кг ZnO и
12 × 200 / 65,4 = 36,7 кг углерода.
Для восстановления 93% Zn из смеси в шихте надо иметь
249 ∙ 100/ 93 = 267,7 кг ZnO или 267,7× 100 / 70 = 382,1 кг обожженного концентрата.
Каменного угля при содержании в нем 90% С и при двукратном избытке надо иметь в шихте (36,7 ∙ 100 ∙ 2) / 90 = 81,5 кг.
Следовательно, шихта должна содержать 382,1кг (82,5%) обожженного концентрата, 81,5 кг (17,5%) каменного угля, т. е. 463,6 кг (100,0%).
При дистилляции, согласно написанному выше уравнению, на каждые 65,4 кг восстановленного цинка получается 1 моль СО, т. е. 22,4 м3. На 200 кг восстановленного цинка получится
22,4 × 200 / 65,4 = 68,5 м3 окиси углерода (при 0° и 1 ат).
![]() В остаток от дистилляции поступает вся пустая порода восстановленного концентрата и зола кокса, а также невосстановленный концентрат и непрореагировавший каменный уголь. Из поступивших в шихту 382,1 кг обожженного концентрата восстановлено 249,0 кг ZnO; в раймовку поступает 381,1 - 249,0 = 133,1 кг,
В остаток от дистилляции поступает вся пустая порода восстановленного концентрата и зола кокса, а также невосстановленный концентрат и непрореагировавший каменный уголь. Из поступивших в шихту 382,1 кг обожженного концентрата восстановлено 249,0 кг ZnO; в раймовку поступает 381,1 - 249,0 = 133,1 кг,
из которых на избыточную окись цинка приходится
267,7 - 249,0 = 18,7 кг,
а на породу 133,1 - 18,7=114,4 кг.
Из 81,5 кг каменного угля, идущего в шихту, расходуется на восстановление окиси цинка 36,7 кг углерода, остальное, т. е.
81,5 - 36,7 = 44,8 кг, поступает в раймовку,
из них на долю золы приходится 81,5×10 /100 = 8,1кг,
а 44,8 - 8,1=36,7 кг — на долю непрореагировавшего углерода. Суммируя эти количества компонентов раймовки, получим ее состав:
кг %
Окись цинка ............... 18,7 10,5∙ (8,4% Zn)
Пустая порода из концентрата . .. . 114,4 64,3
Углерод ................ 36,7 20,6
Зола каменного угля ………… 8,1 4,6
177,9 100,0
Выход раймовки составляет 177,9 × 100 / 463,6 = 38,4% от веса шихты.
Практические занятия
Расчет материального баланса, расхода электроэнергии электролитического рафинирования меди
Исходные данные:
Производительность цеха по производству медного купороса (в кг/сут)15000
Содержание меди в ломе, поступающем на переработку (в %) 96
Состав молотой серы второго сорта (в %):
сера98,0
влага0,5
зола1,0
Состав высокосернистого мазута (в %):
СР 83,4
НР 10,0
NP+OP 0,4
SP 2,9
WP 3,0
AP 0,3
![]() (в кДж/кг) 38390
(в кДж/кг) 38390
Температура поступающего материала и подаваемого воздуха (в 0С) 20
Относительная влажность подаваемого воздуха φ (в %) 70
Состав готовой продукции (1 сорт):
CuSO4.5H2O (в % не менее) 98,0
H2SO4 (в % не более) 0,25
Потери меди в процессе производства медного купороса (в %)
с потерями готового продукта при сушке и укупорке 0,1
с потерями CuSO4.5H2O в жидкой фазе 0,5
в отвал после растворения 0,5
со шлаком (количество шлака 12% от количества загруженной меди,
концентрация меди в шлаке 44%)
угар меди в печи 0,5
Расчет необходимого количества меди-лома
Количество готового продукта с учетом потерь при сушке и упаковке
![]()
Количество медного купороса в готовом продукте
![]()
В натравочной башне получается медного купороса с учетом потерь
![]()
Количество меди в купоросе
![]()
Содержится меди в гранулах
![]()
Доля меди в гранулах от загруженной в печь (в долях от целого)
1-0,005-0,12∙0,44=0,9422
Содержится меди в загружаемом ломе
![]()
Необходимое количество медного лома. Загружаемого в печь
![]()
Принимая во внимание, что плавка медного лома в отражательной печи является единственной периодической операцией в процессе получения медного купороса, расчет отражательной печи проводим на плавку, длящуюся в среднем 6 ч; полученный результат умножаем на 4 для перехода к суточной производительности. Отсюда на плавку в печь загружается лома
![]()
Материальный расчет
Приход.
Поступает меди лома 1045
Примесей в ломе
1045∙0,04=42 кг
Образуется шлака
(1045-42)∙0,12=120 кг
Окисленных примесей в шлаке
120∙(1-0,44)=67 кг
Необходимо кислорода для окисления примесей
67-42=25 кг
В печь добавляется сера (1% от массы лома)
1045∙0,01=10,45 кг
(количеством примесей в сере пренебрегаем, т.к. их менее 0,5 кг)
Требуется кислорода для окисления серы
![]()
Расход мазута принимается по практическим данным – 20% от массы меди-лома
1045∙0,2=209 кг
Требуется кислорода для сжигания мазута
![]()
Принимаем, что
OP=NP=1/2∙0.4%
1) Необходимое кислорода с учетом избыточного воздуха (α=1,5)
1,5∙(10,42+636+25)=1007,6 кг
2) Общее количество сухого воздуха, подаваемого в печь
![]()
3) Поступает в печь влаги с воздухом
4343∙0,01042=45,3 кг
где 0,01042 – влагосодержание воздуха при 200С и φ=70
4) Общее количество подаваемого воздуха
4343+45,3=4388,5 кг
Расход
1) С газами и пылью уходит
(1045-42)∙0,005=5 кг Cu,
209∙0,003=0,63 кг золы.![]()
![]()
![]()
1007,6-(10,42+636+25)=336 кг O2
4343-1007,6+209∙0,5∙0,004=3336
Всего уходит из печи газов и паров
5+0,63+240+640+33+336+3336=4590 кг
2) Получено гранул
(1045-42)-(120-67)-5=945 кг
Сводный материальный баланс башни для растворения меди
|
Приход |
Расход |
||
|
статья |
кг/сут |
статья |
кг/сут |
|
Медь в гранулах Воздух Сера Мазут |
1045 4343 10,45 209 |
Гранулы меди Газы и пары |
945 4590 |
|
Всего |
5570,5 |
Всего |
5535 |
Практические занятия
Расчет шихты выплавки ферромарганца
Рафинированные марки (мало- и среднеуглеродистый) ферромарганца
получают только силикотермическим способом. С учетом получения сплава с заданным содержанием фосфора в зависимости от исходного марганцевого сырья используют силикомарганец с различной концентрацией фосфора.
В качестве марганецсодержащего сырья используют марганцевые концентраты, бесфосфористый шлак или их смеси.
Для грамотного выполнения расчета необходимо тщательно изучить физико-химические основы плавки, определиться компонентами шихты и ее химическим составом, знать основные технологические параметры и показатели процесса.
Выполним следующий расчет.
Требуется получить сплав приблизительно следующего состава (марка ФMн 1,0):
Не менее 86 % Mn; 1,5 % Si; 1,0 % С; 0,3 % Р.
На основании опытных данных задаемся следующими условиями:
– использование кремния из силикомарганца для восстановления оксидов готового рудного материала 74,5 %; 1,5 % переходит в сплав, остальноее количество (24 %) окисляется кислородом диссоциации высших оксидов марганца и железа, атмосферы, а также расходуется на восстановление незначительного количества элементов, имеющихся в вспомогательных материалах шихты;
– распределение марганца оксидных марганецсодержащих материалов: в металл – 48 %, в шлак – 42 %, в улет – 10 %;
– распределение железа в металл – 95, в шлак – 5 %;
– основность шлака СаО/SiO2 = 1,3 – 1,4.
Для упрощения расчета принимаем, что: все компоненты силикомарганца, т.е. находящиеся в исходной металлической фазе, переходят полностью в конечный сплав, за исключением компонента, участвующего в восстановительных процессах.
– MnO2 и Fe2О3 диссоциируют соответственно до Mn3О4 и Fe3О4, т.е. восстановление указанных высших оксидов до более низших оксидов происходит без затрат кремния, далее Mn3O4 и Fe3О4 восстанавливаются кремнием.
– электроды в восстановлении оксидов не участвуют и не оказывают влияние на состав сплава.
Состав шихтовых материалов в пересчете на основные составляющие приведен в табл. 1.
Таблица 1-Состав исходных материалов
|
Шиxто-вые материалы |
Содержание, % |
||||||||
|
MnO2 |
Mn2O3 |
SiO2 |
Al2O3 |
Fe2O3 |
Fe2O3 |
MgO |
P2O5 |
H2O |
|
|
Марганцевый концентрат |
45,0 |
27,7 |
12,18 |
1,48 |
3,78 |
2,44 |
0,85 |
0,28 |
6,29 |
|
СО2 |
Mn2O3 |
SiO2 |
Al2O3 |
FeO |
СаO |
MgO |
P2O5 |
H2O |
|
|
Известь |
5,16 |
– |
0,50 |
0,20 |
0,30 |
90,0 |
0,40 |
0,04 |
3,5 |
|
С |
Mn |
Si |
Al |
Fe |
P |
||||
|
Силикомарганец |
0,9 |
70,5 |
18,8 |
0,51 |
9,2 |
0,09 |
|||
Материальный баланс
Отправной точкой для расчета можно принимать либо 100 кг оксидного рудного материала, либо 100 кг восстановителя и по нему определить остальные компоненты шихты.
Предварительный расчет
Расчет ведем на 100 кг марганцевого концентрата, т.е. необходимо определить количество силикомарганца. Для этого нам нужно знать количество кислорода, связывающегося с кремнием силикомарганца в результате восстановления оксидного материала.
Определение навески силикомарганца
Согласно принятым условиям MnO2 диссоциирует до Mn3O4 без учасьтя кремния
3MnO2 ® Mn3O4 + O2
и при этом образуется
![]() = 39,48 кг Mn3O4 и 45,0 – 39,48 = 5,52 кг О2
= 39,48 кг Mn3O4 и 45,0 – 39,48 = 5,52 кг О2
Аналогичным образом диссоциируют
3Mn2O3 ® 2Mn3O4 + ![]() O2,
O2,
3Fe2O3 ® 2Fe3O4 + ![]() O2
O2
и при этом образуется
27,7![]() = 26,76 кг Mn3O4 и 27,7 – 26,76 = 0,94 кг О2
= 26,76 кг Mn3O4 и 27,7 – 26,76 = 0,94 кг О2
3,78![]() = 3,65 кг Fe3O4 и 3,78 – 3,65 = 0,13 кг О2
= 3,65 кг Fe3O4 и 3,78 – 3,65 = 0,13 кг О2
В дальнейшем идет процесс восстановления
2Mn3O4 + Si = 6MnO + SiO2
образуется
(39,48 + 26,76)![]() = 61,61 кг MnO
= 61,61 кг MnO
66,24 – 61,61 = 4,63 кг О2
Таким же образом
2Fe3O4 + Si = 6FeO + SiO2
образуется
3,65![]() = 3,40 кг FeO
= 3,40 кг FeO
с выделением 3,65 – 3,40 = 0,25 кг О2
При восстановлении закиси марганца до металла по реакции
2MnO + Si = 2Mn + SiO2
образуется
61,61· 0,48 ·![]() =22,91 кг Mn (в сплав),
=22,91 кг Mn (в сплав),
61,61·0,1 ·![]() =4,77 кг Mn (в газовую фазу),
=4,77 кг Mn (в газовую фазу),
и выделяется
61,61·0,58 – 27,68 – 8,05 кг О2.
Аналогично оценим процессы восстановления FeO и P2O5:
2FeO + Si = 2Fe + SiO2
3,40·0,95 · ![]() = 2,51 кг Fe (в сплав),
= 2,51 кг Fe (в сплав),
3,40 · 0,95 – 2,51 = 0,72 кг О2;
2Р2О5 + 5Si = 4P + 5SiO2
0,28 · 0,7 ·![]() = 0,086 кг Р (в сплав),
= 0,086 кг Р (в сплав),
0,28 · 0,1 ·![]() = 0,012 кг Р (в газовую фазу),
= 0,012 кг Р (в газовую фазу),
0,28 · 0,8 – 0,09 = 0,13 кг О2.
Таким образом количество кислорода при восстановлении руды кремнием составит
4,63 + 0,25 + 8,05 + 0,72 + 0,13 = 13,78 кг
Для связывания такого количества кислорода необходимо
Si + O2 = SiO2
13,78 · ![]() = 12,06 кг кремния или силикомарганца
= 12,06 кг кремния или силикомарганца
с учетом коэффициента использования кремния для восстановления оксидов
![]() = 86,11 кг.
= 86,11 кг.
Определение расхода извести
Основность шлака выражается соотношением СаО/SiO2 поэтому необходимо определить их содержание в шлаке. Для этого в первом приближении достаточно знать количество СаО и SiO2, переходящих из руды, и SiO2, образующегося при окислении кремния силикомарганца.
Из руды в шлак переходят 12,18 кг SiO2 и 2,44 кг СаО.
При окислении кремния силикомаргана переходит
86,11· 0,188(0,745 + 0,24) ![]() = 34,17 кг SiO2.
= 34,17 кг SiO2.
Следовательно для обеспечения требуемой основности шлака (принимаем 1,35) необходимо иметь в шлаке
(34,17 + 12,18) · 1,35 = 62,57 кг СаО,
т.е. необходимо ввести в шихту
62,57 – 2,44 = 60,13 кг СаО
или
60,13/0,90 = 66,81 кг извести.
Таким образом, в результате предварительного расчета определены количественные соотношения между компонентами шихты:
марганцевый концентрат ……………. 100 кг
силикомарганец……………………….. 86,11 кг
известь ………………………………… 66,81 кг
Определение количества и состава металла
Из 100 кг марганцевого концентрата в металл восстанавливаются следующие элементы в количестве, определенного в предыдущем разделе:
Mn – 22,91 кг, Fe – 2,51 кг, Р – 0,086 кг.
Из 86,11 кг силикомарганца в металл переходят:
Mn – 86,11 · 0,705 = 60,71 кг,
Fe – 86,11 · 0,092 = 7,92 кг,
Р – 86,11 · 0,0009 = 0,077 кг,
Si – 86,11 · 0,188 · 0,015 = 0,24 кг,
С – 86,11 · 0,009 = 0,77 кг.
Из 66,81 кг извести в сплав после восстановления переходят:
Fe – 66,11 · 0,003 · 0,45 · ![]() = 0,15 кг,
= 0,15 кг,
Р – 66,81 · 0,0004 · 0,7 · ![]() = 0,008 кг.
= 0,008 кг.
Количество и состав получаемого сплава:
Mn ……………….22,91 + 60,71 = 83,62 кг (87,67 %)
Fe …………2,51 + 7,92 + 0,15 = 10,58 кг (11,09 %)
Р ………..0,086 + 0,077 + 0,008 = 0,17 кг (0,18 %)
Si ………………………….0,24 = 0,24 кг (0,25 %)
С ………………………….0,77 = 0,77 кг (0,81 %)
Итого = 95,38 кг (100 %)
Полученный состав металла удовлетворяет требования, предъявляемые условием задачи.
Определение количества и состава шлака
100 кг марганцевого концентрата вносят в шлак следующие оксиды:
MnO …………………….61,61 · 0,42 = 25,88 кг,
FeO ………………………..3,4 · 0,05 = 0,17 кг,
SiO2 …………………………..12,18 = 12,18 кг,
Al2O3 …………………………...1,48 = 1,48 кг,
СаО …………………………….2,44 = 2,44 кг,
MgO ……………………………0,85 = 0,85 кг,
Р2О5 ……………………….0,28 · 0,2 = 0,06 кг.
Из 66,81 кг извести в шлак переходят:
СаО ………………………66,81 · 0,9 = 60,13 кг,
SiO2 …………………… 66,81 · 0,005 = 0,33 кг,
Al2O3 …………………...66,81 · 0,002 = 0,13 кг,
FeO ……………… 66,81 · 0,003 · 0,05 = 0,01 кг,
MgO …………………….66,81 · 0,004 = 0,27 кг,
Р2О5 ………………66,81 · 0,0004 · 0,2 = 0,01 кг.
Количество SiO2, образующегося при окислении кремния силикомарганца:
86,11 · 0,188 · 0,985 · ![]() = 34,17 кг
= 34,17 кг
Количество и состав полученного шлака:
MnO – 25,88 = 25,88 кг (18,74 %)
FeO – 0,17 + 0,01 = 0,18 кг (0,13 %)
SiO2 – 12,18+0,33+34,17 = 46,68 кг (33,80 %)
Al2O3 – 1,48 + 0,13 = 1,61 кг(1,17 %)
СаО – 2,44 + 60,13 = 62,57 кг (45,30 %)
MgO – 0,85 + 0,27 = 1,12 кг (0,81 %)
Р2О5 – 0,06 + 0,01 = 0,07 кг (0,05 %)
Итого = 138,11 кг (100 %)
Основность шлака СаО/SiO2 = 1,34, что находится в пределах значений оптимальной основности шлака. Кратность шлака 138,11/95,38 = 1,45.
Определение массы газовой фазы
В газовую фазу из 100 кг марганцевого концентрата вносится
Н2О – 6,29 кг,
Mn – 61,61 · 0,1 · ![]() = 4,77 кг,
= 4,77 кг,
Р – 0,28 · 0,1 · ![]() = 0,012 кг.
= 0,012 кг.
Из 66,81 кг извести выделяется в газовую фазу
СО2 – 66,81 · 0,0516 = 3,45 кг,
Р – 66,81 · 0,0004 · 0,1 · ![]() = 0,001 кг,
= 0,001 кг,
Н2О – 66,81 · 0,035 = 2,34 кг.
Некоторая часть кремния силикомарганца не участвует в восстановительных процессах и окисляется, взаимодействуя с кислородом, образовавшимся при диссоциации высших оксидов марганца и железа, и кислородом воздуха.
Масса такого кремния составляет
86,11 · 0,188 · 0,24 = 3,89 кг,
для окисления которого потребуется кислорода
3,89 · ![]() = 4,46 кг
= 4,46 кг
Если при диссоциации высших оксидов образуется кислорода
5,52 + 0,.94 + 0,13 = 6,59 кг,
то этого количества достаточно для полного окисления кремния силикомарганца и образует избыток
6,59 – 4,46 = 2,13 кг,
который будет учтен в материальном балансе, как переходящий в газовую фазу.
Общая масса газовой фазы
6,29 + 4,77 + 0,012 + 3,45 + 0,001 + 2,34 +2,13 =19,00 кг.
В том случае, когда в процессе окисления кремния участвует кислород воздуха в материальном балансе учитывается сопутствующий ему азот.
Материальный баланс процесса (табл. 2).
Таблица 2-Материальный баланс плавки
|
Приход |
Расход |
||||
|
Наименование материалов |
кг |
% |
Наименование продукта |
кг |
% |
|
Марганцевый концентрат Силикомарганец Известь |
100 86,11 66,81 |
39,55 34,04 26,41 |
Сплав Шлак Газовая фаза Невязка |
95,38 138,11 19,00 0,43 |
37,71 54,61 7,51 0,17 |
Всего 252,92 Всего 252,92 100
Расход шихтовых материалов на 1 т сплава, кг:
Марганцевый концентрат …………………….![]() = 1048,
= 1048,
Силикомарганец …………………………….. ![]() = 903,
= 903,
Известь …………………………………….. ![]() = 700.
= 700.
Практические занятия
Расчет материального и теплового балансов горения газообразного топлива
Количество тепла, которое выделяется при горении горючей смеси в единицу времени равно
Q1= ![]() кдж (ккал). (1)
кдж (ккал). (1)
В то же время количество тепла, которое передается в окружающую среду равно
Q11 = αF(Т-Т0), (2)
где R — газовая постоянная, дж/ (кг·град) [ккал/ (кг·град)];
α — коэффициент теплоотдачи, вт/(м2·град) [ккал/(м2·ч·град)];
F - поверхность сосуда, м2;
Е — энергия активации, кдж/кмоль (ккал/кмоль)
Если
Q1= Q11
тогда
![]() αF(Т-Т0) (3)
αF(Т-Т0) (3)
![]() = αF (4)
= αF (4)
Подставляя Ае Е/RТ из первого выражения во второе, получаем
![]() (Т — Т0) = 1. (5)
(Т — Т0) = 1. (5)
Меньший корень этого выражения соответствует равенству Т = Тв, поэтому уравнение для температуры воспламенения, полученное академиком Н. Н. Семеновым, имеет следующий вид:
TB= ![]() (1-
(1-![]() ) (6)
) (6)
Анализ полученного выражения показывает, что максимальная величина температуры воспламенения получается приT0 = ![]() , т.е
, т.е
TBмакс = ![]() (7)
(7)
Таким образом, при всех значениях температуры выше значения T0макс = ![]() находится область теплового взрыва, в которой стационарное течение процесса горения невозможно.
находится область теплового взрыва, в которой стационарное течение процесса горения невозможно.
При малых значениях Т0<![]() формула (6) может быть сведена к виду
формула (6) может быть сведена к виду
Тв = Т0 + ![]() (8)
(8)
Причем величина
Тв - Т0 = ![]() (9)
(9)
представляет собой характеристику предвзрывного разогрева горючей смеси, т. е. если
Тв - Т0 <![]() , (10)
, (10)
то тепловой взрыв невозможен.
Величина предварительного разогрева Тв - Т0 обычно невелика. Так при Е> 83800 кдж/кмоль (20000 ккал/кмоль) и Т0 <1000°К Тв - Т0 меньше 100 град. Таким образом, если Е достаточно велика, численное значение Тв мало отличается от Т0, что позволяет в ряде случаев вместо Тв пользоваться величиной Т0.
Исходя из представлений о тепловом взрыве, Н. Н. Семенов установил связь между давлением и температурой для системы в состоянии воспламенения. Согласно которой пока не будут достигнуты определенные температура и давление смесь не воспламенится. Температуры воспламенения различных топлив приведены в таблице 1.
Таблица 1. Температуры воспламенения в воздухе при атмосферном
давлении
|
Вещество |
Температура воспламенения, К |
Вещество |
Температура воспламенения, К |
||
|
минимальная |
максимальная |
мини-мальная |
макси-мальная; |
||
|
Водород |
803 |
863 |
Ацетилен |
608 |
773 |
|
Окисид углерода |
883 |
931 |
Бензин |
683 |
833 |
|
Метан |
918 |
1123 |
Керосин |
543 |
593 |
|
Этан |
803 |
867 |
Нефть |
498 |
|
|
Пропан |
803 |
861 |
Бурый уголь |
723 |
|
|
Бутан |
763 |
842 |
Кокс |
87.3 |
973 |
Горение водорода
Реакция горения водорода в настоящее время изучена наиболее полно, причем неоспоримо доказан цепной характер горения. По стехиометрическому уравнению горения водорода 2Н2 + О2 = 2Н2О получается, что по мере выгорания Н2 скорость реакции
w=k![]() , (11)
, (11)
должна замедляться. Однако на самом деле этого не происходит, так как скорость возрастает в результате цепного механизма реакции. Процесс сопровождается образованием активных центров реакции — атомов водорода и кислорода, а также радикалов. Действительный механизм горения водорода может быть представлен следующим образом:
Н2 + О2 = 2ОН,
![]() Н2 + М = 2Н + М (термическая диссоциация); Зарождение цепей
Н2 + М = 2Н + М (термическая диссоциация); Зарождение цепей
1) ![]() Н + О2 = OН + О,
Н + О2 = OН + О,
2) О + Н2 = ОН + Н, Разветвление цепей
3) 2OН + Н2 = Н2О + Н
4) Н + ЗН2 + O2 = 2Н2О + 3H
5) ![]() Н →
Н → ![]() Н2 обрыв на стенке, Затухание реакции
Н2 обрыв на стенке, Затухание реакции
6) Н+О2 + M = Н2О+M обрыв в объеме.
Из этой схемы видно, что участие в реакции одного атома водорода приводит к образованию трех новых атомов водорода, что вызывает многократное повторение циклов. Поскольку реакция 1 протекает наиболее медленно в силу ее эндотермичности и наибольшей энергии активации Е1= 75420 кдж/моль (18000 ккал/кмоль), она является лимитирующей и определяет протекание всего процесса в целом. В ходе реакции горения водорода происходит нарастание Н, что приводит смесь к состоянию взрыва.
Горение оксида углерода (II) в присутствии H2Oи H2.
В процессе горения оксида углерода большую роль играют водяные пары и водород. Сухая окись углерода до 700°С вообще не реагирует с кислородом. В присутствии Н2О и Н2 реакция горения СО идет как гомогенная цепная реакция со следующими элементарными стадиями:
1. ![]() Н2О + СО = Н2 + СО2 Зарождение цепей
Н2О + СО = Н2 + СО2 Зарождение цепей
2. Н2 + О2 = 2ОН;
3. ![]() ОН + СО = СО2 + Н; Продолжение цепей
ОН + СО = СО2 + Н; Продолжение цепей
4. Н + О2 = ОН + О;
5. ![]() О + Н2 = ОН + Н; Разветвление цепей
О + Н2 = ОН + Н; Разветвление цепей
6. 2Н + стенка = Н2; Обрыв цепей на
7. СО + О = СО2 стенке в объеме
Важная роль, которую играют Н2О и Н2 в процессе горения оксида углерода, объясняется тем, что они создают в пламени небольшие концентрации Н и ОН, необходимые для разветвления цепей. Причем необходима только начальная добавка Н2О и Н2, так как впоследствии Н2О и Н2 образуются как продукты цепной реакции.
Схема развития процесса приведена на рисунке 3
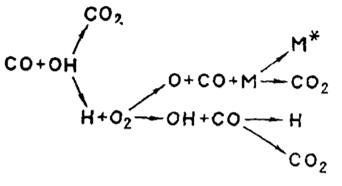
Рисунок 3. Схема горения СО
При горении СО скорость реакции зависит от добавок воды в начальный момент и от количества кислорода в смеси СО + О2. Область воспламенения смеси СО + О2 характеризуется своим «полуостровом воспламенения», представленным на рисунке 4.

1- расход смеси 60л/ч; 2 – 3 л/ч; 3- 2 л/ч; 4 – 1,2 л/ч.
Рисунок 4. Область воспламенения смеси СО + О2 .
Горение углеводородов
Общими чертами цепного механизма окисления углеводородов является то, что в их пламенах обнаружены гидроксил ОН и атомы О2, указывающие на возможность протекания элементарных процессов с участием какого-либо активного атома или свободного радикала R, которые могут образовываться по двум схемам:
1. R+O2 = RO2 и RO2 + RН → RООН + R.
Алкилгидроперекись RООН разлагается на свободные радикалы
2. R + O2 → RO2 и RООН → RО + ОН;
при высоких температурах радикал RO2 распадается по реакции
RO2 → R'СНО + R"O.
В дальнейшем альдегид, окисляясь, дает свободный радикал
RСНО + O2 → RСО + Н2O.
Следует отметить, что действие свободного радикала на исходную молекулу углеводорода приводит к отщеплению атома водорода, т. е. к разрыву связи С — Н, а не С — С.
Отщепившиеся атомы водорода в дальнейшем играют активную роль в процессе окисления. В качестве конкретного примера рассмотрим процесс окисления метана как наиболее распространенного углеводорода. Стехиометрическое уравнение горения метана СН4 + 2О2 → СО2 + 2Н2О - не отражает истинного механизма процесса, который протекает но наиболее вероятной следующей схеме:
2) СН4 + О2→СН3 + НО2,
2) СН3 + О2 → НСНО + ОН,
3) ОН + СН4 → СН3 + Н2О,
4) ОН + СН2О→ Н2О + НСО,
5) СН2О + О2→ НСО + НО2,
6) НСО + О2 → СО + НО2,
7) НО2 + СН4 →Н202 + СН3,
8) НО2 + СН20→ Н2О2 + НСО,
9) ОН ![]() обрыв.
обрыв.
Радикально – цепной процесс горения СН4 с вырожденным разветвлением представлен на рисунке 5.
Окисление других углеводородов происходит в основном в соответствии с вышеприведенной общей схемой окисления и во многом напоминает цепной характер окисления метана.
Воспламенению углеводородов всегда предшествует весьма значительный период индукции (до 0,5 ч); причем для метана связь между временем индукции (τинд), давлением (р) и температурой (Т) устанавливается формулой
![]() = const (12)
= const (12)
Время индукции для метана настолько значительно, что говорить о воспламенении (взрыве) без учета времени индукции нельзя. Изучение предельных значений давления и температуры при воспламенении метана показало, что метану, так же как водороду и окиси углерода, свойствен «полустров воспламенения», показанный на рисунке 6.
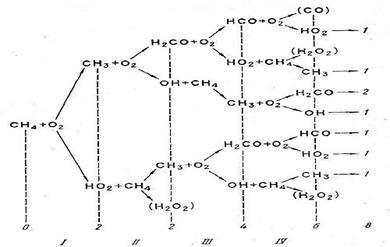
0,2,…-число активных частиц: I, II,…- номера элементарных актов.
Рисунок 5. Схема горения СН4.
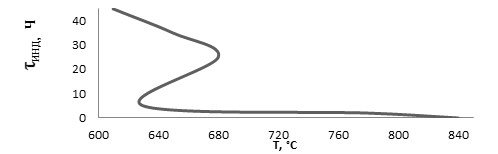
Рисунок 6. Область воспламенения смеси СН4 + 2О2
Горение твердого топлива
Процесс горения твердого топлива может быть разделен на следующие стадии: подогрев и подсушка топлива; процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка; горение летучих; горение коксового остатка (углерода).
При подогреве топлива до 2000С и выше идет процесс выделения летучих, т. е. горючей смеси различных газообразных составляющих — Н2, СО, СО2, СН4, СnНm и др. Количество летучих для разных углей различно, но весьма велико в отношении к массе всего топлива (табл. 2). Температура начала выделения летучих зависит от возраста угля. Чем «старше» уголь, чем выше в нем содержание углерода, тем при более высокой температуре начинается процесс выделения летучих, что видно из таблицы 2. Летучие в процессе горения твердого топлива играют важную роль, причем роль эта различна при горениии кускового топлива и пыли.
Таблица 2-Выход летучих различных твердых топлив, % по массе
топлива
|
Уголь |
При 8500С в воздушной среде |
При 12000С в безкислородной среде |
|
Антрацит |
3,9-5,6 |
6,9-7,5 |
|
Тощий |
14,3 |
17,3 |
|
Газовый |
39,0 |
38,3-40,6 |
|
Длиннопламенный |
46,7 |
49,6 |
|
Якутский |
90,0-83,6 |
90,0-91,5 |
При горении кускового топлива летучие выделяются при сравнительно умеренных температурах, смешиваются с воздухом и воспламеняются первыми. Таким образом, горением летучих начинается процесс горения всего топлива. Тепло, выделяемое при горении летучих, способствует повышению температуры и дальнейшему развитию процесса горения. Горение углерода начинается уже после завершения выхода летучих, так как кислород расходуется на горение летучих и не поступает к поверхности твердых частиц. Поэтому горение самого углерода более- продолжительное и именно оно определяет время протекания всего процесса. Поэтому основой процесса горения твердого кускового топлива является горение углерода.
При сжигании угольной пыли основная масса летучих не успевает выделиться до момента воспламенения частиц, поэтому летучие сгорают вместе с углеродом.
Горение углерода в общем виде можно характеризовать еле дующими реакциями:
- горение углерода:
С + О2 = С02 + 399253,5кдж/кмоль (97 650 ккал/кмоль): (13)
2С + 02 = 2СО + 246623,4 кдж/кмоль (58 860 ккал/кмоль)] (14)
- разложение углеродом двуокиси углерода и водяного пара:
С + С02 = 2СО — 162530,1 кдж/кмоль (38 790 ккал/кмоль}; (15)
С + 2Н20 = СО2 + 2Н2 — 65294,2 кдж/кмоль (17 970 ккал/кмоль); (16)
- окисление окиси углерода кислородом:
2СО + О2 = 2СО2+ 571683,6кдж/кмоль (136 440 ккал/кмоль). (17)
Реакции горения углерода являются первичными реакциями процесса горения, а реакции 2 и 3 — вторичными. В настоящее время еще окончательно не установлено, что образуется сначала — СО или СО2. Есть основание предполагать, что СО и СО2 образуются одновременно по реакции
4С + 3О2 = 2СО2 + 2СО. (18)
Литература
1 Валиев Х. Х. Металлургия свинца, цинка и сопутствующих металлов / Валиев Х. Х., Романтеев Ю. П. – Алматы: 2000. – 441 с.
2 Воскобойников В. Г. Общая металлургия: учебник для
вузов / Воскобойников В. Г. , Кудрин В. А., Якушев А. М. – М. : Металлургия, 1987. – 240 с.
3 Диев Н. П. Металлургия свинца и цинка / Диев Н. П., Гофман И. А. – М. : Металлургиздат, 1961. – 406 с.
4 Диомедовский Д. А. Металлургические печи цветной
металлургии. – М. : Металлургиздат, 1970. – 265 с.
5 Зайцев В. Я. Металлургия свинца и цинка / Зайцев В. Я., Маргулис Е. В. – М. : Металлургия, 1985. – 263 с.
6 Казачков Е. А. Расчеты по теории металлургических
процессов: учеб. пособие для вузов. – М. : Металлургия, 1988. – 288 с.
7 Коротич В. И. Металлургия: учебник для вузов. –Екатеринбург: УГТУ, 2001. – 395 с.
8 Полькин С. И. Обогащение руд цветных и редких
металлов / Полькин С. И., Адамов Э. В. – М. : Недра, 1975. – 154 с.
9 Спурников А. П. Комплексное использование сырья в
цветной металлургии. – М. : Металлургия, 1977. – 35 с.
10 Цейдлер А. А. Цветные металлы. – М. : Металлургиздат, 1931. – 1259 с.
Похожие работы
... = 0,7∙7,023 = 4,916 нм3 Определяем продолжительность продувки, мин , где - интенсивность продувки, нм3/(т∙мин) - (задана). = = 14,9 мин. Количество и состав конвертерных газов: = + ; кг (2.50) = ∙22,4/44; нм3 = 1.17 + 0.01(7,94∙3,5 + 0,4∙6,0) = 1,472 кг = 1,472∙22,4/44 = 0,749 нм3 = , кг (2.51) = ∙22,4/28; нм3 = 6,63 кг ...
... мартеновской плавки. От интенсивности передачи тепла твердой шихте или жидкой ванне зависит скорость нагрева и плавления шихтовых материалов и качество работы мартеновской печи в целом. Большая часть различных мер (совершенствование конструкции головок и печи в целом, организация факела и режима завалки и т. д.) направлена на то, чтобы создать условия, при которых максимум подведенного тепла в ...
... - дальнейшее развитие, совершенствование и разработка новых технологических методов обработки заготовок деталей машин, применение новых конструкционных материалов и повышение качества обработки деталей машин. Наряду с обработкой резанием применяют методы обработки пластическим деформированием, с использованием химической, электрической, световой, лучевой и других видов энергии. Классификация ...
... не оставалось кусков шихты, она не должна содержать рудных частиц крупностью > 8 мм и известняка > 3 мм; необходимо также увеличивать расход топлива. 3.4 Агломерационная машина и технологический процесс производства агломерата В состав агломерационной фабрики входят комплекс оборудования для подготовки шихты, ленточные (конвейерные) агломерационные машины и комплекс оборудования для ...


0 комментариев