Навигация
5. ПРОСТЫЕ ОКСИДЫ ЕВРОПИЯ
В системе европий-кислород образуются оксиды Eu2O3 и Eu3O4, EuO1.31 (Eu16O21) и EuO.
Полуторный оксид E2O3 обладает структурой С-типа, которая при 11000С переходит в В-модификацию. Структура Eu3O4 – ромбическая, EuO имеет структуру NaCl.
Восстановление водородом приводит к значительным отклонениям состава E2O3 от стехиометрического [27] в результате восстановления в течение 2 ч при ![]() торр и температуре 6500С образуется оксид с усредненным составом EuO1.4928. Электропроводность такого оксида после обработки кислородом дегазациипри 800°С не изменяется. Исследование полупроводниковых свойств спеченных образцов при 200-350°С в атмосфере СО (760-5 торр) показало [28], электропроводность оксида увеличивается при понижении давления СО, а энергия активации проводимости уменьшается от 0,68 эВ при 760 торр до 0,43 эВ при 5 торр. Эти данные не позволяют сделать однозначные выводы о дефектной структуре и механизме проводимости.
торр и температуре 6500С образуется оксид с усредненным составом EuO1.4928. Электропроводность такого оксида после обработки кислородом дегазациипри 800°С не изменяется. Исследование полупроводниковых свойств спеченных образцов при 200-350°С в атмосфере СО (760-5 торр) показало [28], электропроводность оксида увеличивается при понижении давления СО, а энергия активации проводимости уменьшается от 0,68 эВ при 760 торр до 0,43 эВ при 5 торр. Эти данные не позволяют сделать однозначные выводы о дефектной структуре и механизме проводимости.
Опубликованы также данные по электропроводности на постоянном токе спеченных образцов Eu203 (99,97%) [29]. Порошки оксида, имеющего структуру С-типа, спекались при 1000°С до плотности, составляющей приблизительно 50% от теоретической. Образцы моноклинной модификации (В-тип) готовились при 1400°С, и их плотность составляла 90% от теоретической.
Зависимость электропроводности С-модификации от парциально давления кислорода при 700°С показана на рис.11. Проводимость оксида соответствовала р-типу при давлениях выше l0-7атм и n-типу – ниже 10-20 атм. В области промежуточных давлений наблюдается минимум электропроводности. Полученные данные были объяснены на основе предположения, что при давлениях, близких к атмосферному, основными дефектами являются полностью ионизированные катионные вакансии. Однако совокупность полученных данных в принципе отражает преобладание дефектов различных типов при высоких и низких давлениях кислорода. В области промежуточных давлений состав оксида, по-видимому, близок к стехиометрическому. С другой стороны, зависимость электропроводности E2O3 от давления кислорода характерна для внешней области, в которой свойства определяются содержанием примесей. Это означает, что в области промежуточных давлений доминирует ионная проводимость. Все это подтверждено результатами исследования оксидов РЗЭ методом ЭДС [30] и по аналогии с другими оксидами позволяет считать рассмотренный подход корректным и для анализа свойств E2O3.
Энергия активации проводимости С-модификации E2O3 в кислороде и на воздухе равны 1,2 и 1,1 эВ (27,6 и 25,3 ккал/моль) соответственно.
Измерения электропроводности В-модификации на воздухе при 400-10000С дали для энергии активации проводимости значение 1,18 эВ (27,2 ккал/моль). По данным работы [29] нельзя установить, сохраняется ли в какой-то степени моноклинная структура ниже температуры перехода.
6. УСТОЙЧИВОСТЬ ПОЛУТОРНЫХ ОКСИДОВ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
В пятидесятых годах нашего века было налажено получение редкоземельных элементов высокой степени чистоты в достаточных для термохимических исследований количествах. К этому периоду относится появление целого ряда работ, посвященных определению теплот образования оксидов редкоземельных элементов.
Таблица 7. Термохимические константы для оксидов РЗЭ
| Оксид | Структура | ΔH0298, ккал./моль | ΔS0298кал./моль • град. | ΔF0298ккал./моль |
| La2O3 Ce2O3 Рг2O3 . . . { Nd2O3 . . . . { Sm2O3 Eu2O3. . . . { Gd2O3 . . . { Tb2о3 Dy2O3 Ho2O3 Er2O3 Tm2O3 Yb2O3 Lu2O3 | Гексагон. » » Кубич. Гексагон. Кубич. Моноклин. » Кубич. » Моноклин. Кубич. » » » » » » » | —428.57 [87-89] —434.93 [85], —427.01 [90] —435.8 [91] —436.8 [91] —432.15 [92] —429.8 —433.89 [93] —393.9 [94] —389.6 [94] —386.97 [95] —433.94 [96] —427.8 —436.8 [97] —445.84 [98] —449.55 [99] — 453.59 [100] —451.4(101] —433.68 [98] —448.9 1102] | 70.4 [103] 70.4 [104] (70.8)[104] (70.8)[104] 70.7 [103] (70.8) 70.6 [105] - - - 69.0 [105] 71.6 [104] 73.4 [106] 71.7 [106] 71.9 [106] 71.4 [104] 69.0 [105] 71.2 [104] | —407.6 —414.0 (—414.8) (—415.6) —411.1 - —412.85 - - - —413.37 —415.4 —424.0 —428.2 —432.2 —430.2 —412.31 —427.7 |
Было показано, что образование полуторных оксидов окислением редкоземельных металлов сопровождается большим выделением тепла. Образовавшиеся оксиды являются весьма устойчивыми. Они плавятся выше 2000° и не разлагаются до температуры плавления. Исключение составляют только оксиды самария и иттербия, которые в присутствии восстановителей или в глубоком вакууме при очень высоких температурах переходят в оксиды, менее богатые кислородом.
Таблица 8. Вклады, вносимые различными частицами в величину Sреш (ккал./моль·град.) [25]
| О О1.33 O1.5 O1.67 O2 | - 2 - 1 0 + 1 + 2 | La Се Pr Nd Sm | 15.2 14.65 14.6 14.45 14.2 | Eu Gd Tb Dy Ho | 14.1 14.0 13.8 13.6 13.45 | Er Tm Yb Lu | 13.3 13.2 13.1 13.0 |
В табл. 7 приведены теплоты образования полуторных оксидов редкоземельных элементов по данным различных авторов.
В работах Веструма [24-26, 32] были определены низкотемпературные теплоемкости и вычислены свободные энергии и энтропии большинства полуторных оксидов редкоземельных элементов при стандартных условиях (табл. 7). Полученные экспериментальные значения энтропии при 2980 К хорошо согласуются с вычисленными суммированием магнитной составляющей с энтропией решетки (Sреш.) (табл. 8).
Таблица 9. Значение энтропии (кал./моль · град.) оксидов редкоземельных элементов при 298° К
| Данные работы [104] | Данные | работы [107] | |||||
| Оксид | Sреш | Sмагн | Вычисл. S0298° | с S0298° - ST | Т°, К | Экстраполир. ST – S0 | Эксперим. S0298° |
| La2O3 | 30.4 | 0 | 30.4 | 30.43 | 5 | 0.002 | 30.43 |
| Ce2O3 | 29.3 | 7.12 | 36.4 | - | - | - | — |
| Pr2O3 | 29.2 | 8.72 | 37.9 | - | - | - | — |
| Nd2O3 | 28.9 | 9.14 | 38.0 | 35.05 | 5 | 2.8 | 37.9 |
| Sm2O3 | 28.4 | 7.12 | 35.4 | 33.22 | 10 | 2.9 | 36.-1 |
| Eu2O3 | 28.2 | - | - | - | - | - | — |
| Gd2O3 | 28.0 | 8.26 | 36.26 | 28.33 | 10 | 7.8 | 36.0 |
| Tb2O3 | 27.6 | 10.19 | 37.5 | - | - | - | —- |
| Dy2O3 Ho2O3 | 27.2 26.9 | 11.02 11.26 | 38.1 38.2 | 33.06 32.38 | 10 10 | 2.7 - | 35.8 37.8 |
| Er2O3 Tm2O3 | 26.6 26.4 | 11.02 10.19 | 37.6 36.6 | 33.81 - | 10 - | 2.8 - | 36.0 |
| Yb2O3 Lu2O3 | 26.2 26.0 | 8.26 0 | 34.5 20.0 | 29.01 - | 10 - | 2.8 - | 31.8 |
Для полуторных оксидов вклад, вносимый кислородом О1,5 близок к нулю, а вклад, вносимый катионом, уменьшается с увеличением атомного номера редкоземельного элемента. В табл. 9 приведены значения энтропии оксидов, вычисленные на основании lанных табл. 8 и измеренные при низких температурах.
Изучение термохимических свойств при высоких температурах было проведено Кингом, Келли, Панкратцем [33-35], Цага-Реашвили и Гвелесиани [36], Бломке и Цигелем [37] и др.

Рис.5. Энтальпия образования оксидов РЗЭ при высоких температурах.
1 — Ег2О3; 2 — Тm2О3; 3 — Но2О3; 4 — Dy2O3; 5 — Ce2O3; 6 — Yb2О3; 7 - Nd2O3; 8 — La2О3; 9 - B-Eu2O3; 10 — C-Eu2O3.
На рис.4 приведены энтальпии образования оксидов при высоких температурах. На кривых теплоемкостей оксидов церия, диспрозия, тулия и иттербия в высокотемпературной области были замечены небольшие термические аномалии, не сопровождающиеся изменением кристаллической структуры оксидов. По мнению авторов, такиеаномалии могут быть вызваны лишь внутриатомные процессами и не могут быть следствием изменения микрокристаллической структуры.
Как уже было сказано, при термическом разложении кислородосодержащих солей или при окислении металлов обычно образуются кубические формы полуторных оксидов. Кубические формы оксидов редкоземельных элементов с малыми размерами ионных радиусов остаются устойчивыми вплоть до температур плавления. При нагревании кубических форм оксидов (от La2О3 до Gd2О3) наблюдается необратимое превращение их в гексагональные или моноклинные формы. Калориметрические измерения показали, что превращения кубических форм оксидов неодима, европия и гадолиния в соответствующие гексагональные и моноклинные формы сопровождаются выделением тепла (кал./моль):
Тип перехода кал./моль
Nd3О3...... С→А 2350
Eu203...... С→В 3430
Gd2O3...... С→В ~ 6000
Таким образом, экспериментально была доказана метастабильность С-форм этих оксидов.
Панкратц, Кинг и Келли [33], изучавшие термохимические свойства оксидов неодима, европия, самария и гадолиния при высоких температурах пришли к следующему выводу. По их данным, кубические формы оксидов самария, европия и гадолиния неустойчивы и превращаются необратимо в моноклинные В-формы.
Рассматривая полиморфизм оксидов редкоземельных элементов, нельзя не попытаться дать объяснение положению, что А-тип оксидов устойчив для больших катионов, а С-тип — для малых. В табл. 10 приведены данные, показывающие зависимость конфигурации координационной сферы от отношения радиуса катиона к радиусу аниона.
Таблица 10. Различные конфигурации координационной сферы
| Координационное число | Конфигурации координа- [ ционной сферы | Отношение радиусов |
| 3 4 4 6 8 12 | Треугольник АХ3 Тетраэдр АХ4 Квадрат АХ4 Октаэдр AX6 Куб AX8 Плотнейшая кубическая или гексагональная упаковка АХ12 | 0.158 ≤А ≤ 0.225 0.225 ≤ к ≤ 0.415 0.415 ≤ к ≤ 0.732 0.415 ≤ к ≤ 0.732 0.732 ≤ А ≤1.00 k≈1.0 |
В настоящее время в физике твердого тела приводится следующее объяснение этой таблицы. Взаимодействие сферически симметричных ионов является ненаправленным и ненасыщенным. Ненасыщенность ионной связи проявляется в том, что каждый ион стремится приблизить к себе как можно больше противоположна заряженных ионов, т. е. образовать структуру с возможно более высокими координационными числами. Однако эти конфигурации неустойчивы в том случае, если катионы настолько малы, что свободно помещаются между анионами и могут «болтаться» в соответствующих пустотах. Если катион приблизится к части окружающих его анионов (к. ч. понизится), то электростатическая энергия системы ионов уменьшится, а, следовательно, устойчивость системы возрастет [38].
Структура А-типа (гексагональная) состоит из координационных полиэдров, расположенных вокруг ионов редкоземельного элемента. Каждый полиэдр образован семью ионами кислорода, три из которых расположены на более удаленном расстоянии и четыре – на более близком расстоянии. Например, для La3О3 эти расстояния равны 2.68—2.78 А и 2,28—2.48 А соответственно. При переходе от окиси лантана к оксидам редкоземельных элементов с меньшими ионными радиусами расстояния М . . .О соответственно уменьшаются. Однако если в оксидах от La2O3 до Nd2О3 сумма ионных радиусов металла и кислорода практически равна расстоянию М . . .О, то начиная с Sm303![]() < dM…O, что приводит к неустойчивости структуры А-формы для оксидов элементом с ионным радиусом, меньшим, чем у неодима.
< dM…O, что приводит к неустойчивости структуры А-формы для оксидов элементом с ионным радиусом, меньшим, чем у неодима.
В структуре В-формы (моноклинной) имеется три типа координационных полиэдров. Общим для всех трех типов является то, что расстояния М. . .О для шести кислородных ионов несколько меньше, чем в соответствующей А-форме, в то время как седьмой ион значительно удален. Так, для окиси самария среднее значение М. . .О для шести кислородных атомов составляет 2.38—2.41 А, седьмой же кислородный атом находится от атома металла на расстоянии 2.71- 2.76 или 3.12 А в зависимости от типа полиэдра. Это позволяет некоторым авторам рассматривать структуру В-формы как состоящую из смеси МО6- и МО7- полиэдров, а следовательно, являющуюся промежуточной между А- и С-формами, структуры которых создаются из одного типа координационных полиэдров (МО7 — в гексагональном А-типе и МО6 — в кубической С-форме). Структура В-формы является устойчивой для оксидов самария, европия и гадолиния вплоть до температур 2000—2300°.
В кубической С-форме кристаллизуются оксиды редкоземельных элементов, имеющие меньший ионный радиус, чем гадолиний. Так как увеличение температуры равносильно увеличению «эффективного» радиуса катиона, можно наблюдать обратимый фазовый переход для оксидов, находящихся на границе устойчивости С- и В-форм или В- и А- форм. В предыдущих разделах было показано, что для оксидов диспрозия, тербия и гольмия в действительности наблюдается обратимый переход С ↔ В-типа, а для оксидов европия и самария — переход В ↔А-типа, причем чем меньше ионный радиус элемента при стандартных условиях, тем до более высоких температур нужно нагреть оксид, чтобы осуществить превращение С ↔В или В ↔А. В работе Ладда и Ли [39] были рассчитаны энергии решеток оксидов редкоземельных элементов. Расчет проводился с использованием как формулы Борна—Габера
U=ΔH— (I + S)M— ![]() — E0 + 2RT
— E0 + 2RT
где U — энергия решетки, ΔH — энтальпия образования оксида, (I + S)M—энергия ионизации и сублимации редкоземельного металла, ![]() и ЕО — энергия диссоциации и сродство к электрону для кислорода, так и по формуле
и ЕО — энергия диссоциации и сродство к электрону для кислорода, так и по формуле
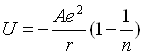
где А — константа Маделунга, г — расстояние между ближайшими ионами противоположного знака, п — степень потенциалf отталкивания. На рис. 46 представлены расчетные данные Лада и Ли для энергии А- и С-форм оксидов в зависимости от ионного радиуса редкоземельного элемента, а также ориентировочный ход кривой энергии решетки для В-формы оксидов.
Наблюдаемые области Стабильности различных структурных форм хорошо согласуются с предположением, что тип полуторной окиси, существующий при обычном давлении, всецело определяется температурой и размером катиона. Тем не менее иногда в процессе образования кристаллического вещества может образоваться структура, энергетически менее выгодная. Но в любом случае реальная кристаллическая решетка будет стабильна при условии абсолютного или относительного минимума свободной энергии. Практически это проявляется в том, что при образовании полуторных оксидов, независимо от размера катиона, сначала образуется С-форма оксида. Для больших катионов эта форма оксида является местабильной, однако переход ее в стабильную равновесную модификацию возможен вплоть до высоких температур.
Относительная устойчивость оксидов в метастабильной С-форме, т.е. оксидов элементов с ионным радиусом, большим, чем у тербия, повышается в ряду от La203 до Gd203. Как видно из рис. 8, одновременно с уменьшением ионного радиуса катиона наблюдается увеличение энергии решетки, а следовательно, и энергии связи М. . .0 [40] (как для устойчивых форм, так и для метастабильной С-формы), что приводит к возрастанию энергии активации и температуры перехода С-формы в устойчивые А- или В-формы.
Кроме этого, уже было показано, что не существует строго определенной температуры фазового перехода, а наблюдается расширенный интервал температур, внутри которого происходит превращение. Так как энергия активации зависит от совершенства кристаллической решетки метастабильной фазы, ширина температурного интервала и его положение сильно зависят от предыстории образца и от дефектности его структуры.
Для обратимых фазовых превращений классическая теория требует наличия определенной температуры перехода кубической модификации в моноклинную. При этой температуре свободная энергия моноклинной фазы GMравна свободной энергии кубической фазы Gk; температура перехода, полученная при нагревании вещества, равна температуре перехода при охлаждении (рис. 6, а).
Однако, как было показано Убберхольдом [41], свободная энергия является функцией не только давления и температуры, но и параметров α и β, характеризующих энергию внутренних напряжений фазы и ее поверхностную энергию, зависящую от состояния соседней фазы. Эти параметры α и β определяются физическим состоянием фаз в системе и существенно различны для зарождающегося зародыша новой фазы и окружающей его матрицы старой фазы.
Таким образом, для оксидов тербия, диспрозия и гольмия вблизи температуры превращения мы имеем четыре функции свободной энергии.
Превращение при нагревании
1) Gk=fk(p, Т, αk, βk)—свободная энергия кубической матрицы,
2) GM’ = fM(p, Т, α'М, β' М)— свободная энергия зародыша кубической фазы в кубической матрице.
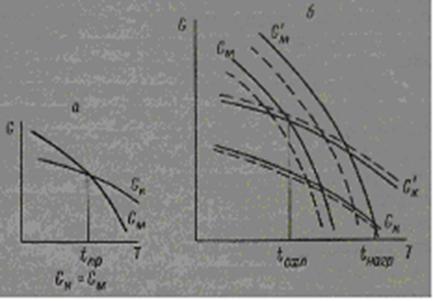
Рис.6. Изменение свободной энергии кубической и моноклинной форм оксидов в зависимости от температуры
а — превращение без гистерезиса; б — превращение с гистерезисом. Пунктиром показано смещение температур фазовых превращений при образовании твердых растворов.
Превращение при охлаждении
3) GМ=fM(p, Т, αM, βM)—свободная энергия моноклинной
матрицы,
4) Gk’ = fk(p, Т, α'k, β'k)—свободная энергия зародыша кубической фазы в моноклинной матрице.
Изменение этих четырех функций Gk, G'M, GM и G’k представлено на рис. 9, б. Условием равновесия будет G'M= Gk при нагревании и G’k = GM при охлаждении. Эта простая схема дает ясное представление о наблюдаемом у этих оксидов явлении гистерезиса: для Tb2О3 Δ(tнагр—tохл)=3000 и для Dy2O3 Δ(tнагр—tохл)=2000 [21]. Кроме этого, для обратимых превращений можно предположить наличие смещении кривых (показано на рис. 6, б пунктиром) свободной энергии в зависимости от совершенства кристаллической решетки каждой из фаз. Однако при высоких температурах и больших скоростях обратимых превращений этот фактор будет оказывать значительно меньшое влияние, чем в случае медленно протекающих необратимых фазовых превращений.
Для однотипных кристаллических веществ термодинамическое условие минимума свободной энергии во многих случаях с достаточной точностью можно заменить условием минимума объема. Критерием объемных изменений, происходящих при образовании соединений, может служить коэффициент компактности структуры q, который равен отношению объема частиц, образующих кристалл, ко всему объему кристалла:

где zi — число частиц сорта i в элементарной ячейке, Vi — объем частицы, Va — объем элементарной ячейки. Из рисунка видно, что коэффициент q изменяется симбатно с изменением — ΔН0 (исключение составляют только оксиды европия и иттербия, склонные к восстановлению при высоких температурах). А-тип структуры является наиболее устойчивым для оксидов элементов с ионным радиусом, большим чем 0.97 А, т. е. для La2О3, Ce2О3, Рr2О3, Nd2О3. Для элементов с меньшим ионным радиусом более устойчивым является В-тип структуры. С-тип структуры является наименее плотно упакованным. Поэтому возможно осуществить С → В-превращение воздействием высокого давления [23]. Однако В-формы оксидов от Но2О3 до Lu2О3 устойчивы только при высоком давлении и переходят обратно в С-формы при снижении давления.
Похожие работы
... MnY2S4 и фазы MgLn4S7 моноклинной сингонии. Условие существования фаз, характер плавления не известны. Ограниченность и неполнота литературных данных определяет актуальность задачи изучения фазовых равновесий в системе MgS – Y2S3. Глава 2. Методическая часть. 2.1. Методы физико-химического анализа Исходя из свойств полуторных сульфидов, таких, как термическая стабильность, летучесть, и ...
... (tпл. GdCl3 = 610˚C), остывший трихлорид хранили в герметически закрытых ампулах. Все операции с солью проводились в сухом боксе. Глава Ш. Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах. Из анализа литературных данных следует, что процесс электровосстановления алюминия из хлоридных и фторидных расплавов изучался в основном на платиновом ...
... отходам производства. В докладе «О состоянии окружающей природной среды Российской Федерации в 1997 году» Государственного комитета Российской Федерации по охране окружающей среды отмечается, что на начало 1997 г. на предприятиях различных отраслей промышленности накоплено 1431,7 млн. т токсичных отходов. За 1997 г. на промышленных предприятиях РФ образовалось 89,4 млн т токсичных отходов, из ...
... отходы образуются в процессе переработки нефти в виде кислых гудронов, нефтяных шламов, отработанных масел и др. ГЛАВА 3. ИЗВЛЕЧЕНИЕ КРЕМНЕФТОРИСТОВОДОРОДНОЙ КИСЛОТЫ ИЗ ПРОЦЕССА ПРОИЗВОДСТВА ФОСФОРНОЙ КИСЛОТЫ В процессе производства концентрированных фосфатных удобрений фосфорсодержащая руда подвергается экстракции раствором серной кислоты. Полученная разбавленная фосфорная кислота ...
0 комментариев