Навигация
Ковалентная полярная связь образуется между атомами различных неметаллов
2. Ковалентная полярная связь образуется между атомами различных неметаллов.
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или отдачи электронов. Ионная связь характерна для солей и щелочей. Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору.
В итоге образуются противоположно заряженные частицы — ионы Na+ и Сl-, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами[8].
После рассмотрения каждого вида связи следует перейти к их сравнительной характеристике.
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалентная неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалентная полярная. В случае, если электроны, участвующие в образовании связи, принадлежат одному атому, то связь ионная.
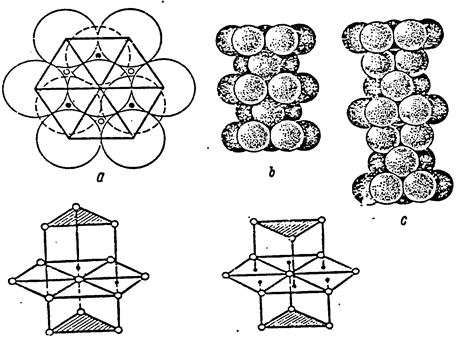
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
Все вышеперечисленные отличия в механизме образования связи объясняют различие в свойствах веществ с разными видами связей.
3. Закон постоянства состава вещества Пруста
К основным законам химии относится закон постоянства состава:
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный качественный и количественный состав.
Атомно-молекулярное учение позволяет объяснить закон постоянства состава. Поскольку атомы имеют постоянную массу, то и массовый состав вещества в целом постоянен.
Закон постоянства состава впервые сформулировал французский ученый-химик Ж.Пруст в 1808 г. Он писал: "От одного полюса Земли до другого соединения имеют одинаковый состав и одинаковые свойства. Никакой разницы нет между оксидом железа из Южного полушария и Северного. Малахит из Сибири имеет тот же состав, как и малахит из Испании. Во всем мире есть лишь одна киноварь".
В этой формулировке закона, как и в приведенной выше, подчеркивается постоянство состава соединения независимо от способа получения и места нахождения[9].
Развитие химии показало, что наряду с соединениями постоянного состава существуют соединения переменного состава. По предложению Н.С. Курнакова первые названы дальтонидами (в память английского химика и физика Дальтона), вторые - бертоллидами (в память французского химика Бертолле, предвидевшего такие соединения). Состав дальтонидов выражается простыми формулами с целочисленными стехиометрическими индексами, например Н2О, НCl, ССl4, СO2. Состав бертоллидов изменяется и не отвечает стехиометрическим отношениям.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение.
Состав соединений молекулярной структуры, т.е. состоящих из молекул, - является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения[10].
4. Закон кратных отношений Дж.Дальтона
Кратных отношений закон, закон Дальтона, один из основных законов химии: если два вещества (простых или сложных) образуют друг с другом более одного соединения, то массы одного вещества, приходящиеся на одну и ту же массу другого вещества, относятся как целые числа, обычно небольшие. К. о. з. открыт в 1803 Дж. Дальтоном и истолкован им с позиций атомизма.
Примеры:
1) Cостав окислов азота (в процентах по массе) выражается следующими числами:
| Закись азота N2O | Окись азота NO | Азотистый ангидрид H2O3 | Двуокись азота NO2 | Азотный ангидрид N2O5 |
| N…63,7 | 46,7 | 36,8 | 30,4 | 25,9 |
| O…36,3 | 53,3 | 63,2 | 69,6 | 74,1 |
| Частное O\ N…0,57 | 1,14 | 1,71 | 2,28 | 2,85 |
Разделив числа нижней строки на 0,57, видим, что они относятся как 1: 2: 3: 4: 5.
2) Хлористый кальций образует с водой 4 гидрата, состав которых выражается формулами: CaCl2×H2O, CaCl2×2H2O, CaCl2×4H2O, CaCl2×6H2O, т. е. во всех этих соединениях массы воды, приходящиеся на одну молекулу CaCl2, относятся как 1: 2: 4: 6[11].
химический атомная валентность электрон
Похожие работы
... момент. Поэтому до перехода к изучению более сложных теорий необходим исторический анализ идей и постулатов периодической классификации. 2. Периодическая система элементов Не считая попыток Лавуазье и его школы дать классификацию элементов на основе критерия аналогии в химическом поведении, первая попытка периодической классификации элементов принадлежит Дёберейнеру. Он заметил, что если ...
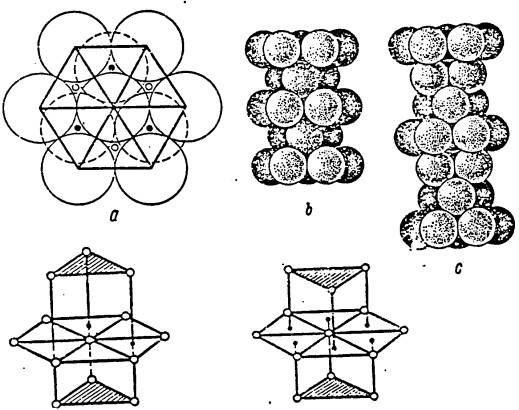
... металлов". Ленинград, 1933г. 5. Г.Г.Скидельский "От чего зависят свойства кристаллов". "Инженер" № 8, 1989г. 6. Б.Ф.Ормонт "Введение в физическую химию и кристаллохимию полупроводников", Москва, 1968 год ПРИЛОЖЕНИЕ 1. Металлическая связь в плотнейших упаковках (ГЕК, ГЦК) Из рассуждений о числе направленных связей (или псевдосвязей, т.к. между соседними атомами металла находится зона проводимости) ...
... до точки плавления, цинк опять становится хрупким – происходит очередная перестройка его кристаллической структуры. Листовой цинк широко применяют в производстве гальванических элементов. Первый «вольтов столб» состоял из кружочков цинка и меди. И в современных химических источниках тока отрицательный электрод чаще всего делается из элемента №30. Значительна роль этого элемента в полиграфии. Мы ...
... Я.Г.Дорфман, И.К.Кикоин "Физика металлов". Ленинград, 1933г. 5. Г.Г.Скидельский "От чего зависят свойства кристаллов". "Инженер" № 8, 1989г. Гродно Г. Г. Филипенко март 199бг. ПРИЛОЖЕНИЕ 1. Металлическая связь в плотнейших упаковках (ГЕК, ГЦК) Из рассуждений о числе направленных связей (или псевдосвязей, т.к. между соседними ...





0 комментариев