Навигация
Дегидратация соединения 5
3. Дегидратация соединения 5
Рассчитывая получить соединения 20, 22, мы изучили реакцию дегидратации соединения 5 в различных растворителях (серный эфир, ТГФ, бензол, этанол) под действием кислот (p-TsOH, HCI) при 20 0С. Исходное соединение возвращалось неизменным. Однако при кипячении в уксусной кислоте (20 мин, Т=130 °С) и последующей нейтрализации раствором соды с выходом 84 % получили кетон 22. Его структура была доказана на основании ГЖХ-МС, ИК и ЯМР 1Н, 13С-спектроскопии.
Рис. 4. Хроматограмма и масс-спектр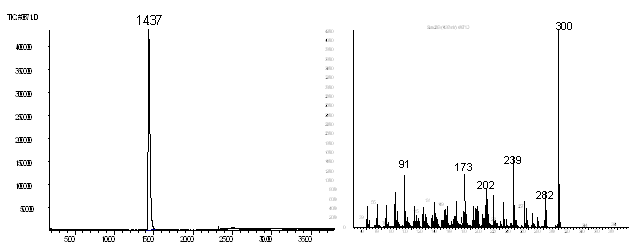
|
В ИК спектре (рис. 5) содержится полоса поглощения карбонильной группы при 1715 см-1.
В спектре ЯМР 1Н (рис. 6) содержится синглетный сигнал протонов метиленовой группы (2Н, С2-Н) в области 2.5 м.д.
 В спектре ЯМР 13С (рис. 7) содержатся сигнал углерода карбонильной группы (С21) при 217.10, четвертичных углеродов при двойной связи: С8, связанного с О-атомом при 142.60 и С3 при 103.82, четвертичного углерода (С10), связанного с О-атомом при 82.4,четвертичного углерода (С1) при 51.26, а также два сигнала третичных углеродов (С15 и С17) при 39.74, 46.38.
В спектре ЯМР 13С (рис. 7) содержатся сигнал углерода карбонильной группы (С21) при 217.10, четвертичных углеродов при двойной связи: С8, связанного с О-атомом при 142.60 и С3 при 103.82, четвертичного углерода (С10), связанного с О-атомом при 82.4,четвертичного углерода (С1) при 51.26, а также два сигнала третичных углеродов (С15 и С17) при 39.74, 46.38.
4. Реакция восстановительного гидроаминирования по Лейкарту
Соединение 5 мы ввели в реакцию гидроаминирования по Лейкарту. Как указано в литобзоре, эта реакция была проведена с трикетоном 14 при микроволновом облучении с формиатом аммония в этиленгликоле [22].
Сначала эту реакцию мы провели также с формиатом аммония в диметиловом эфире диэтиленгликоля (диглим), со смесью карбоната аммония и 85 % муравьиной кислоты в диглиме при микроволновом облучении. При этом было выделено исходное соединение в очищенном виде. В диглиме происходит перекристаллизация соединения 5. Его сложно перекристаллизовать из других растворителей, так как в этом случае образуется продукт, не дающий узкого интервала температуры плавления, что объясняется примесью продуктов дециклизации. И именно неудавшаяся реакция Лейкарта в диглиме помогла найти идеальный растворитель для перекристаллизации. В условиях классической реакции Лейкарта (HCONH2, HCOOH, при нагревании) нами были выделены три новых гетероциклических соединения.
Реакция проводилась при 160-175 °С в формамиде с 85-%-ной муравьиной кислотой. Мы учитывали, что в растворе при нагревании соединение 5 может существовать в виде смеси промежуточных продуктов циклизации (схема 5), содержащих карбонильные группы, а потому можно было ожидать образования разнообразных соединений.
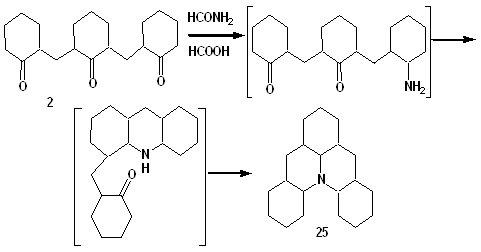
После проведения реакции мы получили трехкомпонентную смесь, из которой с 60 % выходом выкристаллизовывалось соединение 23. Оставшийся фильтрат по данным ГЖХ-МС состоял из смеси соединений 24 и 25 в соотношении 1:2 и примеси соединения 23. После отгона формамида и разбавления остатка водой выпадал осадок соединения 24 (М 303), а после экстракции водного раствора выделили соединение 25 с выходом около 2 %.
Соединение 25 (М 287) является основным продуктом при проведении реакции Лейкарта с расплавом трикетона 2 (выход более 70 % по данным ГЖХ-МС) и представляет собой смесь более 7 стереоизомеров с преимущественным содержанием двух из них (40 %) в соотношении (в %) 30:70.
Структуры полученных соединений 23, 24, 25 установлены на основании ГЖХ-МС, ИК и ЯМР 1Н, 13С-спектроскопии.
21-формил-20-окса-21-азагексацикло[10.8.2.01,6.08,19.08,22.014,19]докозан (23).
|
 Рис. 8. Хроматограмма и масс-спектр соединения 23.
Рис. 8. Хроматограмма и масс-спектр соединения 23. В ИК спектре содержится полоса поглощения амидной группы при 1653 см-1.
Рис. 9. ИК спектр соединения 23 в KBr.

Спектр ЯМР 1Н (d, м.д.) (рис. 10) содержит синглетный сигнал водорода формильной группы при 8.38, дублетный сигнал водорода (1Н, С22-Н) при 3.59 (J=3,42 Гц), мультиплетный сигнал при 2.55 (1Н, С12-Н).
В спектре ЯМР 13С (d, м.д.) (рис. 11) содержатся сигнал углерода формильной группы (С23) при 159.11, четвертичного углерода (С1), связанного с N- и O-атомами при 82.60, четвертичного углерода (С19), связанного с О-атомом при 77.62, третичного углерода (С22), связанного с N-атомом при 60.40, сигналы трех третичных С-атомов (С6, С12, С14) при 41.64, 41.04, 28.48, четвертичного углерода (С8) при 33.73.
Образование соединения 23 из соединений 21 или 22 в результате реакции формилирования представлено на схеме (6):
Схема 6

Для подтверждения пути образования соединения 23 по направлению a или b мы ввели в реакцию Лейкарта кетон 22. По данным ГЖХ-МС реакционная смесь на 30 % состояла из соединения 23 и более чем на 60 % - из соединения 26, которое является основным при проведении реакции Чичибабина также с кетоном 22 и соединением 5.
Известно, что формиламины гидролизуются в щелочной или кислой среде с образованием аминов. Но наши неоднократные попытки гидролизовать соединение 23 и в кислой и в щелочной среде при кипячении (в спирте с 2н и 4н гидроксидом натрия, с добавкой серной, соляной, конц. уксусной кислот) до 6 часов к успеху не привели. Оно оказалось устойчивым и в неизменном виде выделялось из реакции.
3-азагексацикло[9.7.3.02,1.04,9.0 12,17]генэйкозан-12-ол (24).
В масс-спектре содержится пик молекулярного иона [М]+=303, а также пик иона [С13Н23N]+ с массой 193 единицы, соответствующий пергидроакридиновому фрагменту.
Рис. 12. Хроматограмма и масс-спектр соединения 24.
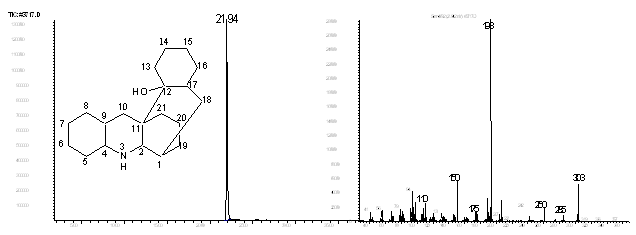
ИК спектр содержит широкую полосу поглощения при 3118 см-1. При снятии спектра с разбавлением картина не меняется, на основании чего мы считаем, что эта полоса соответствует NH-группе и связанной внутримолекулярной водородной связью ОН-группе.
Рис. 13. ИК спектр соединения 24 в CHCI3.

При помощи компьютерных расчетов нами была проведена 3D оптимизация (с использованием алгоритма CHARMM [29]). Группа –OH пространственно сближена с NH-группой и эмпирически рассчитанное расстояние между ними составляет 1,71 А. Это и приводит к прочной внутримолекулярной водородной связи.
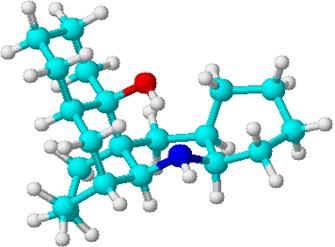
В спектре ЯМР 1Н (d, м.д.) (рис. 14) содержится сигнал водорода при N-атоме при 6.83, исчезающий при снятии спектра с добавкой CD3OD.
В спектре ЯМР 13С (d, м.д.) (рис. 15) содержатся сигнал четвертичного углерода (С12), связанного с О-атомом при 76.56, двух третичных углеродов (С2, С4), связанных с N-атомом при 67.41 и 64.21, четвертичного углерода (С11) при 38.93, трех третичных С-атомов (С1, С9, С17) при 41.4, 40.1, 34.73.
Образование производного пергидроакридина 24 возможно из промежуточного продукта дециклизации – соединения 19 (схема 7):
Схема 7
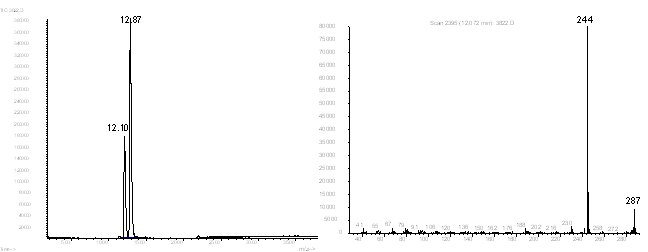

октадекагидро-2Н,6Н-хино[3,2,1-de]акридин (25).
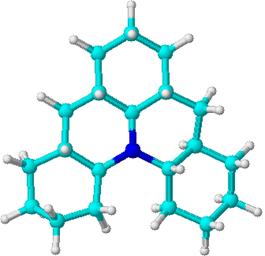
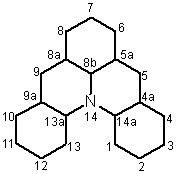
Рис. 16. Хроматограмма и масс-спектр соединения 25.
В ИК спектре отсутствуют полосы поглощения функциональных групп С=О, NH, OH.
Рис. 17. ИК спектр соединения 25 в КВr.

Индивидуального соединения 25 хватило на ГЖХ-МС, ИК-спектр и для определения Т.пл. Поэтому спектр ЯМР 13С был снят для смеси, состоящей из соединений 24 и 25 (1:1). И с учетом вычета уже известных характерных сигналов соединения 24, оставались сигналы, которые соответствовали предложенной структуре 25: сигналы третичных углеродов, связанных с азотом при 71.02 (С2) и при 70.90 (С6 и С11). Аналогично выглядит теоретически моделированный спектр для структуры 25 (рис. 18).
Образование соединения 25 из трикетона 2 представлено на схеме (8).
Схема 8


0 комментариев