Навигация
1.3 Селен
Селен Se – елемент VI групи Періодичної системи елементів Д. И. Менделєєва широко розповсюджений у земній корі, але в малих концентраціях. Зміст його не перевищує 6• 10-5% ,(по масі) і приблизно дорівнює змісту в земній корі сурми, кадмію, срібла. Однак власних руд промислового типу мінерали селен не утворять, тому його відносять до числа рідких неуважних елементів. Селен – супутник сульфідних руд важких кольорових металів. Основними джерелами його одержання служать анодні шлаки мідних і, нікелевих електролітних виробництв.
Атомна маса 78,96. Існує кілька різновидів селен різних кольорів аморфного й кристалічного (рис. 6) будови.

Рисунок 6 - Структура селена [1]
По хімічних властивостях селен близький до сірки, але менш активний. При кімнатній температурі він не взаємодіє з киснем повітря, а при нагріванні на повітрі згоряє з утворенням двоокису селен.. Соляна й розведена сірчана кислоти на селен не діють. Азотна кислота окисляє його до двоокису селен, а лугу розчиняють із утворенням солей.
Селен при температурі 200° С реагує з воднем з утворенням селенистого водню, з киснем утворить ряд сполук (Se, Se02, Se03), а з галогенами — кілька сполук типу SeCl4. Селен утворює сполуки із сіркою, азотом, фосфором і багатьма металами.
Залежно від способу одержання, а також режиму проведення процесу (температури, тиску, швидкості охолодження розплаву) селен може існувати в чотирьох алотропічних формах: склоподібний, аморфної, моноклінної й гексагональної [4].
Склоподібний селен одержують швидким охолодженням розплаву від температури вище крапки плавлення. Селен такої модифікації утвориться при виливанні розплаву на охолоджувану водою металеву пластину або в холодну воду. У цьому випадку одержують селен у вигляді пластинок або дрібних дробинок. Тонкі плівки склоподібного селену одержують конденсацією його пар у вакуумі.
Склоподібний селен знайшов широке застосування у фотографічному процесі ксерографії.
Аморфний селен буває різного фарбування, що обумовлюється різним ступенем дисперсності колоїдних часток, що випадають із розведеного розчину (селенідів) солей селен при додаванні відновлювачів. Так, при відновленні розчинів селенідів при температурах нижче 70° С утвориться аморфна модифікація селен червоних кольорів.
Моноклінний селен одержують обробкою тонко здрібненого селен сірковуглецем. Із що утвориться насиченого розчину темно-жовтогарячих кольорів повільним випаром одержують кристали селен . моноклінної структури.
Гексагональний селен – найбільш важлива модифікація цього матеріалу – застосовується для виготовлення напівпровідникових приладів. Це сама стійка форма, що одержала назву сірого селен, що має структуру у вигляді зиґзаґоподібних гвинтових ланцюгів.
1.4 Карбід кремнію
Карбід кремнію Si — сполука кремнію й вуглецю елементів IV групи. В природі цей матеріал зустрічається вкрай рідко в обмежених кількостях. Карбід кремнію існує у двох модифікаціях: кубічної й гексагональної. Гексагональна модифікація, що одержала назву α – SiС, утвориться при високих температурах і володіє поруч коштовних електрофізичних властивостей.
По типі хімічного зв’язку карбід кремнію ставиться до ковалентних кристалів. Залежно від сировини й технології одержання кристали карбіду кремнію мають найрізноманітніше фарбування: білу, жовту, сіру, зелену й чорну. Домішки можуть бути як чужорідними, тобто включеннями в кристалічну решітку карбіду кремнію чужорідних елементів, так і власними. Кристали карбіду кремнію мають незначні розміри.
Електропровідність кристалів карбіду кремнію визначається кількістю й типом домішки. Домішки елементів V групи (азоту, фосфору, миш’яку, сурми, вісмуту) дають карбіду кремнію зелене фарбування й електропровідність n-типу, а елементів II (кальцію, магнію) і III (бору, алюмінію, галію, індію) груп — чорне фарбування й електропровідність р-типа.
Карбід кремнію має високу хімічну стійкість: при нагріванні на повітрі він починає помітно окислятися при температурах вище 800° С; він стійкий до більшості кислот, за винятком суміші азотної й плавикової кислот, але бурхливо розчиняється в розплавлених лугах [3].
Карбід кремнію, використовуваний у напівпровідниковому виробництві для виготовлення світодіодів, являє собою поліровані із двох сторін монокристали гексагональної модифікації політипів 6Н и 15R. Монокристали карбіду кремнію легуються азотом і мають електронний тип провідності.
Карбід кремнію завдяки його високій твердості (по твердості він небагато уступає алмазу) використають для механічної, обробки різних матеріалів. Із суміші порошку карбіду кремнію, елементарного кремнію й вуглецю випалом в атмосфері азоту одержують сіліт, що застосовують для виготовлення високотемпературних нагрівачів.
На основі карбіду кремнію одержують різні матеріали. Наприклад, при випалі карбіду кремнію із глинистим зв’язуванням одержують нелінійний матеріал – тирит, а при випалі його з ультрапорцеляновим зв’язуванням – нелінійний матеріал – летін.
Окисні напівпровідники
Окісними напівпровідниками прийнято називати бінарні сполуки полярного типу, у яких ясно розрізняються металевий і металоїдний. До цього класу напівпровідникових матеріалів ставляться такі речовини, як Сu2О, ZnO, CdO, NiO, Fe203. На (рис. 7) і (рис. 8) показані структури закису міді й окиси цинку.
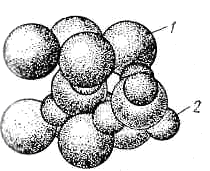
Рисунок 7 - Структура закису міді [1]: 1 – кисень; 2 – мідь
Перевага окісних напівпровідників полягає в тому, що технологія їхнього виготовлення порівняно проста. Ці матеріали використають у полікристалічній формі у вигляді зразків, які легко приготувати методами керамічної технології.
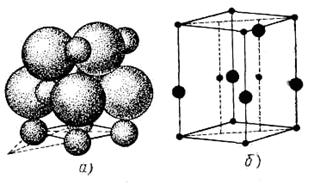
Рисунок 8 - Структура окису цинку[1]: а) розташування атомів; б) кристалічна решітка
Напівпровідниковими властивостями, володіють не всі окисли металів, а тільки, ті, у яких іон металу ставиться до елемента перехідного ряду періодичної таблиці, наприклад Zn, Си, Ni, Co, Fe, Mn, Сг, V, Ti.
Найбільше застосування серед окісних напівпровідників одержала закис міді СиО – матеріал жовтий або червоний кольори [4].
Окісні напівпровідники широко застосовують для виготовлення термо- і фоторезисторів.
Похожие работы
... Висновки. Одним з перспективних напрямків сучасної фізики є дослідження поверхні твердого тіла та взаємодії поверхневих електромагнітних хвиль інфрачервоного діапазону з поверхнею та тонкими шарами напівпровідників . При взаємодії світлової хвилі з поверхнею твердого тіла виникає поверхнева електромагнітна хвиля. Квазічастинки, які відповідають цим коливанням, що мають змішаний електромагнітно- ...
... ій зоні. Для тіл, у яких ширина забороненої зони не перевищує 1 еВ, уже при кімнатній температурі в зоні провідності виявляється достатнє число електронів, а у валентній зоні – вакансій, щоб обумовити відносно високу електропровідність. Такі тіла звичайно називають напівпровідниками. Звідси стає ясним, що розподіл твердих тіл другої групи, на діелектрики й напівпровідників є чисто умовним. У ...
... заряджені дефекти впливають також на матричні елементи для переходів між нелокалізованими станами поблизу країв рухливості, створюючи флуктуації потенціалу. РОЗДІЛ 2 ФОТОІНДУКОВАНІ ЗМІНИ ОПТИЧНИХ ПАРАМЕТРІВ ТОНКИХ ШАРІВ НЕКРИСТАЛІЧНИХ ХАЛЬКОГЕНІДІВ 2.1. Структурні одиниці та фізико-хіміні особливості некристалічних халькогенідів Структура склоподібних і аморфних халькогенідів може бути ...
... параметрів при термоциклюванні, а саме ця особливість є принциповою для практичного використання. Перспективними для вирішення проблеми деградації об’ємних матеріалів з ФПМН є склокерамічні матеріали на основі компонента з фазовим переходом метал-напівпровідник. Такі матеріали можна отримати за керамічною технологією. Важливою вимогою до них, окрім стабільної поведінки при термоциклюванні, є ...






0 комментариев