Навигация
Различие в атомных размерах (ΔR) компонентов должно быть незначительным и не превышать 8 – 15%
2. Различие в атомных размерах (ΔR) компонентов должно быть незначительным и не превышать 8 – 15%.
3. Компоненты должны принадлежать к одной и той же группе элементов периодической системы элементов или к смежным родственным группам и иметь близкое строение электронных оболочек атомов.

Рисунок 5. Кристаллические решетки твердых растворов замещения при неограниченной растворимости компонентов
Примеры сплавов, в которых образуется непрерывный ряд твердых растворов:
Cu (29) и Ni (28) (ΔR=2.7%),
Fe (26) и Ni (28),
Fe (26) и Cr (24),
Ag и Au (ΔR=0.2%),
Mo и W (ΔR=9.9%),
V и Ti (ΔR=2.0%),
Fe и Co – не растворяются.
Твёрдые растворы внедрения образуются только в тех случаях, когда диаметр атома растворенного элемента невелик (R вн. ат./Rраствор > 0,59).
Твёрдые растворы этого типа получаются лишь при растворении в металле (Fe, Mo, Cr и т.д.) углерода (атомный радиус 0,77А°), азота (0,71А°), водорода (0,46А°), т.е. элементов с малым атомным радиусом.
Твёрдые растворы внедрения могут быть только ограниченными по концентрации, поскольку число пор в решетке ограничено, а атомы основного компонента сохраняются в узлах решетки.
Упорядоченные твёрдые растворы
В сплавах Cu и Au, Fe и Al, Fe и Si, Ni и Mn, образующих при высоких температурах растворы замещения с неупорядочнным размещением атомов компонентов, при медленном охлаждении или нагреве, выдержке при высоких температурах протекает процесс перераспределения атомов. В результате, которого атомы компонентов занимают определённые положения (рис. 6) в кристаллической решётке. Т.о. образуется упорядоченный твёрдый раствор или сверхструктура.

Рисунок 6. Кристаллические решетки упорядоченных твердых растворов: а – CuZn, б – CuAu, в – Сu3Au
Образование сверхструктуры сопровождается изменением свойств (например в сплаве пермаллой (железо и 78,5% никеля) ухудшается магнитная проницаемость, повышается твердость, снижается пластичность и изменяется электросопротивление).
Упорядоченные растворы образуются, когда отношение компонентов в сплаве (ат.%) постоянно: 1:1 (CuAu); 1:2; 1:3 (Сu3Au); и т.д. (можно приписать формулу химического соединения CuAu, Cu3Au).
Упорядоченные твердые растворы можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями.
В упорядоченных твердых растворах сохраняется решетка растворителя, но имеется правильное расположение атомов и резное изменение свойств характерное для химических соединений.
4. Химические соединения
Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Характерные особенности химических соединений:
1. Кристаллическая решетка отличается от решеток компонентов, образующих соединение. Атомы располагаются упорядоченно. Химические соединения имеют сплошную кристаллическую решетку (рис. 7).
2. В соединении всегда сохраняется простое кратное соотношение компонентов, что позволяет их выразить формулой: АnBm, А и В-компоненты; n и m – простые числа.
3. Свойства соединения редко отличаются от свойств образующих его компонентов. Cu – НВ35; Al – НВ20; CuAl2 – НВ400.
4. Температура плавления (диссоциации) постоянная.
5. Образование химического соединения сопровождается значительным тепловым эффектом.
Химические соединения образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток.
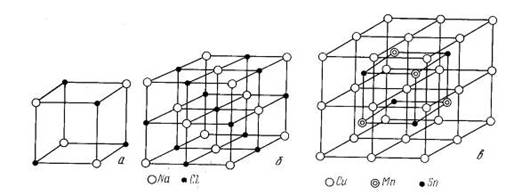
Рисунок 7. Кристаллические решетки: а, б – соединение NaCl, в-соединение Cu2MnSn (ячейка состоит из 8 атомов меди, 4 атомов марганца и 4 атомов олова)
Примером типичных химических соединений с нормальной валентностью могут служить соединения Mg с элементами IV–VІ групп Периодической системы: Mg2Sn, Mg2Pb, Mg2P2, Mg2Sb2, Mg3Bі2, MgS и др. Соединения одних металлов с другими носят название интерметаллидов. Химическая связь в интерметаллидах чаще металлическая.
Большое число химических соединений, образующихся в металлических сплавах, отличается по некоторым особенностям от типичных химических соединений, так как не подчиняется законам валентности и не имеет постоянного состава. Рассмотрим наиболее важные химические соединения, образующиеся в сплавах.
Фазы внедрения
Переходные металлы (Fe, Mn, Cr, Mo, Ti, V, W и др.) образуют с неметаллами С, N, Н соединения: карбиды (с С), нитриды (с N), бориды (с В), гидриды (с Н). Часто их называют фазами внедрения.
Фазы внедрения имеют формулу:
М4Х (Fe4N, Mn4N и др.),
М2Х (W2C, Mo2C, Fe2N, Cr2N и др.),
МХ (WC, TiC, VC, NbC, TiN, VN и др.).
Кристаллическая структура фаз внедрения определяется соотношением атомных радиусов неметалла (Rх) и металла (Rм).
Если Rх/Rм < 0,59, то атомы металла в этих фазах расположены по типу одной из простых кристаллических решеток: кубической (К8, К12) и гексагональной (Г12), в которую внедряются атомы неметалла, занимая в ней определенные поры.
Фазы внедрения являются фазами переменного состава, а соответствующие им формулы (химические) обычно характеризуют максимальное содержание в них металлов.
Фазы внедрения обладают высокой: электропроводностью, температурой плавления и высокой твёрдостью.
Фазы внедрения имеют кристаллическую решетку, отличную от решетки металла растворителя.
На базе фаз внедрения легко образуются твердые растворы вычитания (VC, TiC, ZrC, NbC), часть атомов в узлах решетки отсутствует.
Электронные соединения.
Эти соединения образуют между одновалентными (Cu, Ag, Au, Li, Na) металлами или металлами переходных групп (Mn, Fe, Co и др.), с одной стороны, и с простыми металлами с валентностью от 2 до 5 (Be, Mg, Zn, Cd, Al и др.) с другой стороны.
Соединения этого типа (определил английский металлофизик Юм – Розери), характеризуются определенным отношением валентных электронов к числу атомов: 3/2; 21/13; 7/4; каждому соотношению соответствует определенная кристаллическая решетка.
При отношении 3/2 образуется ОЦК решетка (обозначается β – фаза) (CuBe, CuZn, Cu3Al, Cu5Sn, CoAl, FeAl).
При 21/13 имеют сложную кубическую решетку (52 атома на ячейку) – γ – фаза (Cu5Zn8, Cu31Sn8, Cu9Al4, Cu31Si8).
При 7/4 имеется плотноупакованная гексагональная решетка, обозначается ε – фазой (CuZn3, CuCd3, Cu3Si, Cu3Sn, Au3Sn, Cu5Al3).
Электронные соединения встречаются во многих технических сплавах – Cu и Zn, Cu и Sn (олово), Fe и Al, Cu и Si и т.п. Обычно в системе наблюдается все три фазы (β, γ, ε).
У электронных соединений определенное соотношение атомов, кристаллическая решетка отличается от решеток компонентов – это признаки хим. соединений. Однако в соединениях нет упорядоченного расположения атомов. С понижением температуры (после нагрева) происходит частичное упорядочение, но не полное. Электронные соединения образуют с компонентами, из которых состоят твердые растворы в широком интервале концентраций.
Таким образом, этот вид соединений следует считать промежуточными между химическими соединениями и твердыми растворами.
Таблица №1 – Электронные соединения
| Фаза | Отношение, решётка | Электронные соединения для различных систем: Cu – Zn Cu – Sn Cu – Al Cu – Si | |||
| β | 3/2 кубическая ОЦ | CuZn | Cu5Sn | Cu3Al | Cu5Si |
| γ | 21/23 сложная кубическая | Cu5Zn8 | Cu31Sn8 | Cu9Al4 | Cu31Si8 |
| ε | 7/4 гексагональная | CuZn3 | Cu3Sn | Cu5Al3 | Cu3Si |
Фазы Лавеса
Имеют формулу АВ2, образуются при соотношении атомных диаметров компонентов ДА/ДВ = 1,2 (чаще 1,1–1,6). Фазы Лавеса имеют ГПУ гексагональную решетку (MgZn2 и MgNi2, BaMg2, MoBe2, TiMn2) или ГЦК (MgCu2, AgBe2, Ca Al2, TiBe2, TiCr2). Данные фазы встречаются как упрочняющие интерметаллидные фазы в жаропрочных сплавах.
5. Гетерогенные структуры
Сплавы с гетерогенной (разнородной) структурой образуются в случаях, когда компоненты не обладают полной взаимной растворимостью. При повышении предельной растворимости получается структура, состоящая из насыщенных растворов или твердого раствора и химического соединения.
Примеры систем (Pb–Sb, Cu–Bi, Zn–Sn, Pb–Sn, Pb–Bi, Ni–Cr, Fe–C, Al–Cu и др.). Каждая фаза имеет свою кристаллическую решетку.
Литература
1. Лахтин Ю.М., Леонтьева В.П. Материаловедение. М., 1972, 1980
2. Гуляев А.П. Металловедение. М., 1986
3. Сидорин И.И. Основы материаловедения. М., 1976
4. Антикайн П.А. Металловедение. М., 1972
Похожие работы
... и природы вещества, участвующего в электрохимической реакции. Электрохимические параметры при этом служат аналитическими сигналами, при условии, что они измерены достаточно точно. Электрохимические методы анализа в практику химического анализа вошли сравнительно давно и занимают в ней важную роль. Впервые потенциометрическое титрование было проведено в 1893 г. в институте Оствальда в Лейпциге, а ...
металл менее прочен. 9. Зерно в сплавах. Влияние величины зерна на свойства. Зерно – это кристалл неправильной формы. Кристаллы могут иметь форму дендрита. Дендрит – кристалл древовидной формы. Мелкое зерно прочное, крупное зерно хрупкое. 10. Сплавы. Основные понятия и термины: сплав, компонент, фаза, структура, равновесное и неравновесное состояния. Сплавы – это вещества, состоящие из ...
... механических нагрузок. Наиболее изнашиваемой частью двигателя гоночного автомобиля является поршень цилиндра. По утверждению специалистов немецкой фирмы Mahle, являющейся лидером в производстве поршней гоночных автомобилей, «стоимость поршня болида Formula –1 практически можно приравнять к цене золота». Основными материалами, используемыми в двигателях Формулы-1, являются алюминиевые магниевые, ...
... и приписывают ему решающее значение. Самой характерной и отличительной особенностью процесса ЭХП является подавление структурного травления металлической поверхности, несмотря на её физико-химическую и электрохимическую гетерогенность. Даже при условии равномерного растворения поверхности металла можно объяснить эффект сглаживания шероховатостей, исходя из простых геометрически соображений. В ...








0 комментариев