Навигация
2. Задача
Рассчитать и сделать анализ материального и энергетического балансов производства нитробензола по технологии представленной на рисунке. Оценить масштаб антропогенной нагрузки на окружающую среду (рис. 4).
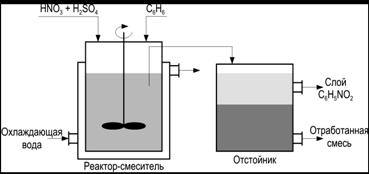
Рис. 4 - Схема процесса получения нитробензола
Реакция получения нитробензола (С6H5NO2) протекает в присутствии серной кислоты (H2SO4) и избытке бензола (С6Н6) из расчета 1 кмоль бензола на 0,95 кмоль азотной кислоты (HNO3):
![]() .
.
Азотная и серная кислоты поступают в виде растворов с массовыми концентрациями 2 и 3. Концентрация серной кислоты в течение процесса получения нитробензола уменьшается до величины 6. Вода, образующаяся в ходе реакции и поступающая с раствором азотной кислоты, уменьшает концентрацию серной кислоты в растворе.
Введение исходных продуктов в систему и выведение из нее продуктов реакции осуществляется при температуре окружающей среды t1. Реакция получения нитробензола протекает при температуре t2 > t1 с эффективностью, которая определяется выходом реакции.
В процессе смешения реагентов происходит выделение тепловой энергии при взаимодействии бензола с азотной кислотой и в результате разбавления серной кислоты реакционной водой и водой, поступающей с исходными реагентами. Количество выделяемой тепловой энергии определяется соответственно удельным тепловым эффектом нитрования бензола и (q1) и удельной теплотой разбавления серной кислоты (q2). Потери тепловой энергии нормируются коэффициентом тепловых потерь, который определяет долю тепла, теряемую от общего входного потока тепловой энергии.
При расчете принимаются следующие исходные данные:
| – масса С6Н6 | М1 = 2,5 кг; |
| – удельная теплоемкость С6Н6 | С1 = 1,72 кДж/(кг · °С); |
| – удельная теплоемкость НNO3 | С2 = 2,51 кДж/(кг · °С); |
| – удельная теплоемкость H2SO4 | С3 = 1,42 кДж/(кг · °С); |
| – концентрация раствора HNO3 | 0,73 (масс. доли); |
| – концентрация раствора Н2SO4 | 0,95 (масс. доли); |
| – концентрация отработанной Н2SO4 | 0,75 (масс. доли); |
| – выход реакции | 0,75; |
| – температура окружающей среды | t1 = 20 °С; |
| – температура реагирующей смеси | t2 = 45 °С; |
| – удельный тепловой эффект реакции | q1 = 153 кДж/моль; |
| – коэффициент тепловых потерь | 0,15. |
Решение
Материальный баланс. На основании закона сохранения вещества (массы) формируется материальный баланс производства нитробензола, который устанавливает связь между входными и выходными потоками вещества:
![]() ,(1.4)
,(1.4)
Где Мвх - масса входного потока вещества;
Мвых - масса выходного потока вещества.
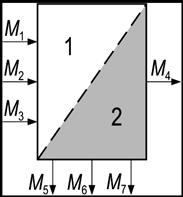
Рис. 5 - Схема материальных потоков процесса получения нитробензола: 1 - зона входных потоков вещества; 2 - зона выходных потоков вещества
Для расчетного анализа материальных потоков необходимо изучить упрощенную схему производства нитробензола. На ее основе составить подробную схему материальных потоков и подобрать не достающие исходные данные. Технологическую схему, можно представить как одну технологическую единицу, в которой структурные составляющие не различаются, и условно распределить в ней потоки вещества, так, как это сделано на рисунке.
Входной поток вещества представляют как сумму составляющих его компонентов по формуле
Мвы=М1+М2+М3= 2,5+2,6+4,2=9,3 кг, (1.5)
где М1-масса бензола С6Н6 (известна по условию), кг;
М2-масса раствора азотной кислоты HNO3, кг;
М3-масса раствора серной кислоты H2SO4, кг.
По известному из условия оптимальному мольному соотношению исходных веществ определяем количество вещества HNO3 требуемого для реакции:
n2 =30.1 моль,
где n1-количество вещества С6Н6,
![]()
-мольная масса бензола, кг/кмоль, 78 кг/кмоль.
С другой стороны количество молей HNO3 определяется аналогично бензолу:
![]() (1.6)
(1.6)
Где М2 HNO3-масса HNO3, кг;
мольная масса HNO3, кг/кмоль, 63 кг/кмоль.
Отсюда
![]() (1.7)
(1.7)
Так как НNO3 поступает в реактор-смеситель в виде раствора, то окончательно масса раствора HNO3 (М2) равна:
![]() (1.8)
(1.8)
Где массовая доля HNO3 в водном растворе по условию.
Необходимое количество раствора Н2SO4, поступающего в реактор–смеситель, будет рассчитываться с учетом количества воды, образовавшейся в реакторе-смесителе.
Количество воды (M2 Н2О), поступившей в реактор вместе с раствором азотной кислоты,
![]() (1.9)
(1.9)
Количество реакционной воды (Mр Н2О) находится из уравнения реакции по исходному веществу, находящемуся в недостатке (НNO3):
![]() (1.10)
(1.10)
гдеn2-количество вещества НNO3 по формуле (1.6),
![]()
мольная масса H2O, кг/кмоль, 18 кг/кмоль;
выход реакции по условию.
Подставляя полученные значения в выражение (1.10), определим количество воды по реакции нитрования бензола:
![]()
Общая масса воды (МН2О) на разбавление H2SO4 в реакторе-смесителе определяется как сумма M2 Н2О и Mр Н2О:
![]() (1.11)
(1.11)
Серная кислота в реактор-смеситель поступает в виде раствора с начальной массовой концентрацией 3. В ходе реакции концентрация раствора уменьшается до конечной величины 6 за счет разбавления реакционной водой и водой, поступившей с азотной кислотой. На основании этого, можно записать, руководствуясь определением массовой доли вещества в растворе, выражение массовых концентраций Н2SO4 на входе и выходе реактора-смесителя:
![]() и
и 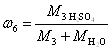 .
.
Разделим первое выражение на второе и решим полученное уравнение относительно массы раствора серной кислоты M3:
 (1.12)
(1.12)
Выходной поток вещества. После послойного разделения в отстойнике на выходе из технологической установки получения нитробензола имеем следующий поток вещества:
![]() (1.13)
(1.13)
![]()
Масса нитробензола (М4), полученная по реакции нитрования бензола, определяется из уравнения химической реакции по веществу находящемуся в недостатке (HNO3):
![]() (1.14)
(1.14)
Где мольная масса С6H5NO2, кг/кмоль, 123 кг/кмоль.
Количество избыточного бензола (М5), необходимого для обеспечения заданного технологического режима, определяется выражением:
![]() (1.15)
(1.15)
Количество отработанной серной кислоты (М6) складывается из массы раствора серной кислоты поступающей в реактор-смеситель и массы воды, содержащейся в растворе азотной кислоты и образованной при смешении реагентов:
![]() (1.16)
(1.16)
Побочные продукты (М7) производства нитробензола, например, можно определить по выходу конечных продуктов реакции:
![]() (1.17)
(1.17)
Подставляя численные значения компонентов, получим массовый выход побочных продуктов:
![]()
Сравнивая полученные значения величин входных и выходных материальных потоков по уравнению (1.4), делаем проверку материального баланса и получаем очевидное тождество: 9,3 кг = 9,3 кг.
Структуру материального баланса удобно представлять в графическом виде. Для этого строится гистограмма входных и выходных материальных потоков рис., которая наглядно показывает соотношения компонентов (статей) в структуре материального баланса.
Энергетический баланс. Энергетический баланс производства нитробензола представляет собой тепловой баланс и складывается из тепловых потоков возникающих в ходе технологического процесса. По аналогии с материальным балансом запишем общее уравнение энергетического баланса, представляющее собой равенство приходного и расходного тепловых потоков:
![]() (1.18)
(1.18)
гдеQвх - приходный поток теплового баланса;
Qвых - расходный поток теплового баланса.
При рассмотрении энергетического баланса теплосодержание исходных продуктов и продуктов реакции не учитывается, так как ввод исходных продуктов и вывод продуктов реакции осуществляется при температуре окружающей среды t1.
Приход тепловой энергии. Приход тепловой энергии определяется термохимическим процессом нитрования бензола, процессом разбавления серной кислоты и подогревом реакционной смеси до температуры t2:
![]() (1.19)
(1.19)
![]()
Тепловой эффект реакции нитрования бензола (Q1) определяется по следующему уравнению: ![]() (1.20)
(1.20)
гдеq1 - удельная теплота реакции нитрования, кДж/моль;
n4 - количество молей нитробензола, моль,
![]()
Для определения выделившейся тепловой энергии при разбавлении серной кислоты, запишем возможные пути разбавления серной кислоты водой:
![]() - путь 1,
- путь 1,
![]() - путь 2,
- путь 2,
![]() - путь 3.
- путь 3.
В реактор попадает готовый раствор серной кислоты, в котором вода находится в связанном состоянии. Энергия, высвободившаяся при получении раствора, не должна учитываться при разбавлении в ходе процесса нитрования. Предполагается, что разбавление исходного раствора серной кислоты протекало по первому уравнению (путь 1), т. е. разбавление шло при одинаковом мольном соотношении исходных веществ. Учитывая это, количество серной кислоты связанной с водой равно количеству воды связанной с серной кислотой, отсюда:
![]()
Где количество серной кислоты связанной с водой, моль.
Количество молей серной кислоты (n3), поступающей на разбавление, в соответствии с материальным балансом производства и учетом начального разбавления определяется по выражению:
![]()
Где мольная масса H2SO4, кг/кмоль, 98 кг/кмоль.
Количество молей воды (nН2О) для разбавления соответствует массе воды, полученной в ходе реакции, и поступающей с раствором азотной кислоты:
![]()
Из полученного мольного соотношения воды и серной кислоты, видно, что количество воды в три раз больше, чем серной кислоты, поэтому разбавление может рассматриваться по реакциям 2 или 3 (путь 2 и 3). Рассчитаем количество гидратов, образовавшихся при разбавлении, с двумя и четырьмя присоединенными молями воды:
 или
или ![]()
Где x - количество молей H2SO4 по реакции 2, моль;
Y - количество молей H2SO4 по реакции 3, моль.
Решая систему уравнений, получим следующее:
![]()
Теплота (Q2), полученная в результате разбавления серной кислоты, определяется как сумма теплоты при разбавлении по 2 и 3 пути:
![]() (1.21)
(1.21)
Где 41,92 и 54,06-удельная теплота разбавления, соответственно по реакции 2 и 3, кДж/моль.
Затраты энергии на подогрев реакционной смеси могут компенсироваться тепловыделением в ходе непрерывного производства. В этом случае эти затраты энергии включаются только в расходную часть энергетического баланса. В данном примере принимается, что производство работает периодически и при запуске эти затраты энергии не могут быть компенсированы тепловыделением. Поэтому они включаются также и в приходную часть энергетического баланса.
Подогрев реакционной смеси от t1 до t2, определяется количеством тепловой энергии, затраченной в единицу времени, на нагревание ее компонентов:
![]() (1.22)
(1.22)
![]()
Где Мi- масса исходных продуктов (М1, М2, М3), кг;
Сi- удельная теплоемкость исходных веществ (C1, C2, С2), кДж/(кг · ºС),
t1 и t2 - соответственно, начальная температура реакционной смеси и температура реакции, °С.
Расход тепловой энергии. Выходной поток тепловой энергии показывает распределение входного потока тепловой энергии в зависимости от производственных потребностей. В данном примере, входной поток тепловой энергии расходуется на технологические нужды (осуществление химического процесса) и компенсацию тепловых потерь в окружающую среду. Следуя этому, запишем уравнение выходного теплового потока для производства нитробензола:
![]() (1.23)
(1.23)
Полезная тепловая энергия, используемая для осуществления процесса получения нитробензола, определяется количеством тепловой энергии затраченной на подогрев реакционной смеси:
![]() (1.24)
(1.24)
Тепловые потери (Q4), по условию нормируемые от прихода тепловой энергии, рассчитываются по формуле
![]() (1.25)
(1.25)
Тепловая энергия (Q5), поступающая в систему охлаждения, определяется из основного уравнения теплового баланса (1.18):
![]() (1.26)
(1.26)
![]()
Понятно, что сравнивать энергетические потоки нет необходимости, так как уравнение (1.26) раскрывает взаимосвязь между компонентами прихода и расхода энергии в системе. В таком случае требуется лишь тщательный подсчет известных компонентов энергетического баланса во избежание расчетной ошибки.
Список использованной литературы
1. Инженерная экология: Общий курс. В 2 т.: Учебное пособие для вузов / И.И. Мазур, О.И. Молдаванов, В.Н. Шишов. - М.: Высшая школа, 1996. - т. 1 - 637 с.
2. Мелешкин М.Т., Степанов В.Н. Промышленные отходы и окружающая среда. - К: Наукова Думка, 1980. – 179 с.
3. Меньшиков В.В., Савельева Т.В. Методы оценки загрязнения окружающей среды: Учебное пособие. - М.: Изд-во МНЭПУ, 2000. – 60 с.
4. Практикум по химической технологии / Г.Г. Александрова, С.И. Вольфкович, Г.Ф. Бебих, Л.В. Кубасова, В.А. Жукова, Л.М. Позняк, Н.С. Рабовская, Н.Л. Соломонова, Р.М. Федорович, Н.Н. Кондратьев; Под ред. акад. С.И. Вольфковича. - М.: Изд-во Московского университета, 1968. - 366.
5. Экология и безопасность жизнедеятельности: Учеб. пособие для вузов / Д.А. Кривошеин, Л.А. Муравей, Н.Н. Роева и др.; Под ред. Л.А. Муравея. - М.: ЮНИТИ-ДАНА, 2000. – 447 с.
Похожие работы
... Глава II. Методики исследования загрязнения окружающей среды и оценки ее качества Для выполнения задач и достижения цели были разработаны нами методики исследования комплексной эколого-геохимической оценки урболандшафтов Волгоградской агломерации, которая заключается в исследовании почв, растительности, оценки выбросов промышленных предприятий и влияния ОС на здоровье человека. 2.1 ...
развития новых технологических процессов постоянно растет. Мы же остановимся на физических загрязнениях окружающей среды. Физические загрязнения, в свою очередь, подразделяются на: тепловые, шумовые, радиоактивные, электромагнитные. Рассмотрим источники, действие каждого из этих подвидов на окружающую среду и здоровье человека. Тепловое загрязнение. Наиболее масштабное однократное употребление ...
... , как на островах, и связано с чрезмерной охотой, прямым преследованием и изменением условий обитания одновременно. Об этом свидетельствует история исчезновения многих видов.[23] 5. Биологическое загрязнение биосферы 1. Биосфера — целостная, относительно устойчивая, гигантская экологическая система, зависимость исторически сложившегося в ней равновесия от связей между ее обитателями, их ...
... , постановлениями и распоряжениями Правительства РФ, законами Ханты-Мансийского Автономного Округа, постановлениями и Распоряжениями Губернатора автономного округа, положением о Комитете по экономической политике Ханты-Мансийского Автономного Округа. При выполнении своих функций отделы должны обеспечит решение задач, вытекающих из федеральных и региональных комплексных программ, направленных на ...
0 комментариев