Навигация
Реакція з морфіном і сірчаною кислотою [17]
3.5 Реакція з морфіном і сірчаною кислотою [17]
Розчин, що містить формальдегід, забарвлюється після додавання розчину сірчанокислого морфіну в концентрованій сірчаній кислоті (0,35 : 100) в рожевий колір, перехідний потім в темний синьо-фіолетовий. Реакцію можна проводити різними шляхами. Замість сірчанокислого морфіну придатний і хлористоводневий морфін. Чутливість реакції дуже висока і складає 1 : 250000
Інтенсивне забарвлення, головним чином синього тону, з'являється і при дії розчину кодеїну в сірчаній кислоті. Високі концентрації формальдегіду дають зелене забарвлення, і в таких випадках краще заздалегідь розбавити випробовуваний розчин. Реакція стає ще виразніше від додавання навіть слідів хлориду заліза (III) [45]. У пробірку вливають 3-4 мл сірчаної кислоти, близько 10 крапель 1-процентного спиртного розчину кодеїну, 2 краплі розчину хлориду заліза (III) і нарешті по краплях розбавлений розчин формальдегіду. Присутність формальдегіду можна знайти по появі синього забарвлення. Реакція вельми чутлива і дозволяє знайти формальдегід в кількостях до 1 f.
3.6 Відкриття формальдегіду у виді гексаметилентетрамина
Декілька мілілітрів водного розчину формальдегіду (більше або менше - в залежності від його змісту) обробляють надлишком аміаку і випаровують на водяній лазні, додаючи час від часу невеликі кількості аміаку так, щоб розчин постійно мав лужну реакцію. Залишок є характерними кристалами гексаметилентетраміна, ідентичність якого може бути доведена реакціями:
Реакція з хлоридом ртуті (II). Залишок від випаровування розчиняють в 3-5 мл води, поміщають одну краплю цього розчину на наочне скло і додають одну краплю насиченого водного розчину хлориду ртуті (II). Негайно або через деякий час утворюється осад, що має вид октаедрів або зірочок з трьома і промінням.
Реакція з реактивом Майєра. До однієї краплі розчину (див. вище) додають каплю розчину реактиву Майєра і дуже маленьку крапельку (з капіляра) розбавленої соляної кислоти: з'являються гексагональні світло-жовті зірочки.
Реакція з фероціанідом магнію-калія. 1 мл розчину (див. вище) гексаметилентетраміну обробляють декількома краплями насиченого розчину сульфату магнію і свіжо приготованого розчину фероціаніду калію; у вигляді жовтих лускових кристалів випадає осад подвійного з'єднання гексаметилентетраміну і фероціаніду калію-магнію складу
MgK[Fe(CN)e]2[12(CH2)eN4].12H20 [15].
3.7 Капілярний метод відкриття формальдегіду у вигляді формальдімедона
Реакцію утворення дімедона проводять на смужці фільтрувального паперу завдовжки 20 см і шириною 1 см, звуженої посередині до 3-4 мм на відстані 1 см. На звужену частину паперової смужки за допомогою вушка платинового дроту наносять концентрований спиртовий розчин дімедона і потім занурюють кінець смужки у випробовуваний водний розчин формальдегіду. При всмоктуванні розчину формальдегід затримується на межі вузької частини у вигляді формальдімедона. Після закінчення всмоктування випробовуваного розчину смужку занурюють у воду, щоб витіснити залишок випробовуваного розчину у вузькій частині і відмити весь надлишок дімедона.
Смужку паперу висушують, вирізують вузьку частину і піддають той, що утворився на нейформальдімедон мікросублімації при 130. Далі формальдімедон може бути ідентифікований за формою кристалів і температурі плавлення.
3.8 Кількісне визначення формальдегіду
Йодометричний метод. Визначення по Ромійну 1 г розчину формальдегіду вносять в мірну колбу місткістю 100 мл, в яку заздалегідь налито 2,5 мл води і 2,5 мл 1,0 н. розчину їдкого розжарюй. Добре перемішують і доповнюють розчин водою до мітки. До точно зміряних 10 мл цього розчину додають 50 мл 0,1 н. розчину йоду і 20,0 мл 1,0 н. розчину їдкого розжарюй, залишають на 15 мін., підкисляють 10 мл розбавленої сірчаної кислоти і титрують надлишок йоду 0,1 н. розчином тіосульфату до жовтого кольору. Потім підливають розчин крохмалю і дотитровують до кінця. Гіпойодит калію, що утворюється на холоду з йоду і їдкого розжарюй, окисляє в лужному розчині формальдегід в мурашину кислоту. 1 мл 0,1 н. розчину йоду відповідає 0,001501 г формальдегіди. Щоб одержати добрі результати, необхідно дотримувати наступні умови : вживаний розчин лугу повинен бути абсолютно вільний від присутності речовин, що окислюються (спирт); надлишок йоду повинен складати не менше 50%; йод і їдке розжарюй повинні змішуватися лише після надбавки формальдегіду; при підкислюючому слід уникати застосування великого надлишку кислоти. Вважається також, що гіпойодит і формальдегід повинні застосовуватися в достатньо високих концентраціях. Цей метод надає велику послугу при аналізі чистих розчинів формальдегіду, але непридатний у присутності оцтового альдегіду і інших реагуючих з йодом речовин.
Розроблений спеціальний метод, що дозволяє визначати формальдегід, оцтовий альдегід, озон, воду, перекис водню і мурашину кислоту при їх сумісній присутності. Запропоновано застосовувати замість лужного розчину йоду лужний розчин брому. Бром виділяють з розчину бромід-бромату точно відомого змісту за допомогою соляної кислоти, підлужнюють розчин, діють протягом 30 мін, на формальдегід, потім знову підкисляють, додають йодиду калію і титрують надлишок йоду тіосульфатом .
Метод з ціанідом калію. На формальдегід діють надлишком ціаніду і після закінчення реакції надлишок ціаніду відтитровують по Фольгарду . Можна також розчин, що містить надлишок ціаниду, підкисляти винною кислотою і відігнати ціаністий водень, уловлюючи його в розчині лугу, потім визначити титруванням нітратом срібла по Лібіху і Деніже. Надалі в аргентометричний спосіб були внесені нові зміни і, крім того, було запропоновано визначати надлишок ціаніду йодометрично . Останній прийом йодометричного визначення унаслідок своєї точності має особливе значення при аналізі малих кількостей формальдегіду. На формальдегід діють ціанідом калія в нейтральному або лужному розчині, причому негайно ж утворюється калієве похідне нітрилу глікольової кислоти, що поволі розкладається під дією води на глікольовокислий калій і аміак.
Надлишок ціаніду калію може бути визначений йодометрично. До розчину додають бром, який в кислому середовищі дає з ціанідом калію бромціан. Надлишок брому зв'язують, додавши фенол або сульфат гідразину, і додають йодид калію, який реагує з бромціаном, виділяючи вільний йод. Установка титру розчину ціаніду. 10-20 мл приблизно О,\М розчину ціаніду калію підливають з бюретки в мірну колбу з довгим горлом, сильно підкисляють концентрованою сірчаною кислотою і при перемішуванні обертанням додають бромисту воду до появи виразного жовтого забарвлення. Щоб видалити надлишок брому, додають з бюретки 0,025 М розчин сульфату гідразину точно до обезбарвлення розчину і потім ще надлишок 1-2мл. Вносять в розчин 0,5-1 г йодиду калії, розчинені в 4 мл води, і негайно титрують йод, що виділився, 0,1 н. розчином тіосульфату у присутності крохмалю.
Хід визначення. До 0,1 УІ розчину ціаніду калію, що знаходиться в мірній колбі, підливають випробовуваний розчин формальдегіду і поступають далі, як це вказано при установці титру. Кількість формальдегіду обчислюють по різниці між об'ємами розчину тіосульфату, витраченими в обох випадках; 1 мл 0,1 н. розчину тіосульфату відповідає 0,003002 г формальдегіди [16]
Похожие работы
х сумішей. Шляхи поліпшення якості проведення аналізів. Охорона праці при виконанні аналізу рідких, газоподібних і твердих речовин. В’язкість – це властивість рідини здавати опір взаємному переміщенню руху її частинок. Від в’язкості нафтопродуктів залежать експлуатаційні властивості зношення деталей, які труться, від вод тепла від них і витрати масла. З підвищенням температури в’язкість зменшу ...
... 2-3 л і більше, залежно від мети аналізу. Посуд повинен щільно закриватись. Для відбору проб з великих глибин використовують спеціальні прилади, так звані батометри. 4. Методи, які застосовуються для визначення стану водних об`єктів Визначення певного інгрідієнта або групи інгрідієнтів проводять з використанням хімічних, фізико-хімічних та фізичних методів. З хімічних методів в аналізі вод ...
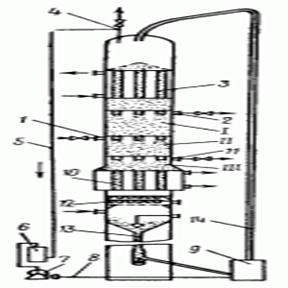
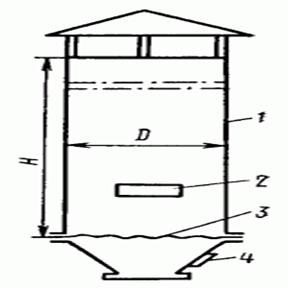
... вартістю абсорбентів. Загальними недоліками методів абсорбції є утворення рідинних стоків і громіздкість апаратурного оформлення. [8]. 3.2 Адсорбційний метод Адсорбційний метод є одним з найпоширеніших засобів захисту повітряного басейну від забруднень. Основними промисловими адсорбентами є активоване вугілля, складні оксиди і імпрегновані сорбенти. Активоване вугілля (АВ) нейтральне по ві ...
... проводиться з метою : - оцінки рівня родючості ґрунту для встановлення забезпеченості сільськогосподарських культур доступними формами елементів живлення і потреби у використанні добрив: - визначеним агрохімічних властивостей, що виявляють на взаємодії мінеральних добрив з ґрунтом і дозволяють робити висновок про необхідність хімічної меліорації , про строки внесення добрив ...
0 комментариев