Навигация
1.2 Получение пероксидов
Все простые пероксосоединения могут быть получены обменной реакцией между H2O2 и гидроксидом нужного металла.
Высокая реакционная способность щелочных металлов (за исключением лития) по отношению к кислороду позволяет синтезировать их пероксиды непосредственным окислением металла кислородом при атмосферном давлении. Эта способность обусловлена тем, что Na, K, Rb и Cs, в отличии от других металлов, обладают наибольшими значениями атомного радиуса и наименьшими значениями энергии ионизации. Литий же этими свойствами не обладает, и синтез пероксида лития осуществим лишь взаимодействием гидроксида с растворами H2O2 [2].
Лабораторные способы получения пероксидов сводятся к окислению избытком кислорода растворов металлов в жидком аммиаке или же к непосредственному сжиганию их при температуре около 300–400 ºС, причем образуются не только пероксиды типа Me2O2, но у калия, рубидия и цезия – типа Me2O4.
Пероксид лития в чистом виде добывают из кристаллического соединения Li2O2×H2O2×3H2O, высушивая его над P2O5 или H2SO4 в эксикаторе. Самое соединение Li2O2×H2O2×3H2O выкристаллизовывается из спиртового раствора смеси Li(OH) и H2O2.
Для натрия известен гидрат состава Na2O2×8H2O образующийся при взаимодействии Na2O2 с водой при сильном охлаждении. Кроме упомянутого соединения, может быть получен и гидрат состава Na2O2×2H2O2×4H2O, легко теряющий воду при высушивании в эксикаторе.
Пероксид бария BaO2 получают окислением BaO в токе кислорода при 500–520ºС, пероксидные соединения других элементов этой группы – взаимодействием соответствующих гидроксидов с растворами H2O2 [3].
1.3 Физические и химические свойства пероксидов
Пероксиды щелочных металлов представляют собой твердые кристаллические вещества различного цвета: пероксид лития – белого, натрия – слабо-желтого, калия – розового, рубидия и цезия, по-видимому, тоже розового цвета.
Пероксиды типа Me2[O3] окрашены в различные оттенки коричневого цвета. Их температура плавления несколько ниже температур плавления соответствующих пероксидов типа Me2[O2], но также повышаются от калия к цезию (таблица-1):
Таблица 1. Температуры плавления пероксидов типа Me2[O3]
| K2O3 | Rb2O3 | Cs2O3 | |
| Т. пл., ºС | 430 | 489 | 502 |
Температура плавления пероксидов в подгруппе повышается с увеличением порядкового номера (таблица-2):
Таблица 2. Температура плавления пероксидов типа Me2[O2]
| Li2O2 | Na2O2 | K2O2 | Rb2O2 | Cs2O2 | Fr2O2 | |
| Т. пл., ºС | 430 | 460 | 490 | 590 | 600 | – |
Температура плавления пероксидов типа Me2[O4] также соответственно несколько ниже температур плавления пероксидов типа Me2[O3] и в том же направлении повышаются (таблица-3):
Таблица 3. Температура плавления пероксидов типа Me2[O4]
| K2O4 | Rb2O4 | Cs2O4 | |
| Т. пл., ºС | 380 | 412 | 515 |
Цвет K2O4 оранжевый, Rb2O4 темно-коричневый, Cs2O4 желтый.
Пероксиды Ca, Sr, Ba и гидратные формы пероксиды Mg, Zn и Cd в чистом виде бесцветны и диамагнитны; пероксид ртути HgO2 желтого цвета.
Пероксиды термически очень устойчивы; устойчивость их повышается с увеличением заряда ядра. Однако с увеличением количества кислорода в молекуле их температуры плавления и термическая устойчивость понижаются.
Являясь солями слабой кислоты, они при растворении в воде подвергаются гидролизу:
Na2+[O2]2–+ 2H+OH– → H2+[O2]2– + 2Na+OH– (3)
Пероксиды же типа Me+2[O4]2 – при гидролизе дают помимо пероксида водорода и молекулу кислорода:
K2+[O4]2–+ 2H+OH– → H2+[O2]2– + O2 + 2K+OH– (4)
При действии кислот протекают те же самые реакции:
Na2+[O2]2– + H2+SO42– → H2+[O2]2– + Na2+SO42–, (5)
K2+[O4]2– + H2+SO42– → H2+[O2]2– + O2 + K2+SO42– (6)
Все пероксиды взаимодействуют с углекислым газом, выделяя кислород:
2Na2O2 + 2CO2↑ = 2Na2CO3 + O2↑. (7)
Во всех пероксидных соединениях, как простых, так и комплексных (известных в настоящее время для полусотни элементов), степень окисления образующего их элемента является максимальной и равна номеру группы, к которой относится этот элемент [3].
Похожие работы
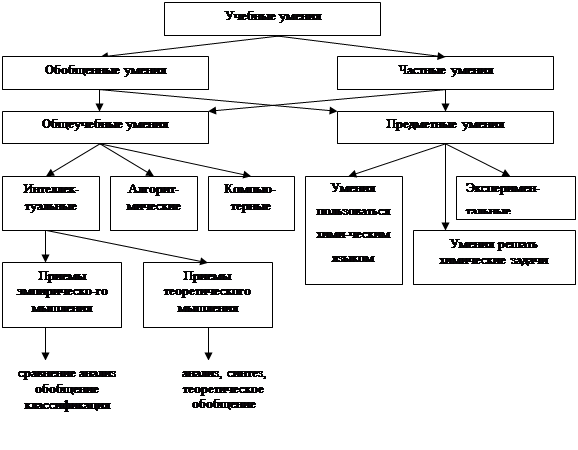
... "ОВР" можно свести в единую схему [13] , которая отражает их взаимосвязь (таблица 3). Таблица 3. Понятия об окислительно-восстановительных реакциях Умения пользоваться химическим языком I группа II группа Относительная электроотрицательность исление1восстановление1 степень окисления окисление2 восстановление2 окислитель восстановитель единство окисления и восстановления ОВР ...
... высших одноатомных спиртов. Так, например, в состав пчелиного воска входит эфир пальмитиновой кислоты и мирицилового спирта С15Н31-СО-ОС30Н61 (Тпл. 72 оС). Глицериды Глицеридами называются сложные эфиры карбоновых кислот и трехатомного спирта глицерина. Они входят в состав чрезвычайно важных веществ – жиров, поэтому на рассмотрении глицеридов мы остановимся несколько подробнее. Жиры Природные жиры ...

0 комментариев