Навигация
Фізико–хімічні властивості сульфату марганцю
2.3.1 Фізико–хімічні властивості сульфату марганцю
Сульфат марганцю MnSO4 – має температуру плавлення 973 К, приблизно при 1123 К розкладається на Mn3O4, SO3 і SO2. Розчинність у воді (г у 100 г): 52,9 (273 К), 64,8 (298 К), 35,5 (373 К), 20,5 (393 К), 3,9 (433 К). Відомі гідрати MnSO4 з 1,2,4,5 і 7 молекулами води. Моногідрат MnSO4·H2O утворюється при нагріванні інших гідратів сульфату марганцю до ~473 К, випадає із водних розчинів при 423 – 433 К. Дігідрат MnSO4·2H2O і тетрогідрат MnSO4·4H2O метастабільні. Дігідрат випадає з водних розчинів 298 – 313 К, тетрогідрат – при 300К. Пентогідрат MnSO4·5H2O має температуру плавлення 328 К. Гептогідрат MnSO4·7H2O – рожеві кристали, температура плавлення 281,6 К. Сульфат марганцю утворює аміакат з шістьма, а моногідрат з п’ятьма молекулами NH3. Сульфат марганцю зустрічається в природі у вигляді мінералів смікіту MnSO4·H2O, малардиту MnSO4·7H2O, джококуіту MnSO4·5H2O, ілезіту MnSO4·4H2O.
Одержують сульфат марганцю обробкою піролюзиту MnO2 горячою концентрованою H2SO4, розчиненням Mn і MnO у H2SO4, прокалюванням піролюзіту з безводним FeSO4, безводний сульфат марганцю – нагріванням його гідратів до 553 К.
Сульфат марганцю – проміжний продукт при переробці марганцевих руд і шламів. Його використовують для синтезу інших сполук Mn, як компонент електроліту при одержані MnO2 і Mn, компонент фарбників у текстильній промисловості, каталізатор у органічному синтезі, мікродобриво.
2.3.2 Фізико–хімічні властивості сульфату нікелю
Сульфат нікелю NiSO4 – лимонно–жовті кристали, що розкладаються вище 973 К з утворенням NiO і SO3, тиск дисоціації 7,5 кПа (1033 К); гігроскопічний; розчинність у воді (г у 100 г): 21,4 (273 К), 29,94 (303 К), 33,39 (323 К), 43,42 (372 К). Утворює гідрати, найважливіший з них – нікелевий купорос NiSO4·7H2O, який кристалізується з водних розчинів в інтервалі 276,4 до 304,5 К; температура плавлення 304,5 К; розчинність у воді 101 г у 100 г (283 К). Моногідрат NiSO4·H2O стійкий вище 357,8 К, збезводнюється при 553 К. Гідрати з 2, 3, 4, і 5 молекулами води метастабільні, кристалізуються з водних розчинів при 363 – 371 К.
Нікелевий купорос одержують взаємодією Ni, NiO, Ni(OH)2 або гідрокарбонату Ni з H2SO4; розчиненням Ni у розбавленій H2SO4, що вміщує трохи HNO3, з наступною нейтралізацією гідроксокарбонатом нікелю і упарюванням.
Сульфат нікелю зустрічається у природі: мінерали мореіозіт NiSO4·7H2O, ретгерсит α – (NiSO4·6H2O), нікельгексогідрит β – (NiSO4·6H2O).
Нікелевий купорос, а також суміш гепта- і гексагідратів використовують для одержання чистого електролітичного Ni, інших сполук Ni і нікельвмістних каталізаторів; нікелевий купорос – компонент електролітів у гальванотехніці для нанесення покриттів на метали; нікелевий купорос застосовують також як фунгіцид.
3. ОПИС ТЕХНОЛОГІЧНОЇ СХЕМИ
На рисунку 3.1 наведено принципову технологічну схему технології утилізації нікелю та марганцю у виробництві синтетичних алмазів.
Неочищений продукт синтезу подається на сита С, де розділяється на три фракції: d=0,75 мм; d=0,375 мм та d=0,125 мм.
Гранули, діаметр яких d>0,75 мм подаються знову на подрібнення у дробарку Д та знову повертаються на сита. Після сит неочищений продукт синтезу йде на вилуговування у реактор–вилужувач ВЛ1, куди також подається сірчана кислота з цеху приготування розчину.
Після закінчення циклу вилуговування, що складає 2 години, рідка фаза що являє собою розчини H2SO4 з концентрацією w=5–15 % ваг., що містять в своєму складі MnSO4 і NiSO4, декантується та подається в збірник ЗБ1.
Із ВЛ1 нижня частина суспензії подається на фільтр Ф1, де розділяється на тверду фазу та маточний розчин. Тверда частина – алмазографітова шихта, йде на подальшу переробку та отримання алмазу.
Відфільтрований розчин після фільтра Ф1 подається у збірник ЗБ1.
У ЗБ1 відбувається осадження сполук нікелю та марганцю за допомогою розчинів NaOH та H2O2, які подаються з цеху приготування розчинів. Крім того тут використовується розчин NaOH, що утворюється на стадії кінцевого очищення алмазів від домішок, що містять близько 1 % з'єднань кремнію.
Отримана суспензія після ЗБ1 відстоюється у відстійнику ВТ. Очищена рідина – водно-сольовий розчин з відстійника ВТ йде на переробку, а суспензія на фільтрування до фільтра Ф2.
При фільтруванні на фільтрі Ф2 утворюється очищена рідина і осад, що містять в своєму складі з'єднання таких елементів як: марганець, нікель, натрій, кремній та органічні сполуки.
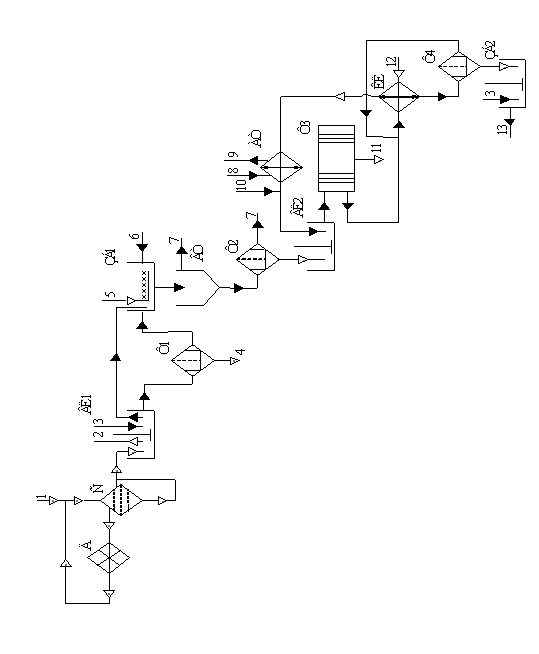
Відфільтрована рідина прямує на подальшу переробку, а тверда фаза, яка містить переважно гідроксиди і оксиди марганцю і нікелю спрямовується у вилужувач ВЛ2, де піддається обробці NH4OH з концентрацією 20–24 %. В результаті такої обробки з'єднання нікелю переважно переходять в розчин, а з'єднання марганцю та заліза залишаються в нерозчиненому вигляді.
Отримана суспензія фільтрується на фільтр–пресі Ф3. Після чого тверда фаза, що містить з'єднання марганцю і 5–10 % нікелю, в перерахунку на чистий метал, прямує на металургійну переробку.
Після відділення твердої фази на фільтрі Ф3 із розчину, що містить аміачні комплекси нікелю відгоняють аміак разом з парою за допомогою кип’ятіння у КЛ. Далі аміак з парою прямує на конденсацію у АТ, а після чого знову потрапляє на стадію вилуговування сполук нікелю у ВЛ2. В результаті відгонки пари з аміаком нікель випадає в осад у вигляді Ni(OH)2, який відділяється від розчину фільтруванням на фільтрі Ф4. Обробкою осаду Ni(OH)2 за допомогою H2SO4 одержують розчин NiSO4 у ЗБ2, який є товарним продуктом. Після фільтрування розчин NaOH прямує на отримання нікелю (II) гідроксиду у КЛ.
Таким чином, запропонована схема дозволяє значно поліпшити екологічний стан у промисловому районі і дозволяє повернути цінний нікель у вигляді додаткової ліквідної хімічної продукції.
Для існуючого виробництва синтетичних алмазів запропоновано принципову технологічну схему очищення стічних вод, що містять з'єднання марганцю і нікелю, з двома способами утилізації водно-сольового розчину; електродіаліз з отриманням NaClО і H2 або спрямовування розчину у водооборотну систему підприємства.
4. ЕНЕРГОЗБЕРЕЖЕННЯ ТА ЕКОЛОГІЯ
Запропонована схема утилізації нікелю та марганцю значно скорочує кількість необхідних енергоресурсів за рахунок використання енергії розігріву реакційної суміші при розчиненні сірчаної кислоти та за рахунок реакції взаємодії металів з кислотою. Додатково для скорочення кількості енергоресурсів проводиться автоматичне регулювання температури і підігрів вмикається на останній стадії.
За рахунок використання H2SO4 зменшується кількість газо образних викидів та спрощена схема утилізації твердих відходів у вигляді суміші солей нікелю та марганцю.
Стічні води, та газові викиди, що містять іони нікелю та марганцю – токсичні речовини з досить різноманітним впливом на організм: можуть викликати зміни в кровообігу, органах подиху, нервовій системі, обмін речовин; загальну реактивність організму.
Екологічна обстановка залишається дуже складною. Проводиться багато досліджень з метою створення безвідходних технологій, що дозволять ліквідувати чи забезпечити мінімальні шкідливі викиди у водоймища, ґрунт і атмосферу.
Весь комплекс проведених досліджень і запропонована технологічна схема дозволяють скоротити кількість викидів та кількість необхідних енергоресурсів до мінімально можливих величин.
5. РОЗРАХУНОК МАТЕРІАЛЬНОГО БАЛАНСУ
Вихідні дані:
Концентрація H2SO4 = 15 %;
Співвідношення Ni/Mn = 40/60;
Ступінь перетворення (a) – 97 %;
Продуктивність – 20 млн. карат/місяць або 4000 кг/місяць;
Співвідношення (алмаз+графіт) / (Ni+Mn) = 50/50.
Маса суміші алмазів, що подається на очистку:
 (5.1)
(5.1)
Сумарна маса Ni+Mn:
![]() (5.2)
(5.2)
Визначаємо масу Ni:
![]() (5.3)
(5.3)
Визначаємо масу Mn:
![]() (5.4)
(5.4)
Процес очищення алмазу від солей Ni представляємо у вигляді рівняння:
Ni + H2SO4 = NiSO4 + H2. (5.1)
По цьому рівнянню розрахуємо кількість H2SO4, необхідну для взаємодії з нікелем:
![]() . (5.5)
. (5.5)
Тоді кількість отриманого NiSO4 складатиме:
![]() . (5.6)
. (5.6)
Кількість одержаного H2 за результатами реакції (5.1) складе:
![]() або
або
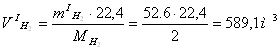 . (5.7)
. (5.7)
Залишилось Ni після реакції:
![]() . (5.8)
. (5.8)
Процес очищення алмазу від солей Mn представляємо у вигляді рівняння:
Mn + H2SO4 = MnSO4 + H2. (5.2)
По цьому рівнянню розрахуємо кількість H2SO4, необхідну для Mn:
![]() . (5.9)
. (5.9)
Тоді кількість отриманого MnSO4 складатиме:
![]() .
.
Кількість одержаного H2 за результатами реакції (5.2) складе:
![]() або
або
 .
.
Залишилось Mn після реакції:
![]() .
.
Усього по реакції (5.1) та (5.2) необхідно H2SO4:
![]() .
.
Залишилось H2SO4 після реакцій (5.1–5.2):
![]() .
.
Усього по реакції (5.1) та (5.2) необхідно H2:
![]() або
або
![]() .
.
Розрахуємо кількість води, необхідної для отримання 15 % H2SO4:
![]() .
.
Результати розрахунків зводимо у таблицю 5.1.
Таблиця 5.1 – Матеріальний баланс
| Прихід | Витрати | ||||
| Компонент | m, кг | м3 | Компонент | m, кг | м3 |
| Алмаз+графіт | 4000 | Алмаз+графіт | 4000 | ||
| Ni | 1600 | Ni | 48 | ||
| Mn | 2400 | Mn | 72 | ||
| H2SO4 | 6934 | H2SO4 | 208,02 | ||
| H2O | 39293 | H2O | 39293 | ||
| NiSO4 | NiSO4 | 4077,3 | |||
| MnSO4 | MnSO4 | 6391,4 | |||
| H2 | H2 | 137,3 | 1537,5 | ||
| Усього: | 54227 | – | Усього: | 54227 | |
6. РОЗРАХУНОК ТЕПЛОВОГО БАЛАНСУ
Вихідні дані приведені в таблиці 6.1.
Таблиця 6.1 – Теплоємність та тепловий ефект речовин [11]
| Компонент | Теплоємність при 25 °С, Дж/моль·град | Тепловий ефект при 25 °С, кДж/моль |
| Алмаз+графіт | 7,3 | |
| Ni | 26,05 | 0 |
| Mn | 26,32 | 0 |
| H2SO4 (15%) | 137,57 | 194,6 |
| H2О | 75,3 | |
| NiSO4 | 80,0 | –888,0 |
| MnSO4 | 100,0 | –994,0 |
| H2 | 28,83 | 0 |
Тепловий ефект реакцій (5.1) та (5.2) розраховуємо за формулою:
![]() (6.1)
(6.1)
За даними таблиці 6.1 розраховуємо тепловий ефект реакції (5.1):
![]() .
.
За даними таблиці 6.1 розраховуємо тепловий ефект реакції (5.2):
![]() .
.
Розрахунок зводимо до визначення необхідної кількості тепла:
 (6.2)
(6.2)
де Qпралмаз – тепло, що подається з алмазом, кДж/моль;
QпрNi – тепло, що подається з Ni, кДж/моль;
QпрMn – тепло, що подається з Mn, кДж/моль;
![]() – тепло, що пішло з H2SO4, кДж/моль;
– тепло, що пішло з H2SO4, кДж/моль;
![]() – тепло, що пішло з H2O, кДж/моль;
– тепло, що пішло з H2O, кДж/моль;
QТ1р-ції – тепло, що пішло на 1–у реакцію, кДж/моль;
QТ2р-ції – тепло, що пішло на 2–у реакцію, кДж/моль;
Qвиталмаз – тепло, яке виходить з алмазом, кДж/моль;
QвитNi – тепло, яке виходить з Ni, кДж/моль;
QвитMn – тепло, яке виходить з Mn, кДж/моль;
QвитMnSO4 – тепло, яке виходить з MnSO4, кДж/моль;
QвитNiSO4 – тепло, яке виходить з NiSO4, кДж/моль;
![]() – тепло, яке виходить з H2SO4, кДж/моль;
– тепло, яке виходить з H2SO4, кДж/моль;
![]() – тепло, яке виходить з H2O, кДж/моль;
– тепло, яке виходить з H2O, кДж/моль;
QвитH2 – тепло, яке виходить з H2, кДж/моль;
Qвит – тепло витрат (2 %), кДж/моль.
6.1 Розрахунок приходу теплаРозрахунок приходу тепла розраховується за формулою:
![]() (6.3)
(6.3)
де mі – маса компонента, кг;
tівх – температура входу, дорівнює 25 °С;
Сі – теплоємність, кДж/моль·град.
Тепло, яке надходить з алмазом:
![]()
Тепло, що надходить з нікелем:
![]()
Тепло, що надходить з марганцем:
![]()
Тепло, яке поступає з сірчаною кислотою:
![]()
Тепло, яке поступає з водою
![]()
Тепло, що пішло на реакцію (5.1):

Тепло, що пішло на реакцію (5.2):

Сумарний прихід тепла:
![]()
Розрахунок витрату тепла розраховується за формулою:
![]() (6.4)
(6.4)
де tівих – вихідна температура °С.
Вихідне тепло алмазу складає:
![]()
Вихідне тепло з нікелем:
![]()
Вихідне тепло з марганцем:
![]()
Вихідне тепло NiSO4:
![]()
Вихідне тепло MnSO4:
![]()
Тепло, що виходить з сірчаною кислотою:
![]()
Тепло, що виходить з водою:
![]()
Вихідне тепло з Н2:
![]()
Тепло витрат:
![]()
Тоді вихідна температура потоків за умови витрат дорівнює:
![]() (6.5)
(6.5)
![]() + 2021769,7
+ 2021769,7
![]() °С
°С
Вихідне тепло алмазу складає:
![]()
Вихідне тепло з нікелем:
![]()
Вихідне тепло з марганцем:
![]()
Вихідне тепло NiSO4:
![]()
Вихідне тепло MnSO4:
![]()
Тепло, що виходить з сірчаною кислотою:
![]()
Тепло, що виходить з водою:
![]()
Вихідне тепло з Н2:
![]()
Результати розрахунків зводимо у таблицю 6.2.
Таблиця 6.2 – Тепловий баланс
| Прихід тепла | Витрата тепла | ||
| Кількість теплоти | кДж/моль | Кількість теплоти | кДж/моль |
| Qпралмаз | 730000 | Qпралмаз | 725036 |
| QпрNi | 1042000 | QпрNi | 31047,43 |
| QпрMn | 1579200 | QпрMn | 47053,84 |
| QпрH2SO4 | 23847727,7 | QвитNiSO4 | 8099125,2 |
| QпрH2O | 73968346,38 | QвитMnSO4 | 15869891,35 |
| QТ1р-ції | –28478 | 710566,9 | |
| QТ2р-ції | –50310 | QпрH2O | 73465361,6 |
| QвитH2 | 98260,8 | ||
| Qвит | 2021769,7 | ||
| Всього: | 101088486 | Всього: | 101068112,8 |
7. РОЗРАХУНОК ОСНОВНОГО АПАРАТУ
Реактор–вилуговувач має вигляд циліндричного апарату, з конічним днищем.
Усі апарати працюють 8 годин в день. Один цикл складає 2 години. Знаючи кількість розчину, який переробляється за місяць, знайдемо об’єм розчину, який переробляється за один цикл.
![]() кг/годину.
кг/годину.
 м3.
м3.
Знайдемо об’єм апарату:
![]() , (7.1)
, (7.1)
де (1+0,5) – співвідношення,
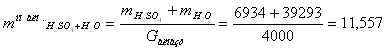 кг.
кг.
![]() л.
л.
Так як відомо, що співвідношення висоти апарату до його діаметру дорівнює приблизно 1,7, тоді
H = 1,7·d (7.2)

З попередньої формули знайдемо діаметр апарату:
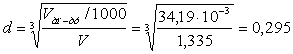 м.
м.
Тоді висота апарату дорівнюватиме із формули (7.2):
H = 1,7·0,295 = 0,501 м.
Так як за умовою висота конічної частини апарату у 6 разів менша за загальну висоту, то:
![]() м.
м.
Знайдемо об’єм конічної частини:
 м3 = 1,9 л.
м3 = 1,9 л.
Знайдемо об’єм циліндричної частини апарату:
 м3 = 5,7 л.
м3 = 5,7 л.
V = Vцил – Vкон = 0,0057 – 0,0019 = 0,0038 м3.
Висоту апарату приймаємо 510 мм. Висоту конусної частини приймаємо 85 мм. Діаметр апарату приймаємо 300 мм.
Із зовнішньої сторони апарат покривається рубашкою, що підігріває робочий розчин.
Враховуючи середовище в апараті вибираємо матеріал апарату.
Середовище: H2SO4 (15 %), при Т = 20–37 ˚С.
Матеріал: сталь Х18Н10Т + поліетиленова футеровка.
8. ОХОРОНА ПРАЦІ 8.1 Загальна характеристика умов здійснення технологічного процесу
Похожие работы
... 15. Білецька В. Українські сорочки, їх типи, еволюція і орнаментація//Матеріали доетнографії та антропології. 1929. Т. 21—22. Ч. 1. С. 81. 16. Кравчук Л. Т. Вишивка // Нариси історії українського декоративно-прикладного мистецтва. Львів, 1969. С. 62. 17. Добрянська І. О„ Симоненко І. Ф, Типи та колорит західноукраїнської вишивки//Народна творчість та етнографія. 1959. № 2. С. 80. 18. ...
... та нітратний азот, аміаковий азот, хлориди, залізо загальне, важкі метали (Сu, Мn, А1, Сг, Ni). Згідно з матеріалами досліджень на якісний склад дренажних вод негативно впливає ряд чинників: антропогенні (літні табори для випасу худоби, несанкціоновані сміттєзвалища, залишки складів мінеральних добрив га пестицидів), природні (нітрифікація, амоштизація, мінералізація донних відкладень), а також ...
0 комментариев