Навигация
Зависимость растворимости ПАВ от температуры
2.1 Зависимость растворимости ПАВ от температуры
Известно много важных и весьма интригующих проявлений влияния температуры на самоассоциацию ПАВ. Одно из них, имеющее огромное практическое значение, — сильная температурная зависимость растворимости ПАВ, в основном характерная для ионных ПАВ. Их растворимость при низких температурах может быть очень незначительной, но резко увеличивается в относительно узком температурном интервале. Эту закономерность обычно называют явлением Крафта, а температуру начала резкого возрастания растворимости — точкой Крафта или температурой Крафта. Температурная зависимость растворимости ПАВ в этой области показана на рис.
Добавление простых спиртов приводит к понижению KKM, причем понижение KKM практически линейно зависит от концентрации спирта. Наклон зависимостей резко увеличивается с уменьшением полярности спирта.
Точка Крафта может сильно изменяться при незначительных вариациях в строении молекулы ПАВ. Для ПАВ с алкильными цепями характерны следующие закономерности.

1. Точка Крафта возрастает с увеличением длины алкильной цепи, причем возрастание не регулярное, проявляется различие между «хвостами» с четным и нечетным числом атомов С.
2. Точка Крафта сильно зависит от природы полярной группы и противоиона. Добавление солей обычно приводит к повышению точки Крафта. В то же время многие другие растворенные вещества ее понижают. Общие закономерности, связывающие точку Крафта и природу противоиона, не установлены. Например, точка Крафта щелочных алканоатов увеличивается при уменьшении атомного номера противоиона, тогда как для щелочных сульфатов или сульфонатов наблюдается прямо противоположная зависимость. В случае катионных ПАВ точка Крафта обычно выше для бромидов, чем для хлоридов, и еще выше для иодидов. В случае двухзарядных противоинов точка Крафта обычно заметно повышается.
Эффект Крафта легко объясняется одновременным проявлением температурной зависимости молекулярной растворимости ПАВ и температурной зависимости ККМ. Как уже было сказано выше, KKM настолько слабо зависит от температуры, что в первом приближении можно считать, что она вообще не зависит от температуры. В тоже время распад мицелл на составные сольватированные ионы увеличивается с температурой, как это характерно для простых солей. Если такое растворение происходит ниже ККМ, мицеллы не образуются и общая растворимость ПАВ лимитируется низкой молекулярной растворимостью. Если же молекулярная растворимость достигает ККМ, то могут возникать мицеллы. Как мы увидим далее, характерная особенность процесса мицеллообразования состоит в том, что при увеличении концентрации мицелл практически не происходит изменения активности молекулярно растворенного ПАВ. Этот факт и высокая растворимость мицелл объясняют, почему при совсем небольшом увеличении молекулярной растворимости наблюдается резкое увеличение общей растворимости ПАВ.
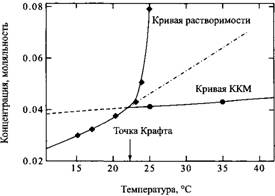
Температурная зависимость растворимости ПАВ в области точки Крафта
Точка Крафта определяется соотношением энергий ПАВ в твердом кристаллическом состоянии и в мицеллярных растворах. Энергия мицеллярных растворов слабо изменяется в различных случаях, например в зависимости от природы противоиона, в то время как из-за параметров упаковки энергия кристаллического состояния может изменяться очень резко. Чтобы понять явление Крафта, необходимо разобраться в эффектах упаковки и электростатических взаимодействиях ионов в твердом теле.
Если растворимость ПАВ очень низка, то оно не будет иметь практического значения. Поскольку длинноцепочечные ПАВ обычно более эффективны, то при молекулярном дизайне поверхностно-активных веществ следует соблюдать тонкий баланс. Снизить точку Крафта обычно удается, варьируя состояние твердого ПАВ. Наряду с изменением противоиона, что не всегда возможно, следует иметь в виду особенности пространственной упаковки гидрофобных цепей. Разработка ПАВ с пониженными точками Крафта обычно основана на уменьшении выгодности упаковки цепей в твердом состоянии. Для этого используют следующие приемы:
1) введение метальных групп или других заместителей для разветвления цепей;
2) ведение двойных связей в алкильные цепи;
3) введение полярных сегментов между алкильной цепью и ионной группой.
Эти же общие принципы используют при производстве ПАВ, совместимых с жесткой водой. Контроль «плавления» цепей также очень важен для биологических систем, в частности для биомембран, и достигается регулированием ненасыщенности углеводородных цепей.
3. Движущие силы мицеллообразования и термодинамические модели
3.1 Гидрофобные взаимодействия
Уже неоднократно говорилось о дифильности как о важной характеристике ПАВ и полярных липидов. Взаимодействие воды с гидрофобными группами невыгодно. Это создает движущую силу выталкивания их из водного окружения, что может быть достигнуто в результате макроскопического разделения фаз или «маскировки» неполярных групп каким-то другим способом. Известно множество других проявлений гидрофобных эффектов и гидрофобных взаимодействий.
На молекулы углеводорода в воде действует сила, стремящаяся перенести их в углеводородную фазу или любое другое неполярное окружение. Если к углеводородной молекуле присоединить полярную группу, возникает противоположная сила, препятствующая макроскопическому разделению на фазы. Если эта сила невелика, разделение будет происходить. Если она больше гидрофобного эффекта, дифильное вещество может оставаться молекулярно растворенным или присутствовать в виде небольших агрегатов, например димеров. Самоассоциация ПАВ всегда сопряжена с балансом гидрофобных и гидрофильных взаимодействий.
Гидрофобные взаимодействия усиливаются с увеличением длины алкильной цепи алкана или гидрофобной группы ПАВ. Снижение растворимости алканов с увеличением числа атомов углерода в молекуле коррелирует с изменением KKM ПАВ.
Явления, контролируемые гидрофобными взаимодействиями, т.е. стремлением устранить контакт между водой и неполярными молекулами или неполярными поверхностями: а — вода и масло не смешиваются друг с другом, при этом возникает сильная движущая сила, выталкивающая молекулы углеводородов из воды; б — самоорганизация молекул поверхностно-активных веществ; в — другие типы ассоциации углеводородных цепей; г — фолдинг белков; д — сильная адгезия неполярных поверхностей в воде; е — несмачивание водой гидрофобных поверхностей; — быстрая коагуляция гидрофобных частиц в воде; з — прикрепление гидрофобных частиц к пузырькам воздуха.
Заметим, что мицеллообразование можно рассматривать как промежуточное явление между разделением на фазы и образованием комплексов; это проявляется и в подходах к моделированию мицеллообразования с точки зрения термодинамики. Образование мицелл обычно рассматривают в рамках одной из следующих моделей.
4. Модель фазового разделения
В этой модели образование мицелл рассматривается как процесс, аналогичный фазовому разделению, причем мицеллы являются новой фазой, а KKM — концентрацией насыщения раствора молекулярным ПАВ. Избыток ПАВ сверх ККМ, следовательно, влияет только на концентрацию мицелл. Эта модель мицеллообразования особенно удобна для интерпретации экспериментальных данных. В результате физико-химических измерений получают среднюю величину по различным состояниям, в которых могут находится молекулы ПАВ. Ниже KKM существуют только отдельные молекулы ПАВ, и среднее значение величины Q равно
![]()
Для концентраций выше ККМ, учитывая, что Cmic = Ctot - KKM и Caq = ККМ, получим:
![]()
Для концентраций существенно выше KKM <Q> приближается к Qmc· Модель фазового разделения не вызывает трудностей при ее использовании, она наглядна и подходит для описания многих систем. Она выполняется тем
лучше, чем выше числа агрегации ПАВ в мицеллах.
4.1 Модель, основанная на законе действующих масс
Предположим, что мицеллярный комплекс одного типа находится в равновесии с мономерной формой ПАВ А\\
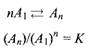
К — константа равновесия. Согласно этой модели, числа агрегации можно получить из вариации Qua^ вблизи ККМ. Причем чем более плавно происходит изменение системы, тем меньше число агрегации и тем больше для описания такой системы применима модель, основанная на законе действующих масс, а не модель фазового разделения. Зависимости доли ПАВ, входящего в состав мицелл, от общей концентрации ПАВ показаны на рис. для разных чисел агрегации.

Зависимость доли ПАВ, переходящего в мицеллы, от общей концентрации ПАВ для систем с разными числами агрегации N.
При очень больших числах агрегации N на этих зависимостях наблюдается резкий скачок, и вариация в пределе будет такой же, как предсказывается моделью фазового разделения.
В реальности мицеллы не монодисперсны, поскольку всегда есть некоторое распределение по числам агрегации и мицеллы образуются постепенно, что учитывает следующая модель мицеллообразования.
4.2 Модель множественных равновесий
Данные равновесия описывают поведение неионных ПАВ. Чтобы учесть ассоциацию противоионов с мицеллами, необходимо записать равновесия для противоинов. Вообще говоря, это не совсем правильный подход, поскольку оперирование константами равновесия подразумевает взаимодействия на малых расстояниях с образованием определенных комплексов. Распределение противоионов контролируется электростатическими взаимодействиями, действующими на больших расстояниях. Именно поэтому невозможно приписать определенные характеристики противоионам, связанным с мицеллами. В то же время это не означает, что связывание противоионов или их ассоциация с мицеллой теряет физический смысл. Таким образом, необходимо представлять ограничения соответствующих моделей при анализе данных.
Похожие работы
... свойств составляющих их компонентов. Исследована эффективность первапорационного разделения смеси метанол-метилбутиловый эфир через хитозановую мембрану, модифицированную серной кислотой и четырьмя поверхностно-активными веществами. Для модифицированной серной кислотой хитозановой мембраны содержание метанола в пермеате составляет 70 вес.% при 250С. При 500С разделительный фактор снижается. ...
... моноклональных антител, даже если их получают на основе человеческих гибридом. Эта проблема не нова для медицины и не является непреодолимой. 02.09.10-15.09.10 18 Тема №18. Технология лекарственных форм в экстремальных условиях. По причинам возникновения чрезвычайные ситуации могут быть техногенного, природного, биологического, экологического и социального характера. Внутренними ...
0 комментариев