Навигация
Жидкость остается на поверхности другой фазы в виде капли
1. Жидкость остается на поверхности другой фазы в виде капли.
2. Капля растекается по поверхности.
На рис. 2.4.1.2 показана капля на поверхности твердого тела в условиях равновесия.
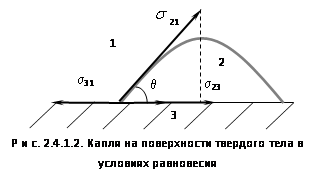
Поверхностная энергия твердого тела, стремясь к уменьшению, растягивает каплю по поверхности и равна s31. Межфазная энергия на границе твердое тело - жидкость стремится сжать каплю, т.е. поверхностная энергия уменьшается за счет уменьшения площади поверхности. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между жидкой, твердой и газообразной фазами по касательной к сферической поверхности капли и равно s21. Угол q (тетта), образованный касательной к межфазным поверхностям, ограничивающим смачивающую жидкость, имеет вершину на границе раздела трех фаз и называется краевым углом смачиваемости. При равновесии устанавливается следующее соотношение
![]() - закон Юнга.
- закон Юнга.
Отсюда вытекает количественная характеристика смачивания как косинус краевого угла смачивания ![]() . Чем меньше краевой угол смачивания и, соответственно, чем больше cos q, тем лучше смачивание.
. Чем меньше краевой угол смачивания и, соответственно, чем больше cos q, тем лучше смачивание.
Если cos q > 0, то поверхность хорошо смачивается этой жидкостью, если cos q < 0, то жидкость плохо смачивает это тело (кварц – вода – воздух: угол q = 0; «тефлон – вода – воздух»: угол q = 1080). С точки зрения смачиваемости различают гидрофильные и гидрофобные поверхности.
Если 0< угол q<90, то поверхность гидрофильная, если краевой угол смачиваемости q>90, то поверхность гидрофобная. Удобная для расчета величины работы адгезии формула получается в результате сочетания формулы Дюпре и закона Юнга:
![]() ;
;
![]() ;
;
![]() - уравнение Дюпре-Юнга.
- уравнение Дюпре-Юнга.
Из этого уравнения видна разница между явлениями адгезии и смачиваемости. Разделив обе части на 2, получим
![]() .
.
Так как смачивание количественно характеризуется cos q, то в соответствии с уравнением оно определяется отношением работы адгезии к работе когезии для смачивающей жидкости. Различие между адгезией и смачиванием в том, что смачивание имеет место при наличии контакта трех фаз. Из последнего уравнения можно сделать следующие выводы:
1. При q= 0 cos Q = 1, Wa=Wk.
2. При q = 900 cos q = 0, Wa=Wk/2.
3. При q =1800 cos q = -1, Wa=0.
Последнее соотношение не реализуется.
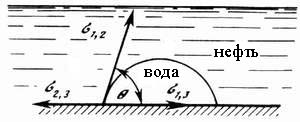
Коэффициент растекания по Гаркинсу. Условие растекания и смачивания. Эффект Марангони. Правило АнтоноваРассмотрим условие растекания жидкости 2 по поверхности 3. Это условие можно получить из закона Юнга, приняв, что процесс проходит при q < 0. Тогда s31 ³ s23 + s21.
При этом условии равновесие становится невозможным и происходит растекание. Из уравнения следует, что уменьшение межфазного натяжения s23 и уменьшение поверхностного натяжения жидкости s21способствует растеканию. Если разность s31 и s23 заменить выражением из уравнения Дюпре, что получим условие растекания в виде

Таким образом, растекание происходит в том случае, если работа адгезии превышает работу когезии растекания жидкости. Разницу между левой и правой частями неравенства называют коэффициентом растекания f или коэффициентом растекания по Гаркинсу F
![]() ;
; ![]() .
.
При положительном значении коэффициента растекания жидкость растекается, при отрицательном - не растекается. Растекание жидкости с меньшим поверхностным натяжением по жидкости с бớльшим поверхностным натяжением называют эффектом Марангони. Под ним понимают движение в поверхностных слоях, вызванное градиентом поверхностного натяжения. Обычно неоднородность по поверхностному натяжению обусловлена неодинаковостью состава и температуры в разных точках межфазной поверхности. Течение происходит из области малых натяжений в сторону бớльших натяжений вследствие самопроизвольного уменьшения энергии Гиббса поверхности. Если предположить, что течение следует закону Ньютона, то напряжение сдвига давления записывается таким образом:
![]() ,
,
где х - направление по поверхности в направлении движения жидкости.
При растекании раствора поверхностно-активных веществ (ПАВ) градиент поверхностного натяжения можно разложить на два сомножителя:
![]() ,
,
где ![]() - характеризует поверхностную активность поверхностно-активных веществ (ПАВ);
- характеризует поверхностную активность поверхностно-активных веществ (ПАВ);
![]() - градиент его концентрации в направлении движения.
- градиент его концентрации в направлении движения.
Скорость течения раствора в межфазном слое пропорциональна напряжению сдвига:
![]() ,
,
где DС - разность концентрации в поверхностном слое, заменяющая градиент концентрации.
Из полученного соотношения следует, что скорость поверхностного течения раствора тем выше, чем больше поверхностная активность растворенного вещества и чем больше разность концентраций в направлении движения. Эффект играет существенную роль в процессах массопереноса.
Если одна жидкость находится в контакте с другой, то со временем происходит их взаимное насыщение. В результате разность между поверхностными натяжениями фаз уменьшается, что ведет к ухудшению растекания. Коэффициент растекания уменьшается почти до нуля. Это позволило сформулировать правило Антонова, в соответствии с которым формула для коэффициента растекания для систем с взаимно насыщенными жидкостями примет вид
![]() ,
,
где s31, s21 - поверхностное натяжение двух взаимно насыщенных жидкостей и s23 - межфазное натяжение на границе между взаимно насыщенными жидкостями.
Если жидкости не растекаются друг по другу, то при взаимном насыщении коэффициент растекания отрицателен, это ведет к увеличению краевого угла и несоблюдению правила Антонова.
Адсорбция ионов на кристалле. Электрокинетические явления
Образование и строение ДЭС. Электрокинетический потенциал. Правила написания мицелл
Адсорбция электролитов сводится к адсорбции ионов, т.е. переходу ионов из одной фазы в другую. Это явление приводит к образованию двойного электрического слоя (ДЭС). Переход ионов обусловлен различием значения величины химического потенциала компонентов (ионов) в граничащих фазах. Ионы переходят из фазы с большим значением в фазу с меньшим значением. В результате на границе раздела фаз образуется скачок потенциала, который приостанавливает дальнейший переход ионов. В зависимости от значения ионы переходят из раствора на поверхность или наоборот. В обоих случаях поверхность приобретает избыточный заряд, который компенсируется ионами противоположного знака. Таким образом, на поверхности раздела фаз возникает двойной электрический слой (ДЭС).
Пути образования ДЭС:
1-й путь – адсорбционный;
2-й путь - поверхностная диссоциация.
Рассмотрим 1-й путь. Пусть происходит реакция
AgNO3 + KCl ® AgCl + KNO3
Примем, что в избытке KCl. Образующиеся кристаллы AgCl находятся в ионном растворе, содержащем ионы К+, Сl-, NO3-, при условии ж(Cl-) >т(Сl-). Ионы Cl переходят из раствора в твердую фазу, т.е. адсорбируются на твердой поверхности кристалла, на границе раздела фаз не возникает необходимость для равновесия скачка потенциала. Поверхность кристалла при этом приобретает отрицательный заряд. Поскольку согласно правилу Фаянса - Панета – Пескова на кристалле адсорбируются ионы общей природы с ионами кристалла или изоморфные им, т.е. способные достраивать кристаллическую решетку.

В нашем случае адсорбция ионов Cl- происходит за счет химических сил, приводящих к прочному присоединению их к кристаллу. Оставшиеся в растворе ионы К+ электростатически притягиваются к поверхности и восстанавливают нарушения электронейтральности системы. Однако прочно к поверхности они не присоединяются, а так как их концентрация около поверхности больше, чем в растворе, то они диффундируют в сторону меньшей концентрации, т.е. от поверхности в раствор. На поверхности кристалла возникает двойной электрический слой (ДЭС), имеющий следующее строение:
ДЭС состоит из внутренней обкладки или адсорбционного слоя (ионы Cl-) и наружной обкладки или слоя противоионов (ионы К+). Часть противоионов связано с поверхностью относительно прочно и входит в плотный слой. Остальные противоионы, совершающие тепловое движение около поверхности, составляют диффузионную часть двойного электрического слоя (ДЭС). Распределение противоионов плотной и диффузной частей определяется соотношением между электростатическими притяжением ионов к поверхности и их диффузии в растворе. Последнее определяется тепловым движением ионов и зависит от разности концентрации в двойном электрическом слое (ДЭС) и объеме раствора. Если для реакции взять избыток AgNO3, то внутренняя обкладка двойного электрического слоя (ДЭС) будет состоять из ионов Ag, а противоположными будет NO3. Примером двойного электрического слоя (ДЭС), образованного путем поверхностной диссоциации, является двойной электрический слой (ДЭС), возникающий на поверхности стекла в H2O за счет катионов К, Na и т.п. Таким образом, поверхность стекла в H2O заряжается отрицательно. Растворение материала поверхности и возникновение на ней двойного электрического слоя (ДЭС) можно вызвать добавлением веществ, реагирующих с поверхностью. Например, амфотерный Al(OH)3 в присутствии кислоты заряжается положительно, а в щелочи отрицательно.
![]() Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . +HCl . Al(OH)2Cl . Al(OH)2+ Cl-
![]()
![]() Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-
Al(OH)3 . . Al(OH)2Cl . Al(OH)2+ Cl-

В пределах двойного электрического слоя (ДЭС) действует электрическое поле, интенсивность которого характеризуется значением потенциала. На рис. 2.5.1.1 показано изменение потенциала двойного электрического слоя (ДЭС) на кристалле AgCl с увеличением расстояния от поверхности. Потенциал на поверхности частицы называется термодинамическим потенциалом. Он характеризует скачок потенциала на границе раздела между фазами. Ионы в слое противоионов (плотного слоя) приближаются к поверхности на расстояние, определяемое собственными размерами. Воображаемая поверхность, проведенная через их центры, называется плоскостью максимального приближения и расположена на расстоянии порядка молекулярных размеров, а потенциал плоскости равен . Смещение фаз в дисперсной системе относительно друг друга вызванное внешними силами (электрическое поле) происходит по поверхности скольжения, которая не всегда совпадает с плоскостью максимального приближения и обычно расположена на бόльшем расстоянии от поверхности. Потенциал на поверхности скольжения называется электрокинетическим потенциалом или zпотенциалом. Его можно рассчитать из электрокинетических экспериментов. Его значение зависит от числа не скомпенсированных на поверхности скольжения зарядов адсорбционного слоя, т.е. числа ионов в диффузионном слое. Падение потенциалов в плотной части двойного электрического слоя (ДЭС) имеет линейный характер. В диффузной части двойного электрического слоя (ДЭС) для слабо заряженных поверхностей изменение потенциалов с расстоянием подчиняется экспоненциальной зависимости

где j0- потенциал поверхности;
c- параметр Дебая;
r - характеристическая величина атмосферы, расстояние, на котором действуют адсорбционные силы;
х - расстояние от поверхности, толщина двойного электрического слоя (ДЭС).
![]() ,
,
где z – заряд.
Существует несколько правил для составления мицелл:
1. Основа мицеллы – агрегат, нерастворимый в данной дисперсионной среде, состоящий из множества (m) молекул (атомов) простого вещества (осадка).
![]()
![]() mAg3AsO3 × nAsO33- × 3(n-x)Na+-3x×3xNa+
mAg3AsO3 × nAsO33- × 3(n-x)Na+-3x×3xNa+
Агрегат Потенциал- Противо- Ионы
определяю- ионы диффузионного
![]() щие ионы адсорбции- слоя
щие ионы адсорбции- слоя
онного слоя
![]()
![]() Ядро мицеллы
Ядро мицеллы
Адсорбционный слой Диффузион-
![]() ный слой
ный слой
Коллоидная частица
Здесь m, n, x – натуральные числа;
m – число молекул в агрегате;
n – число потенциалопределяющих ионов;
(n – x) – число противоионов адсорбционного слоя;
x – число противоионов диффузного слоя.
Численный коэффициент 3 перед (n – x) и х поставлен ввиду трехос-новности аниона AsO33-.
2. Согласно правилу Пескова-Фаянса-Панета, на поверхности агрегата адсорбируются ионы электролита-стабилизатора, входящие в состав агрегата, либо имеющие общую природу с ним, либо специфически взаимодействующие с ним и находящиеся в избытке. Ионы, сообщающие агрегату поверхностный заряд, называются потенциалопределяющими. Агрегат + потенциалопределяющие ионы = ядро мицеллы.
3. Заряд ядра компенсируется эквивалентным количеством противоположно заряженных ионов электролита-стабилизатора – противоионов. Часть противоионов, прочно связанных с ядром, входит в адсорбционный слой. Агрегат + адсорбционный слой = коллоидная частица (имеет заряд).
4. Остальная часть противоионов образует диффузионный слой.
5. Суммы электрических зарядов коллоидной частицы и диффузионного слоя равны друг другу по абсолютной величине и противоположны по знаку.
6. Электрический заряд коллоидной частицы равен алгебраической сумме электрических зарядов потенциалопределяющих ионов и противоионов адсорбционного слоя.
7. Мицелла гидрофобного золя является электронейтральной, т.е. алгебраическая сумма электрических зарядов ионов всех слоев равна нулю
Для любого типа реакции одно из исходных веществ берут в избытке по сравнению со стехиометрически необходимым соотношением:
Na3AsO3 + 3AgNO3 → ↓Ag3AsO3 + 3NaNO3
избыток осадок
Электролитическая диссоциация электролита, взятого в избытке:
Na3AsO3 « 3Na+ + AsO33-
Заряд коллоидной частицы определяется так (правило 6):
n(-3) + 3(n – x)(+1) = -3x
Для проверки правильности записи формулы мицеллы подсчитывают алгебраическую сумму зарядов всех ионов (правило 7):
n(-3) + 3(n – x)(+1) + 3х(+1) = 0
Коллоидная частица имеет отрицательный заряд, мицелла в целом электронейтральна.
Похожие работы
... )/2 (4.3) Так как смачивание количественно характеризуется косинусом краевого угла, то в соответствии с уравнением (4.3) оно определяется отношением работы адгезии к работе когезии д.ля смачивающей жидкости. Принципиальное различие между поверхностными явлениями адгезии и смачивания состоит в том, что смачивание имеет место при наличии трех сопряженных фаз. Из уравнения (4.3) можно сделать ...
... плотности припоя: . Отличие расплавов припоев от обычных жидкостей состоит в том, что жидкий припой представляет собой систему, состоящую из нескольких компонентов, и в процессе его растекания происходит физико-химическое взаимодействие компонентов и основного металла, дополнительное растворение элементов основного металла в припое, взаимодействие с газовыми и флюсующими средами. При вытеснении ...
... 1,63 89,6 78,7 84,2 276 281 278,5 Рис. 4.13. График зависимости укрывистости оттиска от температуры Рис. 4.14. График зависимости прочности к истиранию от деформации 5. Анализ результатов исследования процесса тиснения Исследования процесса тиснения фольгой на дизайнерском картоне для косметической продукции показали, что для каждого вида дизайнерской бумаги необходимо
... среде приведет в будущем к получению новых методов повышения отдачи нефти пластами, основанных на новых физических принципах. В качестве примера приложения теоретических основ физики нефтяного пласта к нефтепромысловой практике рассмотрим физические основы некоторых методов увеличения нефтеотдачи пластов. 4.1 Обработка поверхностно-активными веществами Необходимых изменений поверхностных и ...



0 комментариев