Навигация
Реакции окисления
3. Реакции окисления
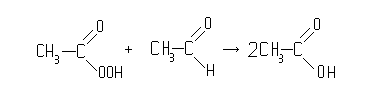
Ацетальдегид окисляются кислородом воздуха до уксусной кислоты. Промежуточным продуктом являются надуксусная кислота:
CH3CHO + O2![]() CH3CO-OOH
CH3CO-OOH
CH3CO-OOH + CH3CHO![]() CH3-C-O-O-CH-CH3
CH3-C-O-O-CH-CH3![]()
O OH
2CH3COOH
Аммиачный раствор гидроксида серебра при легком нагревании с альдегидами окисляет их в кислоты с образованием свободного металлического серебра. Если пробирка, в которой идет реакция, была предварительно обезжирена изнутри, то серебро ложится тонким слоем на ее внутренней поверхности - образуется серебряное зеркало [16, 173]:
CH3 CHO + 2[Ag(NH3)2]OH![]() CH3COONH4 + 3NH3 + H2O + 2Ag
CH3COONH4 + 3NH3 + H2O + 2Ag
4. Реакции полимеризации
При действии на ацетальдегид кислот происходит его тримеризация, образуется паральдегид:
CH – CH3
O O
3CH3CHO![]() СH3 – CH CH – CH3
СH3 – CH CH – CH3
O
5. Галогенирование
Ацетальдегид реагирует с бромом и иодом с одинаковой скоростью независимо от концентрации галогена. Реакции ускоряются как кислотами, так и основаниями.
CH3CHO + Br2![]() CH2BrCHO + HBr
CH2BrCHO + HBr
6. Декарбоксилирование
При нагревании с трис(трифенилфосфин)родийхлоридом претерпевают декарбонилирование с образованием метана:
CH3CHO + [(C6H5)P]3RhCl![]() CH4 + [(C6H5)3P]3RhCOCl
CH4 + [(C6H5)3P]3RhCOCl
7. Конденсация
7.1 Альдольная конденсация
В слабоосновной среде (в присутствии ацетата, карбоната или сульфита калия) ацетальдегид подвергаются альдольной конденсации по А. П. Бородину с образованием альдегидоспирта (3-гидроксибутаналя), сокращенно называемого альдолем. Альдоль образуется в результате присоединения альдегида к карбонильной группе другой молекулы альдегида с разрывом связи С — Н в α-положеиии к карбонилу:
CH3CHO + CH3CHO ![]() CH3–CHOH–CH2–CHO
CH3–CHOH–CH2–CHO
Альдоль при нагревании (без водоотнимающих веществ) отщепляет воду с образованием непредельного кротонового альдегида (2-бутеналя) [16, с. 176]:
CH3–CHOH–CH2–CHO![]() CH3–CН=CH–CHO + Н2О
CH3–CН=CH–CHO + Н2О
Поэтому переход от предельного альдегида к непредельному через альдоль называется кротоновой конденсацией. Дегидратация происходит благодаря очень большой подвижности водородных атомов в α-положении по отношению к карбонильной группе (сверхсопряжение), причем разрывается, как и во многих других случаях, р-связь по отношению к карбонильной группе.
7.2 Сложноэфирная конденсация
Проходит с образованием уксусноэтилового эфира при действии на ацетальдегид алкоголятов алюминия в неводной среде (по В. Е. Тищенко):
O
2CH3CHO![]() CH3–CH2–O–C–CH3
CH3–CH2–O–C–CH3
7.3 Конденсация Клайзена— Шмидта.
Эта ценная синтетическая реакция состоит в катализируемой основаниями конденсации ароматического или иного альдегида, не имеющего водородных атомов, с алифатическим альдегидом или кетоном. Например, коричный альдегид может быть получен встряхиванием смеси бензальдегида и ацетальдегида примерно с 10 частями разбавленной щелочи и выдерживанием смеси в течение 8—10 суток. В этих условиях обратимые реакции приводят к двум альдолям, но один из них, в котором 3-гидроксил активирован фенильной группой, необратимо теряет воду, превращаясь в коричный альдегид[18, с. 554]:
C6H5—CHO + CH3CHO![]() C6H5–CHOH–CH2–CHO
C6H5–CHOH–CH2–CHO ![]()
![]() C6H5–CH=CH–CHO
C6H5–CH=CH–CHO
1.3.3.3 Химические свойства кислорода
Кислород обладает высокой химической активностью, особенно при нагревании и в присутствии катализатора. С большинством простых веществ он взаимодействует непосредственно, образуя оксиды. Лишь по отношению к фтору кислород проявляет восстановительные свойства.
Подобно фтору кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). С галогенами, криптоном, ксеноном, золотом и платиновыми металлами он непосредственно не реагирует, и их соединения получают косвенным путем. Со всеми остальными элементами кислород соединяется непосредственно. Эти процессы обычно сопровождаются выделением теплоты.
Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений принимается равной -2. Кроме того, кислороду приписывают степени окисления +2 и + 4, а также +1(F2O2) и -1(Н2О2) [17, с. 337].
Наиболее активно окисляются щелочные и щелочноземельные металлы, причем в зависимости от условий образуются оксиды и пероксиды:
О2 + 2Са = 2СаО
О2 + Ва = ВаО2
Некоторые металлы в обычных условиях окисляются лишь с поверхности (например, хром или алюминий). Образующаяся пленка оксида препятствует дальнейшему взаимодействию. Повышение температуры и уменьшение размеров частиц металла всегда ускоряют окисление. Так, железо в нормальных условиях окисляется медленно. При температуре же красного каления (400 °С ) железная проволока горит в кислороде:
3Fe + 2О2 = Fe3 O4
Тонкодисперсный железный порошок (пирофорное железо) самовоспламеняется на воздухе уже при обычной температуре.
С водородом кислород образует воду:
Н2 + O2 = Н2O
При нагревании сера, углерод и фосфор горят в кислороде. Взаимодействие кислорода с азотом начинается лишь при 1200 °С или в электрическом разряде:
N2 + O2 = 2NO
Водородные соединения горят в кислороде, например:
2H2S + ЗО2 = 2SO2 + 2Н2О (при избытке О2)
2Н2S + О2 = 2S + 2Н2О (при недостатке О2)
СН4 + 2О2 = СО2 + 2Н2О
Похожие работы
... кислота производилась также пиролизом ацетона через кетен, окислением узких фракций бензина, а также выделением из продуктов окисления твердого парафина. В результате развития синтетических методов производства уксусной кислоты удельный вес их вырос с 50% в 1963 г. до 70% в 1965 г. и до 90% в 1970 г. За эти же годы общий объем производства уксусной кислоты в стране вырос в три раза. В 1963 г. ...
... уксусная кислота применяется в химической, фармацевтической и легкой промышленности, а также в пищевой промышленности в качестве консерванта. Формула СН3СООН. Синтетическая пищевая уксусная кислота выпускается концентрированной (99.7 %) и в виде водного раствора (80 %). По физико-химическим показателям синтетическая пищевая уксусная кислота должна соответствовать следующим нормам: Таблица ...
... , похожих на лед; вследствие этого безводная уксусная кислота получила название ледяной уксусной кислоты. Уксусная кислота имеет большое народнохозяйственное значение. Она широко применяется в самых различных отраслях промышленности и в быту. В химической промышленности уксусная кислота используется для получения винилацетата, ацетата целлюлозы, красителей и многих других веществ. В виде солей ...
... группа в карбоксиле кислот может быть замещена различными атомами или группами (Х); образующиеся при этом вещества обычно называют функциональными производными карбоновых кислот; строение их может быть представлено общей формулой R—C—X II O Мы кратко рассмотрим образование и свойства таких производных кислот, или галогенангидриды, ангидриды, ...

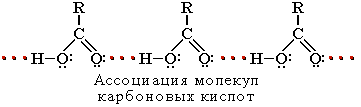
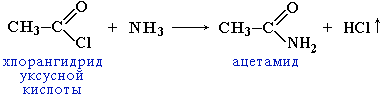
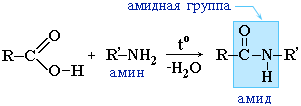
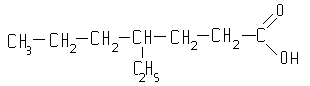
0 комментариев