Навигация
Переваги ПЛР-діагностики інфекційних захворювань тварин
3. Переваги ПЛР-діагностики інфекційних захворювань тварин
Метод дозволяє досягти гранично можливої чутливості: від одного до декількох збудників в пробі. Специфічність методу складає 99-100 відсотків. Для ПЛР-аналіза придатний будь-який матеріал, у тому числі і гістологічні препарати. Кількість досліджуваного матеріалу, як правило, складає декілька десятків мікролітів. Висока чутливість методу дозволяє контролювати ефективність лікування, що проводиться. ПЛР успішно використовується при діагностиці важкокультивованих і некультивованих збудників, а також хронічних, латентних і персистентных форм інфекції. Тривалість аналізу не перевищує 5-6 годин.
Але разом з перевагими є певний недолік, який можна охарактеризувати як технологічний. Маються на увазі підвищені вимоги до оснащення лабораторії, якості тест-наборів і строге дотримання регламенту дослідження щоб уникнути отримання помилкових результатів. Вирішення проблеми якості аналізів можливо при відповідній кваліфікації персоналу і обов'язкової сертифікації лабораторії.
Розробка методик і випробування приладів і устаткування — один з етапів великої роботи по впровадженню ПЛР-методів в практику діагностичних лабораторій. У зв'язку із зростаючим інтересом до ПЛР-діагностики впровадження її методів в систему державної ветеринарної служби — справа сьогоднішнього дня. Необхідно відзначити, що перспективними напрямами є визначення антибіотикорезистентності клінічних штамів збудників, можливість кількісного обліку результатів для контролю динаміки інфекційного процесу, правильного вибору тактики лікування і оцінки ефективності вживаних лікарських засобів.
До теперішнього часу ветеринарними фахівцями вже розроблені тест-системи для діагностики методом ПЛР таких захворювань, як туберкульоз, сибірська виразка, лейкоз, чума великої рогатої худоби, сказ, ящур, бруцельоз, кампилобактеріоз, лістеріоз, хламідіоз тварин, класична чума свиней, респіраторно-репродуктивний синдром свиней, парвовірусна інфекція свиней, енцефаломіокардит свиней, сальмонельоз, стафилококкоз, мікоплазмоз, хвороба Марека, реовирусная інфекція, хвороба Гамборо, інфекційний бронхіт птахів, ньюкаслська хвороба; чума м'ясоїдних, вірусний ентерит норок, вірусний гепатит качок та ін. [4].
Діагностика приватної патології методом ПЛР. У даному розділі розглянуті тільки деякі види патології, при яких цей метод грає важливу роль. Слід зазначити, що дана діагностика — один із способів і не може повністю замінити вживаний в даний час комплекс діагностичних досліджень.
Серед методів лабораторної діагностики грипу птахів найбільш ефективним вважається метод полімеразної ланцюгової реакції. Використовуючи праймери до НА, NA і М-генам різних субтипів вірусу грипу, Zhang W. і Evans D.N. (1991 р.) вперше продемонстрували можливість детекції вірусів. Проте дослідження були виконані на музейних штамах.
Головними перевагами ПЛР порівняно з методами культурального підходу є його вища чутливість, швидкість і безпека для персоналу. При порівнянні з серологічними методами ПЛР істотно виграє, оскільки дозволяє виявляти віруси грипу на найраніших стадіях, задовго до появи антитіл.
Окрім явних діагностичних переваг, його доповнюють методом секвенування ДНК, і тоді він є універсальним молекулярно-генетичним підходом до визначення більшості біологічних властивостей вірусів грипу птахів, що дозволяє виявляти спорідненість циркулюючих штамів, передбачати його небезпеку для людини і ефективність противірусної терапії [2].
Хламідіозная інфекція широко поширена практично серед всіх видів ссавців і завдає істотного економічного збитку різним галузям тваринництва, викликаючи загибель тварин, патологію їх репродуктивних органів, аборти, народження мертвого або нежиттєздатного приплоду.
Хворі тварини часто стають джерелом інфекції працівників господарств, що приводить до виникнення епідемічних спалахів. Поширеність збудників хламідіозов в природі серед диких тварин і особливо птахів представляє постійну загрозу спорадичних захворювань для людей, професійно не зайнятих в сільському господарстві.
Тривалий час загальновизнаним еталоном для прямих методів виявлення хламідій вважається виділення збудника в культури клітин. Проте метод має недоліки, що істотно обтяжує його широке використання в практичній ветеринарії. Перш за все високий ризик інфікування персоналу, а отже, необхідність проведення робіт по виділенню збудника в спеціальній режимній лабораторії.
Крім того, культуральний метод трудомісткий і займає багато часу. Не дивлячись на те, що для висіву патогена підходить практично будь-який матеріал від інфікованої тварини, успіх дослідження багато в чому залежить від швидкості транспортування проб в лабораторію і дотримання умов доставки зразків (спеціальні транспортні середовища, охолоджування, додавання антибіотиків, попереднє очищення матеріалу від токсичних речовин і так далі).
З урахуванням цих недоліків були розроблені альтернативні тести, такі, як визначення антигена методами іммуноферментного аналізу (ІФА), прямій імунофлуоресценції (МФА), а також експрес-методами.
Разом з тим для Іфа-детекциі антигенів так само, як і для культурального методу, характерні низька чутливість і специфічність. Враховуючи, що при проведенні методу імунофлуоресценції для достовірного виявлення хламідій необхідно виявити певне число елементарних тілець у всьому досліджуваному зразку, чутливість аналізу залежить від досвіду роботи лаборанта.
В даний час одним з найбільш перспективних слід рахувати метод полімеразної ланцюгової реакції (ПЛР). Для діагностики хламидиозов людини і тварин він був вперше застосований в 1989 році. Це швидкий і надійний діагноз, своєчасна ефективна терапія і науково обгрунтована профілактика. Додаткова інформація про різновид збудника, легко отримувана методом ПЛР, дозволить проводити епідеміологічний контроль і запобігати розповсюдженню небезпечних штамів хламідій [3].
Сьогодні основним масовим і доступним у ветеринарній практиці методом прижиттєвої діагностики туберкульозу є внутрішньошкірна проба із застосуванням ППД-туберкуліна для ссавців. Проте даний тест має відомі недоліки: тривалий термін виявлення захворювання; збудник туберкульозу при посіві патолого-анатомического матеріалу росте поволі; колонії мікобактерій туберкульозу бичачого вигляду з'являються тільки через 20-60 днів, а пташиного — через 15-30 днів посіву. При адаптації до живильного середовища швидкість росту може зростати.
При діагностиці туберкульозу ПЛР-метод застосовують у разі отримання позитивних результатів при проведенні планових алергічних досліджень в благополучних по туберкульозу господарствах. Кров всіх тварин аналізують при введенні туберкуліну. Також полімеразну ланцюгову реакцію доцільно застосовувати при вивченні патматериала від вбитих тварин для діагностики і ідентифікації культур М. Bovis і М. Tuberculosis з іншими видами мікобактерій [1].
Висновки
Отже, активний розвиток і впровадження методу ПЛР в діагностичну практику дозволив продемонструвати основні переваги і ефективність цієї реакції, виявити недоліки і виробити підходи для їх подолання.
Таким чином, висока чутливість і специфічність ПЛР-метода дозволяє гарантовано виявляти одиничних збудників в біологічному матеріалі за короткий проміжок часу, що дозволяє поставити точний діагноз, призначити адекватне лікування і розробити профілактичні заходи.
На закінчення слід зазначити, результати ПЛР-анализу, як і інші діагностичні тести in vitro, необхідно розглядати з урахуванням даних, отриманих традиційними методами.
Для раціонального використання ПЛР у ветеринарній практиці потрібно визначити її місце, зважаючи на специфіку поставлених завдань і економічне обгрунтування для вирішення тих або інших проблем.
Список використаних джерел
1. http://www.webpticeprom.ru
2. http://www.medlinks.ru
3. http://www.veterinarka.ru
4. http://www.vetotvet.com
Похожие работы
... осіменіння. Проведення планових, технологічних та вимушених дезінфекцій забезпечується силами служби ветеринарної медицини господарства. РОЗДІЛ 5. КЛІНІКО-МОРФОЛОГІЧНА ДІАГНОСТИКА ТА РОЗПОВСЮДЖЕННЯ ЛЕЙКОЗУ ВЕЛИКОЇ РОГАТОЇ ХУДОБИ У СВК «РУЖИНСЬКИЙ» РУЖИНСЬКОГО РАЙОНУ ЖИТОМИРСЬКОЇ ОБЛАСТІ 5.1 Клінічне дослідження У СВК «Ружинський» згідно протиепізоотичного плану 12 січня 2007 року була ...
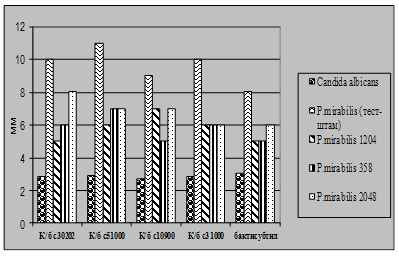
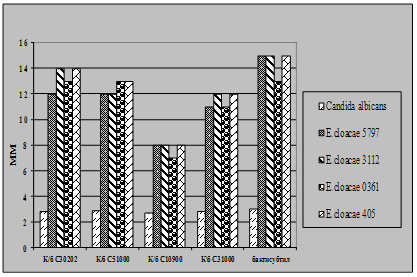
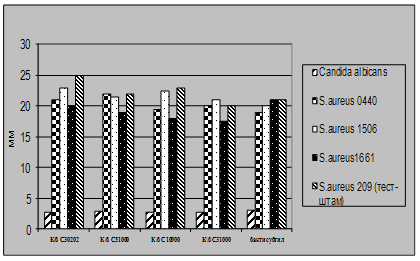
... і декстрин. Температурний оптимум росту 30°С, оптимум рН 7 –9,5 Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків. 3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів Пробіотики відіграють позитивну роль у підвищенні загальної ...
... хворобі Дауна. У 1969 р. Т.Каперсон запропонував диференціальне фарбування хромосом , що дало змогу розрізняти кожну з хромосом окремо і виявляти зміни їх. Великий внесок у вивчення загальної генетики людини зробили: М.П.Дубинін , Д.Д.Ромашов , А.А.Малиновський , В.П.Єфроїмсон , М.П.Бочков , І.Р.Барляк , М.А.Пілінський. В Україні питаннями медичної генетики займалися такі відомі вчені , як ...




0 комментариев