Навигация
Приготовление бактериальной суспензии
2.2.6 Приготовление бактериальной суспензии
В качестве источника углерода, используемого прокариотическими микроорганизмами в конструктивно-энергетическом обмене является жир и СПАВ. Приготовленную синтетическую среду подвергаем дробному автоклавированию (1; 0.5; 0.5 МПа) в течение 30 мин. По истечении данного времени, среды разливали в стерилизованные конические колбы по 50 см3.
Для получения биомассы исследуемой культуры микроорганизмов, выделенной в первой серии эксперимента, делаем посев на скошенный агар.
Подготовленные таким образом культуры инкубируем в термостате 24 ч при температуре (40±0,5)°С, по окончании чего в пробирки с микроорганизмами вводили 5 см 3 соответствующей жидкой синтетической среды, осуществляя процесс механического воздействия. Приготовленную таким образом бактериальную суспензию вносим в колбы, содержащие по 50 см3 соответствующей синтетической среды. Культивирование микроорганизмов проводили в течение различного времени при температуре (40±0,5)°С при переменном механическом воздействии, осуществляемом на Shaker Type, с частотой колебаний 250 об/мин, амплитудой 6 по 2 ч в сутки.
2.2.7 Определение мутности
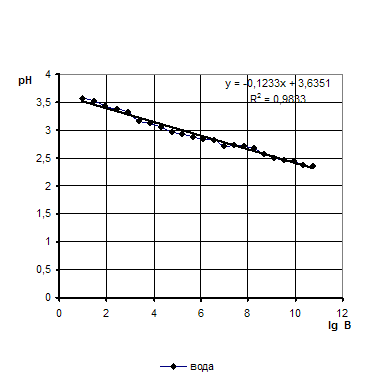
Мутность определяют фотометрическим способом на приборе КФК-2-УХЛ-4.2 при D2540 и толщине поглощаемого слоя 30 мм. Стандартным раствором является дистиллированная вода.
2.2.8 Высаливание фермента
В колбу отбирают 50 см3 бактериальной суспензии, добавляют 30% от ее массы сульфата аммония, перемешивают. Раствор и образующийся осадок переносят в патроны и устанавливают в центрифугу марки ЦЛН-2. Продолжительность вращения 15 мин со скоростью 5000 об/мин. После чего образовавшийся осадок собирают в бюкс.
2.2.9 Биуретовый метод по Ярош
Метод используется для определения раствора белков с концентрацией от 0,04 до 1,6 мг/см3.
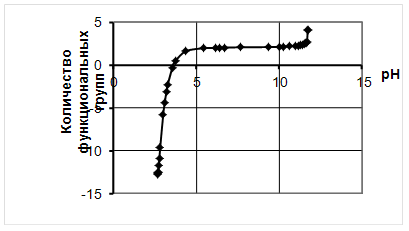
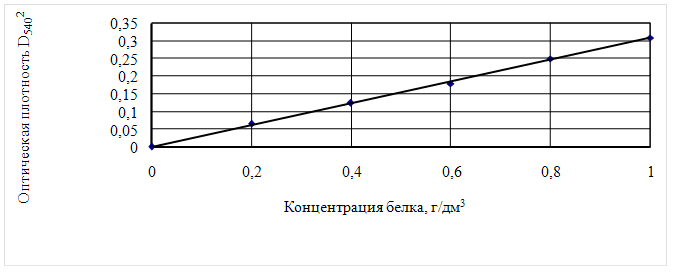
В пробирку наливают 2,4 см3 раствора мочевины, 0,1 см3 раствора белка и 2,5 см3 биуретового реактива. Смесь хорошо перемешивают и пробирки помещают в водяную баню или в термостат при 400С на 10 мин. Затем их охлаждают до 200С. Через 30 мин после добавления биуретового реактива раствор колометрируют при длине волны 540 нм. Количество белка находят по калибровочной кривой, составленной по яичному альбумину (рис. 1).
Для построения калибровочной кривой готовят исходные водные растворы с содержанием 15,20,25,30,35,40 и т.д. мг белка в 10 см3. Из полученных растворов отбирают в пробирки по 0,1 см3, добавляют 2,4 см3 раствора мочевины и 2,5 см3 биуретового раствора и ведут определений описанным выше методом.
2.2.10 Определение активности липазы (модифицированный метод Ота, Ямада)
За единицу ферментативной активности липазы принимают такое количество фермента, которое освобождает 1 мкмоль олеиновой кислоты из 40%-ной эмульсии оливкового масла при рН 7,0 и t=37°С в течение 1 ч.
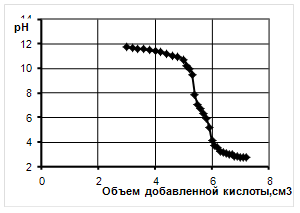
Метод основан на определении путем титрования щелочью жирных кислот, образовавшихся под действием липазы при использовании в качестве субстрата оливковое масло.
Для проведения этого анализа необходимы следующие реактивы: раствор оливкового масла (субстрат), 2%-ный раствор поливинилового спирта, 1н раствор соляной кислоты, 0,05н раствор щелочи, фосфатно-цитратный буфер с рН 7,0, 1%-ный раствор фенолфталеина, 90%-ный раствор спирта, 1%-ный раствор фермента.
Приготовление субстрата. 100 см3 оливкового масла смешивают со 150 см3 2%-ного раствора поливинилового спирта в эмульсаторе. Полученную эмульсию выдерживают на льду в течение 60 мин. Если расслаивания не наблюдается, субстрат пригоден к использованию.
Приготовление раствора поливинилового спирта. 20г спирта помещают в мерную колбу на 1 дм3 и добавляют 800 см3 дистиллированной воды. Суспензию выдерживают в течение 30 мин при комнатной температуре, затем добавляют 0,5 см3 1н раствора соляной кислоты и непрерывно перемешивают при температуре 80–90°С в течение 1 ч. Затем раствор охлаждают, доводят до рН 7,0 раствором щелочи, объем доводят до 1 дм3 дистиллированной водой и полученный раствор фильтруют.
5 см3 эмульсии – субстрата и 4 см3 буфера с рН 7,0 помещают в колбу на 100 см3, которую закрывают пробкой. Смесь выдерживают на водяной бане при температуре 37°С в течение 10 мин. Затем к смеси добавляют 1 см3 раствора фермента и хорошо перемешивают. Полученную смесь выдерживают при температуре 37°С в течение 60 мин, после чего немедленно добавляют 30 см3 этанола для прекращения реакции. Раствор титруют 0,05н раствором щелочи в присутствии 1%-ного раствора фенолфталеина до появления окраски.
Контрольную пробу готовят следующим образом. К смеси субстрата и буфера с рН 7,0, выдержанной при температуре 37°С добавляют 30 см3 этанола, затем 1 см3 ферментного раствора и смесь немедленно титруют.
Разность между результатами титрования контрольной и опытной проб соответствует количеству 0,05н раствора щелочи, которое пошло на нейтрализацию жирных кислот, образовавшихся из оливкового масла под действием фермента.
Липазную активность фермента ЛС (в ед/г) определяют по формуле (1):
А ґТ
ЛС =– ґ 50, (1)
В
где ЛС – липазная активность фермента, ед/г;
А – разность между результатами титрования опытной и контрольной проб, см3;
Т – титр щелочи;
В-концентрация образца ферментного раствора, г/см3.
Похожие работы
... продукции, а значит, дает значительный экономический эффект. 2. Объекты и методы исследования Целью дипломной работы являлось изучение свойств бактериальной суспензии, с последующим применением в подготовительных процессах переработки мехового сырья. Для выполнения эксперимента был составлен сетевой график, представленный на рисунке 1. Применение ферментов в кожевенной и ...
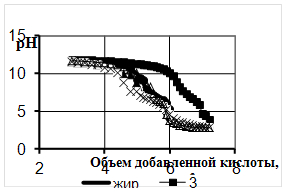
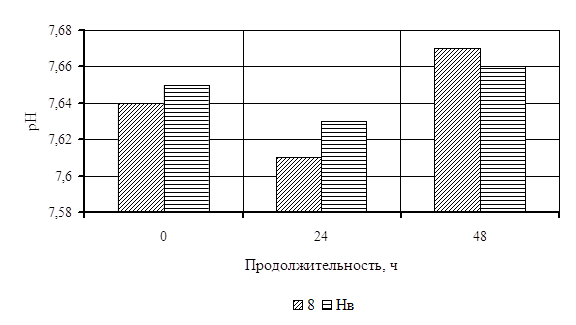
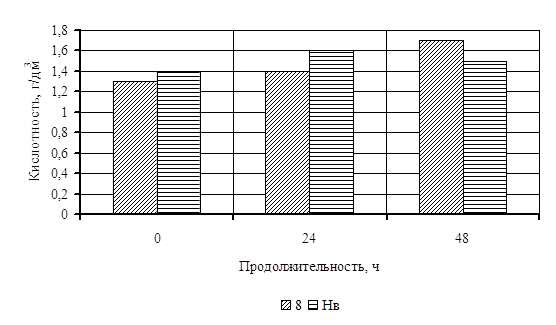
... Охрана окружающей среды Заключение Рисунок 2 – Сетевой график дипломной работы 2.1 Объекты исследования Объектом исследования в дипломной работе являлись микроорганизмы, выделенные из различных природных жиров: нерпичьего (Н), нерпичьего, выращенного на среде с шёрстным жиром (Нв), шерстного (В) и микроорганизмы, выделенные из ...



0 комментариев